- •Конструкционные материалы для деталей технических устройств железнодорожного транспорта
- •А.Д. Верхотуров
- •Введение
- •1. Общие сведения о металлах и сплавах
- •1.1. Определение и классификация металлов
- •1.2. Строение металлов
- •1.3. Полиморфные превращения металлов
- •1.4. Дефекты строения кристаллов
- •1.4.1. Точечные дефекты
- •1.4.2. Линейные дефекты
- •1.4.3. Поверхностные дефекты
- •1.5. Диффузия в металлах и сплавах
- •1.6. Деформации и механические свойства металлов
- •1.6.1. Механические свойства, определяемые при статических нагрузках
- •1.6.2. Механические свойства, определяемые при динамических нагрузках
- •1.7. Кристаллизация металлов
- •2. Основные положения теории сплавов
- •2.1. Виды сплавов
- •2.2. Диаграммы состояния двойных сплавов
- •2.2.1. Общие положения
- •2.2.2. Порядок построения диаграмм
- •Температуры начала и конца кристаллизации сплавов
- •2.2.3. Диаграмма состояния сплавов, компоненты которой образуют механические смеси (ι рода)
- •2.2.4. Правило отрезков
- •2.2.5. Диаграмма состояния сплавов, компоненты которой неограниченно растворимы в жидком и твердом состояниях (ιι рода)
- •2.2.6. Диаграмма состояния сплавов, компоненты которой неограниченно растворимы в жидком состоянии и ограниченно в твердом (III рода)
- •2.2.7. Диаграмма состояния сплавов, компоненты которой в твердом виде образуют устойчивые химические соединения (IV рода)
- •2.2.8. Связь между диаграммами состояний и свойствами двухкомпонентных сплавов
- •3.1.2. Компоненты, фазы, линии и точки диаграммы Fe–Fe3c
- •3.1.3. Перитектическое превращение
- •3.1.4. Эвтектоидное превращение
- •3.1.5. Эвтектическое превращение
- •3.2. Стали
- •3.2.1. Общая классификация
- •3.2.2. Углеродистые стали
- •Химический состав сталей
- •Сопоставление марок сталей типа «Ст» и «Fe» по международным стандартам исо 630-80 и исо 1052-82
- •3.2.3. Легированные стали
- •Обозначения легирующих элементов
- •3.2.4. Стали и сплавы с особыми физическими свойствами
- •3.3. Конструкционные чугуны
- •3.3.1. Серые чугуны
- •3.3.2. Высокопрочные чугуны
- •3.3.3. Ковкие чугуны
- •3.3.4. Специальные чугуны
- •4. Инструментальные материалы
- •Основные марки и области применения керамики
- •5. Термическая обработка сталей
- •5.1. Общие положения
- •5.2. Превращения в стали при нагреве
- •5.3. Превращения в стали при охлаждении
- •5.3.1. Перлитное превращение аустенита
- •5.3.2. Мартенситное превращение
- •5.3.3. Промежуточное (бейнитное) превращение аустенита
- •5.4. Технология термической обработки стали
- •5.4.1. Отжиг
- •5.4.2. Нормализация
- •5.4.3. Закалка
- •5.4.4. Отпуск закаленной стали
- •5.5. Особенности закалки легированных сталей
- •6. Химико-термическая обработка стали
- •6.1. Общие сведения
- •6.2. Цементация
- •6.3. Азотирование
- •6.4. Насыщение поверхностного слоя одновременно углеродом и азотом
- •6.5. Диффузионная металлизация
- •7. Цветные металлы и сплавы
- •7.1. Общие сведения
- •7.2. Алюминиевые сплавы
- •7.2.1. Классификация алюминиевых сплавов
- •7.2.2. Состав, структура и свойства алюминиевых сплавов
- •Химический состав деформируемых алюминиевых сплавов, не упрочняемых термической обработкой
- •Химический состав промышленных дюралюминов
- •Средний состав промышленных сплавов системы Al–Mg–Si (гост 4784-97)
- •Химический состав промышленных сплавов системы Al–Cu–Mg–Si (гост 4784-97)
- •Содержание легирующих элементов в сплавах системы Al-Zn-Mg-Cu (гост 4784-97)
- •Химический состав жаропрочных алюминиевых сплавов (гост 4784-97)
- •Химический состав литейных алюминиевых сплавов (гост 1583-93)
- •7.2.3. Термическая обработка алюминиевых сплавов
- •7.2.4. Применение алюминиевых сплавов
- •7.3. Медные сплавы
- •7.3.1. Классификация и обозначение медных сплавов
- •Обозначения легирующих элементов медных сплавов
- •7.3.2. Латуни
- •Химический состав и механические свойства деформируемых латуней (гост 15527-70)
- •Механические свойства литейных латуней (гост 17711-93)
- •7.3.3. Бронзы
- •Химический состав и механические свойства оловянных бронз
- •Свойства алюминиевых бронз
- •7.3.4. Медно-никелевые сплавы
- •Химический состав конструкционных и механические свойства медно-никелевых сплавов (гост 492-73)
- •7.3.5. Применение меди и ее сплавов
- •7.4. Сплавы на основе магния
- •Химический состав и механические свойства магниевых сплавов
- •7.5. Сплавы на основе титана
- •Химический состав (гост 19807-91), структура и механические свойства некоторых сплавов титана
- •7.6. Сплавы на основе никеля
- •7.7. Антифрикционные материалы
- •Характеристики антифрикционных материалов
- •Химический состав алюминиевых антифрикционных сплавов
- •Состав и свойства стандартных литых цинковых сплавов
- •7.8. Фрикционные материалы
- •Состав и свойства фрикционных материалов на железной основе
- •Состав фрикционных материалов на медной основе, %
- •7.9. Припои
- •8. Неметаллические материалы
- •8.1. Пластмассы
- •Свойства термопластичных масс
- •Свойства термореактивных пластмасс
- •8.2. Резины
- •9. Материалы, используемые на железнодорожном транспорте
- •10. Задания на самостоятельные работы
- •10.1. Общие требования
- •Варианты заданий
- •10.2. Работа № 1 по разделу «Железоуглеродистые сплавы»
- •10.2.1. Вопросы к работе № 1
- •10.2.2. Задачи к работе № 1
- •Исходные данные для решения задач
- •10.3. Работа № 2 по разделу «Термическая обработка стали»
- •10.3.1. Вопросы к работе № 2
- •10.3.2. Задачи к работе № 2
- •Исходные данные для решения задач
- •Заключение
- •Библиографический список
- •Первая группа сталей по стандарту en 10027
- •1.1.2. Вторая группа
- •Вторая группа сталей по стандарту en 10027
- •1.2. Порядковые номера
- •Нумерация сталей по стандарту en 10027
- •Приложение 2
- •1. Системы маркировки сталей в сша
- •1.1. Система обозначений aisi
- •Обозначения углеродистых и легированных сталей в системе aisi
- •Дополнительные буквы и цифры в обозначениях коррозионно-стойких сталей по системе обозначений aisi
- •1.2. Система обозначений astm
- •1.3. Универсальная система обозначений uns
- •Обозначения сталей в системе uns
- •Соответствие символов aisi и uns
- •1.1.2. Углеродистые качественные стали
- •1.1.3. Стали для поковок
- •1.1.4. Стали для производства листового проката
- •1.1.5. Стали для производства труб
- •1.1.6. Арматурные стали
- •1.1.7. Стали для производства катанки
- •1.5. Жаропрочные стали
- •Оглавление
- •Конструкционные материалы для деталей технических устройств железнодорожного транспорта
- •6 80021, Г. Хабаровск, ул. Серышева, 47.
3.1.2. Компоненты, фазы, линии и точки диаграммы Fe–Fe3c
Компоненты сплавов. Основными компонентами железоуглеродистых сплавов являются железо и углерод.
Железо (лат. Ferrum) открыто в III тысячелетии до н.э., это химический элемент VIII группы периодической системы Менделеева, атомный номер 26, атомный радиус 0,127 нм, атомная масса 55,8; плотность 7,83 г/см3. Блестящий серебристо-белый металл с температурой плавления 1539 °С. Широко распространено в природе, занимая второе место (после алюминия) среди металлов.
Железо имеет аллотропные модификации (рис. 40), которые различаются по кристаллической структуре или по магнитным свойствам. При температуре ниже 768 °С устойчиво ферромагнитное -железо с объемно-центрированной кубической решеткой (ОЦК). При 768 °С (точка Кюри) железо становится парамагнитным, решетка остается той же. Между 911 °С и 1392 °С устойчиво -железо с гранецентрированной кубической решеткой. Выше 1392 °С вновь образуется ОЦК-решетка.
Железо является важнейшим металлом современной техники, хотя в чистом виде практически не используется по причине низких прочностных характеристик. Оно необходимо для жизнедеятельности многих живых организмов, в том числе и человека (входит в состав гемоглобина).
Способность железа растворять углерод и другие элементы служит основой для получения разнообразных сплавов, способных выдерживать воздействие высоких и низких температур, вакуума и высоких давлений, агрессивных сред, больших переменных напряжений, ядерных излучений и др. На долю таких сплавов приходится около 95 % всей металлической продукции (стали, чугуны, ферросплавы).
Углерод (лат. Carboneum) химический элемент IV группы периодической системы Менделеева, атомный номер 6, атомный радиус 0,077 нм, атомная масса 12,011, плотность 2,5 г/см3, температура плавления 3500 °С.
Основные кристаллические модификации углерода – алмаз и графит. В решетке алмаза все атомы углерода соединены между собой очень прочными связями и образуют в пространстве непрерывный трехмерный каркас (рис. 41, а). В графите атомы углерода располагаются параллельными слоями, причем атомы внутри слоя связаны между собой сильнее, чем один слой с другим (рис. 41, б).
В соединениях с железом углерод приобретает металлические свойства. Он может растворяться в решетке железа по механизму внедрения, т. е. внедряться в межузельные пространства (поскольку атомный радиус углерода почти в два раза меньше, чем у железа), а также образовывать химические соединения Fe3C; Fe2C и др.
Алмаз – диэлектрик, графит – хороший проводник электрического тока. Алмаз химически весьма стоек, графит при обычных условиях химически инертен, а при высоких температурах соединяется со многими элементами, является сильным восстановителем.

Рис. 41. Кристаллические решетки: а – алмаза; б – графита
Содержание углерода в земной коре 6,5·1016 т. Значительное количество (около 1013 т) входит в состав горючих ископаемых (уголь, природный газ, нефть и др.), а также в состав углекислого газа атмосферы (6·1011 т) и гидросферы (1014 т). Простейшие соединения углерода (диоксид углерода, метан) обнаружены в атмосфере почти всех планет Солнечной системы. Так, атмосфера Марса состоит в основном из диоксида углерода. Все организмы растений и животных построены из соединений углерода (средняя массовая доля углерода – 18 %).
Фазы системы Fe–Fe3C. Компоненты сплавов системы Fe–Fe3C образуют следующие фазы: жидкий раствор углерода в железе (ж), феррит (ф), аустенит (А) и цементит (ц).
Феррит (от лат. Ferrum железо) – твердый раствор внедрения углерода в -железе, имеющего ОЦК решетку. В ОЦК решетке имеются свободные места (так называемые поры) размерами 0,062 нм. Работы исследователей предполагают, что меньшая часть атомов углерода в
кристаллической решетке Fe находится в порах, а большая – на дефектах решетки (вакансиях, дислокациях). Максимальная растворимость углерода в низкотемпературном феррите составляет 0,02 % при 727 С, а в высокотемпературном -феррите 0,1 % при 1499 С. При комнатной температуре феррит содержит 0,006 % углерода.
В феррите могут быть растворены кремний, марганец, фосфор и другие элементы. При t = 911…768 С феррит парамагнитен, а от 768 С до абсолютного нуля – ферромагнитен.
Феррит мягок, пластичен, имеет следующие свойства: в = 250 МПа; = 50 %; = 80 %; КСU = 2,5 МДж/м2; НВ 80.
Микроструктура феррита представляет собой однородные зерна (рис. 42).
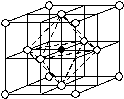
Аустенит (от имени английского ученого Робертса-Аустена) – твердый раствор углерода и других элементов в -железе, имеющего ГЦК решетку. Эта решетка в центре имеет пору диаметром 0,102 нм в которой атом углерода с несколько большим размером (0,154 нм) может поместиться, вызывая увеличение параметров -решетки. При этом сам атом уменьшается в размерах, отдавая валентные электроны. Искажение решетки ведет к уменьшению остальных ее пор, которые становятся недоступными для других атомов углерода. На рис. 43 показана схема строения элементарной ячейки аустенита, в которой растворен один атом углерода. Углерод в аустените находится в виде атомов, ионизированных дважды. В то же время атомы железа ионизированы однократно.
|
|
Рис. 42. Микроструктура феррита, × 500 |
Рис.
43. Кристаллическая решетка аустенита:
|
Максимальная растворимость углерода в аустените при t = 1147 °С равна 2,14 %. При снижении температуры растворимость уменьшается и при t = 727 С составляет 0,8 %.
При t = 727 С вследствие аллотропического превращения Fe → Fe и очень малой растворимости углерода в -железе аустенит распадается с образованием механической смеси феррита и цементита.
Рис.
44. Микроструктура аустенита, ×
500
Цементит – химическое соединение железа с углеродом (карбид железа Fe3C), содержит углерода 6,67 %, плотность 7,82 г/см3.
Кристаллическая решетка цементита очень сложная и состоит из ряда октаэдров, оси которых наклонены друг к другу (рис. 45). В вершинах октаэдров находятся атомы железа, каждый из которых принадлежит двум октаэдрам. Атом углерода находится в центре октаэдра.
Рис.
45. Кристаллическая решетка цементита:
– атомы железа;
– атомы углерода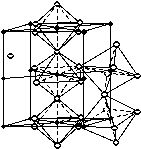
Температура плавления цементита (около 1250 С) точно не установлена, так как в процессе нагрева он разлагается, что и искажает результаты измерений.
Аллотропических превращений цементит не претерпевает, но при низких температурах он слабо ферромагнитен. Магнитные свойства теряются при t = 727 С.
Цементит имеет высокую твердость (НВ > 800, царапает стекло), но очень низкую (практически нулевую) пластичность.
Он способен образовывать твердые растворы замещения. Атомы железа могут замещаться атомами других металлов (хрома, марганца, вольфрама, молибдена и др.), а атомы углерода – неметаллами (азотом, кислородом), то есть образуется легированный цементит. Углерод в решетке цементита практически не растворяется.
Цементит неустойчив и при определенных условиях распадается на железо и углерод в виде графита, что имеет очень важное практическое значение.
В железоуглеродистых сплавах цементит может выделяться из жидкого раствора (в виде крупных равноосных зерен), из аустенита (в виде сетки по границам зерен) и из феррита (в виде очень мелких кристаллов по границам зерен). В первом случае цементит называется первичным (Ц I), во втором – вторичным (Ц II), в третьем – третичным (Ц III). Химические и физико- механические свойства всех трех типов цементита абсолютно одинаковы.
Основные точки и линии диаграммы Fe–Fe3C. Приводимые на диаграмме буквенные обозначения точек являются общепринятыми в международной практике (см. рис. 40).
Точка А (1539 С) соответствует температуре плавления чистого железа, а точка D (≈1250 С – приблизительной температуре плавления цементита. При температуре 1392 С (точка N) происходят полиморфные превращения Fe ↔ Fe, а при t = 911 °С (точка G) – полиморфные превращения Fe ↔ Fe.
Точка Р (727 С) соответствует максимальному содержанию углерода в -железе, а точка Е (1147 °С) – максимальному содержанию углерода в -железе.
При охлаждении аустенита с содержанием углерода 0,8 % в точке S (727 С) происходит его распад на механическую смесь феррита (имеющего 0,02 % углерода) и цементита вторичного. Такая смесь называется перлитом (франц. perlite, от Perle жемчуг) и обозначается символом П:А0,8 ↔ П (Ф0,02 + Ц II)
Следовательно, основными условиями образования перлита в железоуглеродистых сплавах являются содержание углерода в аустените 0,8 % и температура 727 С.
Перлит чаще всего имеет пластинчатое строение и является прочной структурной составляющей: в = 800…900 МПа, ≤ 16 %, НВ 180…220.
При охлаждении жидкого расплава с содержанием углерода 4,3 % в точке С (1147 оС) образуется механическая смесь аустенита с содержанием углерода 2,14 % и цементита первичного. Эта смесь называется ледебуритом (от имени немецкого металлурга А. Ледебура) и обозначается индексом Л: Л [А2,14 + Ц I].
При t = 20…25 °С ледебурит представляет собой смесь цементита и перлита. В этой структурной составляющей цементит образует сплошную матрицу, в которой размещены колонии перлита. Такое строение ледебурита служит причиной его большой твердости (НВ > 600) и хрупкости.
Линии диаграммы представляют собой семейство критических точек, в которых происходят какие-либо превращения в железоуглеродистых сплавах.
Линии АВСД и NJECF – соответственно линия ликвидус и линия солидус, показывают температуры начала и конца кристаллизации жидких сплавов. При температурах, соответствующих линии HJB, происходит перитектическое превращение. Линия МО (768 С) указывает на температуру перехода феррита из магнитного состояния в немагнитное при нагреве и наоборот при охлаждении. Это превращение не относится к разряду фазовой перекристаллизации. Линии GS и PG соответствуют температурам начала и конца полиморфного превращения феррита в аустенит при нагреве и аустенита в феррит при охлаждении. Линии QP и SE указывают на предельную растворимость углерода в - и -железе. Линия ECF (1147 С) – семейство точек, при которых протекает эвтектическое превращение в сплавах. Эвтектика (от греч. eutektos – легко плавящийся) – тонкая механическая смесь твердых фаз, одновременно закристаллизовавшихся из расплава. При охлаждении сплава с содержанием углерода 4,3 % в точке С образуется чистая эвтектика – ледебурит. Этот сплав называют эвтектическим чугуном. Чугуны с содержанием углерода менее 4,3 % называются доэвтектическими, а при содержании более 4,3 % – заэвтектическими.
Линия PSK (727 °С) – линия эвтектоидного превращения. Эвтектоид (от эвтектика и греч. eidos – вид) аналогичная эвтектике структурная составляющая металлических сплавов, но в отличие от нее образующаяся не из жидкой, а из твердой фазы и потому имеющая более тонкое дисперсное строение. Так при охлаждении аустенита с содержанием углерода 0,8 % в точке S образуется эвтектоид – тонкодисперсная механическая смесь феррита и цементита вторичного, называемая перлитом. Такой сплав именуется эвтектоидной сталью. Стали, имеющие углерода менее 0,8 % называются доэвтектоидными, а более 0,8 % – заэвтектоидными.
Таким образом, в системе «железо – цементит» происходят три изотермических превращения:
– перитектическое превращение на линии HJB (1499 С)
Фн + Жв → АJ;
– эвтектическое превращение на линии ECF (1147 С)
Жс → [АЕ + Ц I];
– эвтектоидное превращение на линии PSK (727 С)
АS → (ФР + Ц II).
Рассмотрим превращения в железоуглеродистых сплавах, которые происходят при медленном охлаждении от температуры плавления.