
- •Вопрос 110 Молекулярная структура миофибрилл. Структура и функции основных белков миофибрилл миозина, актина, тропомиозина, тропонина.
- •Вопрос 111 Биохимические механизмы мышечного сокращения и расслабления. Роль ионов кальция и других ионов в регуляции мышечного сокращения.
- •Вопрос 112 Саркоплазматические белки. Миоглобин, его строение и функции. Карнозин и анзерин. Особенности энергетического обмена в мышцах; роль креатинфосфата.
- •Вопросы 113 и 114
- •Вопрос 115 Медиаторы нервной системы: ацетилхолин, катехоламины, серотонин, γ-аминомасляная кислота, глицин, глутамат, гистамин. Физиологически активные пептиды мозга.
Вопрос 111 Биохимические механизмы мышечного сокращения и расслабления. Роль ионов кальция и других ионов в регуляции мышечного сокращения.
Биохимический цикл мышечного сокращения состоит из пяти фаз:
1. Толстые нити миозина скользят по тонким нитям актина за счет перемещения
головок миозина. Если с миозином не связана молекула АТФ, то головка миозина связывается с глобулой фибриллярного актина.
Если миозин связывает молекулу АТФ и гидролизует ее до АДФ и фосфата,
происходит циклическая серия конформационных превращений.
2. Содержащая АДФ и Н3РО4 миозиновая «головка» может свободно вращаться
под большим углом, и, достигая нужного положения, связываться с F-актином.
3. Взаимодействие обеспечивает высвобождение АДФ и Н3РО4 из
актин-миозинового комплекса.
4. Новая молекула АТФ связывается с комплексом миозин-F-актин
5. Комплекс миозин–АТФ обладает низким сродством к актину, и поэтому
происходит отделение миозиновой (АТФ) «головки» от F-актина.
Последняя стадия – это и есть расслабление, которое зависит от связывания АТФ с
актин-миозиновым комплексом. Затем цикл возобновляется.

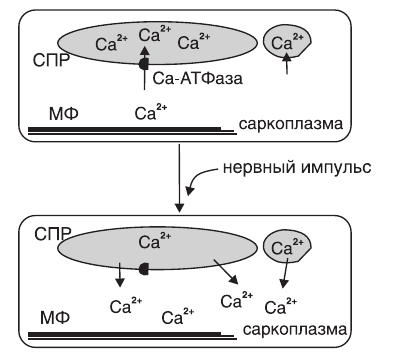
Миофибриллы обладают способностью взаимодействовать с АТФ и сокращаться
лишь при наличии в среде определенных концентраций ионов Ca2+.
При поступлении сигнала от двигательного нейрона мембрана мышечной клетки
деполяризуется, сигнал передается на кальциевые каналы СР. Са2+-каналы открываются, внутриклеточный уровень ионов Са2+ возрастает.
Ионы Сa2+ связывается с тропонином С, вызывая конформационную перестройку в
тропонине, что влечет за собой разрушение комплекса тропонин-тропомиозин и дает возможность головкам миозина связываться с актином. Происходит инициация актин-миозинового цикла.
По завершении сокращения уровень ионов Са2+ снижается за счет активного
обратного транспорта Са2+ в СР, тропонин С отдает Са2+, комплекс тропонин-тропомиозин занимает исходное положение на молекуле актина, блокируя актин- миозиновый цикл. Результат – расслабление мышцы
Вопрос 112 Саркоплазматические белки. Миоглобин, его строение и функции. Карнозин и анзерин. Особенности энергетического обмена в мышцах; роль креатинфосфата.
Саркоплазматические белки – миоглобин, миоальбумин, глобулин-кси
(глобулярные белки), миогеновая фракция (ферменты гликолиза, ЦТК, пентозофосфатного цикла).
1. Миоглобин – гемсодержащий белок, белок красных мышц, присутствует в
скелетной и сердечной мышце. Запасает кислород и отдает его только при очень интенсивной работе, т.к. имеет очень высокое сродство к кислороду.
Основная функция – транспорт в мышцы от гемоглобина кислорода с
поддержанием его оптимального градиента вблизи митохондрий.
Mb имеет очень большое сродство к O2. При парциальном давлении O2 – 40 мм
рт. ст. в венозной крови Mb полностью насыщен O2. И даже при низком ПД O2 – (10-20 мм рт. ст.) Mb почти полностью насыщен O2. Только при тяжелой физической работе ПД O2 может снизиться до 5 мм рт. ст., и Mb способен легко отдавать O2.
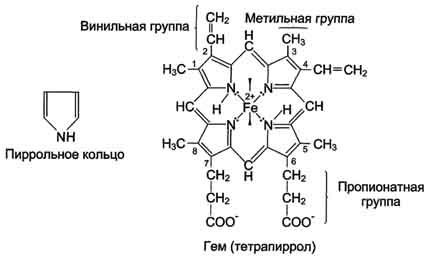
Строенение: содержит небелковую часть (гем) и белковую часть (апомиоглобин).
Гем – молекула, имеет структуру циклического тетрапиррола, 4 пиррольных
кольца соединены метиленовыми мостиками – содержит 4 метильные, 2 винильные и 2 пропионатные боковые цепи (в целом – протопорфирин).
4 атома азота пиррольных колец связаны с Fе2+, находящемся в центре молекулы
Апомиоглобин – белковая часть миоглобина
I структура: Одна полипептидная цепь – 153 аминокислоты
II структура: 8 α-спиралей (названия от А до Н)
III структура: компактная глобула, образованная за счет петель и поворотов в области несприрализованных участков
Связывание гема с апомиоглобином:
Гем – специфический лиганд апомиоглобина, присоединяющийся к белковой части
в углублении между двумя α-спиралями F и Е. Центр связывания с гемом образован преимущественно гидрофобными остатками АК, окружающими гидрофобные пиррольные кольца тема. Две боковые группы пропионовых кислот, ионизированные при физиологических значениях рН, выступают на поверхности молекулы.
В активный центр апомиоглобина кроме гидрофобных аминокислот входят также 2
остатка Гис (Гис64 и Гис93 или Гис Е7 и Гис F8), играющие важную роль в функционировании белка. Они расположены по разные стороны от плоскости тема и входят в состав спиралей F и Е, между которыми располагается гем.
Атом железа в теме может образовывать 6 координационных связей, 4 из которых
удерживают Fe2+ в центре протопорфирина IX (соединяя его с атомами азота пиррольных колец), а 5-я связь возникает между Fe2+ и атомом азота имидазольного кольца Гис F8
Гис Е7 хотя и не связан с гемом, но необходим для правильной ориентации и
присоединения О2 к миоглобину: свободный от белковой части гем имеет высокое сродство к СО (в 25.000 раз больше, чем к О2), но в миоглобине, имея белковое окружение, имеется Гис Е7, который нарушает оптимальное расположение СО в центре связывания и создает условия для связывания О2 (СО в рез-те имеется сродство к гему только в 200р больше и занимает только 1% гемсодержащих белков)
Гидрофобные остатки аминокислот, окружающие гем, препятствуют
проникновению в центр связывания миоглобина воды и окислению Fe2+ в Fe3+. Трёхвалентное железо в составе тема не способно присоединять О2.
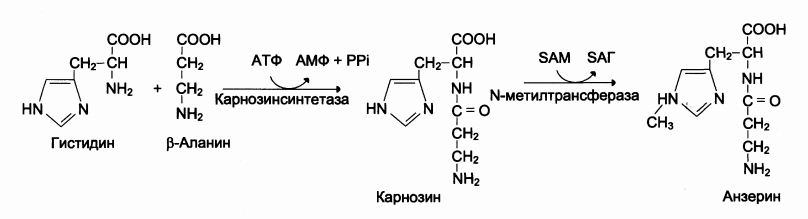
Карнозин и анзерин – гистидиновые дипептиды, синтезирующиеся в мышцах и ГМ.
Их много в скелетных мышцах
Карнозин образуется из β-аланина и гистидина под действием карнозинсинтетазы.
В присутствии SAM идет реакция метилирования карнозина под действием фермента N-метилтрансферазы и образуется анзерин.
Карнозин может поступать из мышц в кровь и поглощаться почками и энтероцитами.
В крови и почках присутствует Zn-зависимый фермент КАРНОЗИНАЗА,
способный гидролизовать карнозин на гистидин и β-аланин.
Карнозин увеличивает амплитуду сокращения скелетных мышц и активирует
работу ионных насосов мышечных клеток, стимулирует АТФ-азную активность миозина.
Карнозин и анзерин обладают антиоксидантной активностью, ингибируют NO-
зависимую гуанилатциклазу, замедляют процессы старения человека, влияя на скорость апоптоза.
Энергетический обмен в состоянии покоя очень низкий, при интенсивной
физической работе – значительно возрастает
В белых (быстрых) волокнах преобладает анаэробный гликолиз (субстрат глюкоза).
В красных (медленных) мышцах преобладает аэробное окисление жирных кислот, кетоновых тел и глюкозы.
Миокард в качестве субстратов для синтеза АТФ использует жирные кислоты
(65-70%), глюкозу (15-20%) и молочную кислоту (10-15%).
Основной потребитель АТФ – процесс мышечного сокращения.
Запасы АТФ быстро истощаются.
Источники АТФ:
Классический путь в реакциях субстратного и окислительного фосфорилирования
При участии миоаденилаткиназы: АДФ + АДФ = АТФ + АМФ
Креатинфосфатный челнок
Креатинкиназный путь ресинтеза АТФ является очень быстрым и максимально
эффективным, т.к. за счет каждой молекулы креатинфосфата образуется молекула АТФ.
Синтез креатина идет последовательно в почках и печени в 2х трансферазных
реакциях. По окончании синтеза креатин с током крови доставляется в мышцы или мозг.
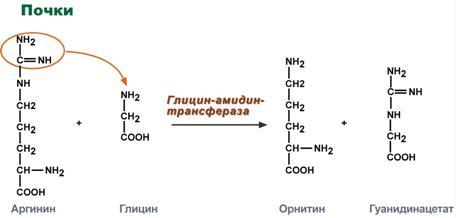
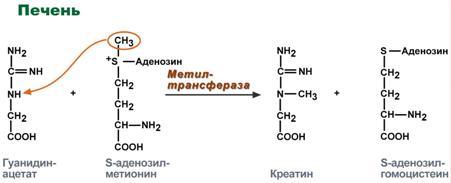
В мышцах и клетках мозга из него образуется креатинфосфат.
В виде креатинфосфата креатин является депо макроэргических связей, используется для быстрого ресинтеза АТФ во время работы клетки.
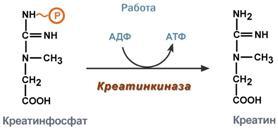
При мышечной работе ионы Са2+, высвободившиеся из СР, являются
активаторами креатинкиназы.
После завершения интенсивной работы запасы креатинфосфата восстанавл-ся в
почках и печени, при наличии энергии АТФ (во время покоя или отдыха) он фосфорилируется с образованием креатинфосфата.
Креатинурия развивается если синтез креатина опережает возможности его
фиксации в мышечной ткани (появление креатина в моче).
Физиологическая креатинурия наблюдается в первые годы жизни ребенка. Иногда
сюда же относят и креатинурию стариков, которая возникает как следствие атрофии мышц и неполного использования образующегося в печени креатина.
Патологическая кретинурия наблюдается при заболеваниях мышечной системы
(при миопатии или прогрессирующей мышечной дистрофии)
