
- •1 Электронтранспортная цепь: nadph-p450 редуктаза – цитохром р450
- •2 Электронтранспортная цепь:
- •Электронтранспортные цепи эр
- •Вопрос 103 Гемоглобины человека, структура. Транспорт кислорода и диоксида углерода. Гемоглобин плода и его физиологическое значение. Гемоглобинопатии.
- •1. Аллостерический ингибитор аминолевулинатсинтазы – гем
- •2. На уровне трансляции синтез фермента регулирует железо
Вопрос 100
Распад гема. Схема процесса, место протекания. «Прямой» и «непрямой»билирубин, его обезвреживание в печени. Билирубиндиглюкуронид, его превращения. Диагностическое значение определения билирубина в крови и моче.
Гемоксигеназа: NADPH-зaвиcимый ферментативный комплекс, локализованная в
мембране ЭР. Катализирует расщепление связи между двумя пиррольными кольцами => образуются линейный тетрапиррол биливердин (пигмент жёлтого цвета) и монооксид углерода (СО).
Ионы железа, освободившиеся при распаде гема, могут быть использованы для
синтеза новых молекул гемоглобина или для синтеза других железосодержащих белков.
Биливердин восстанавливается до билирубина биливердинредуктазой (NADPH-
зависимой). Дальнейший метаболизм билирубина происходит в печени.
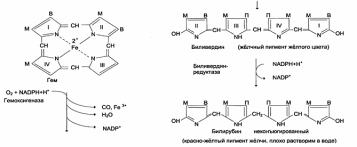
Неконъюгированный билирубин – билирубин, образованный в клетках РЭС (селезёнки и костного мозга), плохо растворим в воде, по крови транспортируется в комплексе с белком плазмы крови альбумином.
Комплекс «альбумин-билирубин», доставляемый с током крови в печень, на
поверхности плазматической мембраны гепатоцита диссоциирует. Высвобожденный билирубин образует временный комплекс с липидами плазматической мембраны.
Облегчённая диффузия билирубина в гепатоциты осущ-ся белками-переносчиками:
Лигандин (транспортируют основное кол-во билирубина)
Протеин Z
В гладком ЭР гепатоцитов к билирубину присоединяются (реакция конъюгации)
полярные группы от глюкуроновой кислоты. Билирубин имеет 2 карбоксильные группы, поэтому может соединяться с 2 молекулами глюкуроновой кислоты (УДФ- глюкуронат) под действием УДФ-глюкоуронилтрасфераз, образуя хорошо растворимый в воде конъюгат – диглюкуронид билирубина (конъюгированный, или прямой, билирубин)
Индукторами синтеза УДФ-глюкуронилтрансфераз служат некоторые лекарственные препараты, например, фенобарбитал.
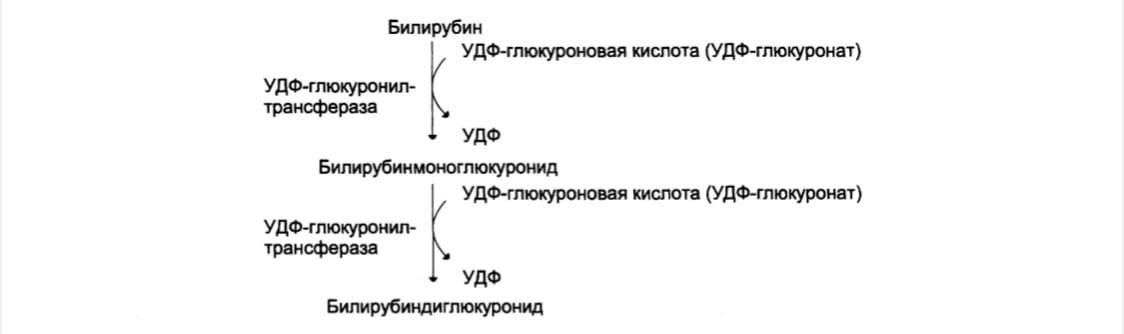
В норме диглюкуронид билирубина – главная форма экскреции билирубина в
жёлчь, однако не исключается присутствие небольшого количества моноглюкуронида.
Катаболизм билирубинбиглюкоуронида в кишечнике:
Билирубинглюкурониды, попадая в составе желчи, в кишечнике гидролизуются
специфическими бактериальными ферментами р-глюкуронидазами, которые гидролизуют связь между билирубином и остатком глюкуроновой кислоты. Освободившийся в ходе этой реакции билирубин под действием кишечной микрофлоры восстанавливается с образованием группы бесцветных тетрапиррольных соединений – уробилиногенов. Небольшая часть всасывается и поступает в кровь, еще часть уробилиногенов удаляется с мочой., но основная часть остается в кишечнике.
В результате окисления в прямой кишке уробилиноген превращается в пигмент
коричн. цвета – уробилин, который выводится из организма, являясь пигментом кала.
Диагностическое значение определения концентрации билирубина в
биологических жидкостях человека: см. след. вопрос
Вопрос 101
Нарушения катаболизма гема. Желтухи: гемолитическая, желтуха новорожденных, печеночно-клеточная, механическая, наследственная (нарушения синтеза УДФ-глюкуронилтрансферазы). Диагностическое значение определения билирубина и уробилиноидов при различных видах желтух,
дифференциальная диагностика желтух.
Причины гипербилирубинемии:
Увеличение образования билирубина, превышающее способность печени экскретировать его
Повреждение печени, приводящее к нарушению секреции билирубина в жёлчь в нормальных количествах.
Закупорка желчевыводящих протоков печени.
Желтуха - пожелтение тканей из-за отложения в них билирубина
1. Гемолитическая (надпечёночная) желтуха –результат интенсивного гемолиза эритроцитов. Она обусловлена чрезмерным образованием билирубина, превышающее способность печени экскретировать его
Основная причина: наследственные или приобретённые гемолитические анемии.
Гемолитические анемии могут быть вызваны: сепсисом, лучевой болезнью,
дефицитом глюкозо-6-фосфатдегидрогеназы эритроцитов, талассемией, переливанием несовместимых групп крови, отравлением сульфаниламидами,
Количество освобождающегося из эритроцитов гемоглобина за сутки может
доходить до 45 г (при норме 6,25 г), что увеличивает образование билирубина.
Кал и моча приобретают более интенсивную окраску.
Главный признак – повышение содержания в крови неконъюгированного (непрямого) билирубина. Это позволяет легко отличить её от механической (подпечёночной) и печёночно-клеточной (печёночной) желтух.
Неконъюгированный билирубин токсичен, легко растворяясь в липидах мембраны и проникая вследствие этого в митохондрии, разобщает в них дыхание и окислительное фосфорилирование, нарушает синтез белка, поток ионов калия через мембрану клетки и органелл. Это отрицательно сказывается на состоянии ЦНС, вызывая у больных ряд характерных неврологических симптомов.
Желтуха новорождённых – разновидность гемолитической желтухи
новорождённых - "физиологическая желтуха", наблюдающаяся в первые дни жизни
Причина: ускоренный гемолиз и недостаточность функции белков и ферментов
печени, ответственных за поглощение, конъюгацию и секрецию прямого билирубина.
У новорождённых не только снижена активность УДФ-глюкуронилтрансферазы,
но и недостаточно активно происходит синтез второго субстрата реакции конъюгации – УДФ-глюкуроната.
Осложнение: билирубиновая энцефалопатия – когда конц. неконъюгированного билирубина превышает 340 мкмоль/л, он проходит через ГЭБ и вызывает его поражение.
2. Печёночно-клеточная (печёночная) желтуха обусловлена повреждением гепатоцитов и жёлчных капилляров, например, при острых вирусных инфекциях, хроническом и токсических гепатитах.
Причина: поражение и некроз части печёночных клеток.
Происходит задержка билирубина в печени, чему способствует резкое ослабление
метаболических процессов в поражённых гепатоцитах.
Вместо преобладающих в норме диглюкуронидов билирубина в поражённой
печёночной клетке образуются главным образом моноглюкурониды.
В результате деструкции печёночной паренхимы образующийся прямой
билирубин частично попадает в большой круг кровообращения, что ведёт к желтухе.
Билирубина в кишечник попадает меньше, чем в норме.
Главный признак – повышается концентрация в крови как неконъюгированного (непрямого) и конъюгированного (прямого) билирубина.
Кал менее окрашенный (т.к. в кишечник поступает меньше билирубин-глюкуронида, то и количество образующегося уробилиногена также снижено.)
Моча имеет более интенсивную окраску за счёт присутствия там не только уробилинов, но и конъюгированного билирубина, который хорошо растворим в воде и экскретируется с мочой.
3. Механическая, или обтурационная (подпечёночная) желтуха обусловлена нарушением желчеотделения в двенадцатиперстную кишку.
Ее возникновение обусловлено:
Закупоркой жёлчных протоков (при желчнокаменной болезни)
Опухолью поджелудочной железы, жёлчного пузыря, печени, двенадцатиперстной кишки,
Хроническим воспалением поджелудочной железы
Послеоперационным сужением общего жёлчного протока
При полной закупорке общего жёлчного протока конъюгированный билирубин в
составе жёлчи не поступает в кишечник, хотя гепатоциты продолжают его вырабатывать.
Кал обесцвечен (т.к. нормальные пути экскреции билирубина заблокированы,
происходит его утечка в кровь, поэтому в крови больных повышена концентрация конъюгированного билирубина.)
Моча насыщенного оранжево-коричневого цвета (т.к растворимый билирубин
экскретируется с мочой)
4.Наследственные нарушения метаболизма билирубина обусловлены генетическими нарушениями в структуре белков и ферментов, ответственных за транспорт (захват) непрямого билирубина в печень и его конъюгацию с глюкуроновой кислотой. В крови – повышена концентрация непрямого билирубина.
Известно 2 типа наследственных желтух:
Первый тип – характерно полное отсутствие УДФ-глюкуронилтрансферазы.
Заболевание наследуется по аутосомно-рецессивному типу. Дети умирают в раннем возрасте из-за развития билирубиновой энцефалопатии.
Второй тип – характерно снижение активности (недостаточности) УДФ-
глюкуронилтрансферазы, гипербилирубинемия происходит за счёт непрямого билирубина. Желтуха хорошо поддаётся лечению фенобарбиталом.
Транзиторная гипербилирубинемия – семейная гипербилирубинемия новорождённых, связаная с наличием конкурентных ингибиторов конъюгации билирубина (эстрогенов, свободных жирных кислот) в материнском молоке. При грудном вскармливании ингибиторы конъюгации билирубина обнаруживают в сыворотке крови ребёнка. Исчезает при переводе ребёнка на искусственное вскармливание
Диагностическое значение: в нормальном состоянии концентрация билирубина в плазме составляет 0,3 - 1 мг/дл, 75% от него - непрямой билирубин.
Прямой Б. (конъюгированньй) может взаимодействовать с диазореагентом и образовывать соединения розового цвета (реакция Ван дер Берга). Неконъюгированньй билирубин (непрямой) гидрофобен, содержится в комплексе с альбумином и не реагирует с диазореактивом до тех пор, пока не добавлен органический растворитель( этанол), который осаждает альбумин.
Когда содержание билирубина в крови превышает норму – гипербилирубинемия. Гипербилирубинемию классифицируют как неконъюгированную и конъюгированную(в зависимости от того, концентрация какого типа билирубина повышена в плазме)
Дифференциальная диагностика желтух: измерение концентраций связанного и свободного билирубина по отдельности необходимо при постановке диагноза желтухи (необходимо сдать анализы крови и мочи). Уробилиноген – в сутки выделяется 4 мг в составе мочи (если повышен или понижен, то это свидетельствует о желутхе и поражении печени)
Вопрос 102
Биотрансформация лекарственных веществ. Фазы биотрансформации –микросомальное окисление и коньюгация. Роль цитохрома Р450 в окислении ксенобиотиков. Схемы процессов окисления веществ в системе цитохрома Р450. Схемы реакций коньюгации с ФАФС и УДФГК.
Индукция системы цитохрома Р450 лекарственными средствами.
Метаболизм ЛС протекает в 3 фазы:
1. Всасывание
2. Биотрансформация
3. Выведение
Различают 2 фазы биотрансформации:
Реакции окисления, восстановления, гидролиза;
Реакции конъюгации – взаимодействие ксенобиотиков или их метаболитов с различными эндогенными гидрофильными молекулами.
1. Фаза микросомального окисления – происходит под действием
микросомальных оксидаз, расположенных в мембранах гладкого ЭР, функционирующих в комплексе с 2 внемитохондриальными ЦПЭ
Микросомальная система включает несколько белков, составляющих электронтранспортные цепи (ЦПЭ).
В ЭР существуют две такие цепи:
Первая состоит из 2х ферментов: NADPH-P450 редуктазы и цитохрома Р450,
Вторя включает: NADH-цитохром-b5 редуктазу, цитохром-b5
и стеароил-КоА-десатуразу.
1 Электронтранспортная цепь: nadph-p450 редуктаза – цитохром р450
Донор электронов – NADPH, окисляемый NADPH-P450 редуктазой.
Фермент в качестве простетической группы содержит 2 кофермента –
флавинадениндинуклеотид (FAD) и флавинмононуклеотид (FMN).
Протоны и электроны с NADPH переходят последовательно на коферменты
NADPH-P450 редуктазы (FAD и FMN)
Восстановленный FMN (FMNH2) окисляется цитохромом Р450.
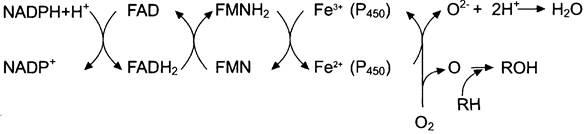
Цитохром Р450 –гемопротеин, содержит простетическую группу гем и имеет
участки связывания для кислорода и субстрата (ксенобиотика).
2 Электронтранспортная цепь:
Донор электронов для NADH-цитохром b5-редуктазы – NADH
Протоны и электроны с NADH переходят на кофермент NADH-цитохром b5-
редуктазы – FAD, а после этого электроны переходят на Fe3+ цитохрома b5.
Цитохром b5 в некоторых случаях может быть донором электронов (e) для
цитохрома Р450 или для стеароил-КоА-десатуразы, которая катализирует образование двойных связей в жирных кислотах, перенося электроны на О2 с образованием воды
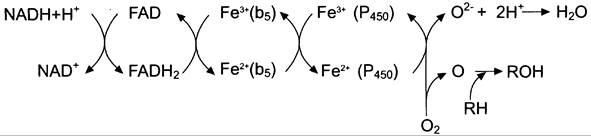
Электронтранспортные цепи эр

RН — субстрат цитохрома Р450;
В одной системе NАDРH окисляется NАDРHцитохром Р450-редуктазой, которая затем передаёт
электроны на целое семейство цитохромов Р450.
Вторая система включает в себя окисление NАDН цитохром b5-редуктазой, электроны переходят на
цитохром b5; восстановленную форму цитохрома b5 окисляет стеароил-КоА-десатураза, которая переносит электроны на O2.
Функционирование цитохрома Р450
Молекулярный кислород в триплетном состоянии инертен и не способен
взаимодействовать с органическими соединениями. Чтобы сделать кислород реакционноспособным, необходимо его превратить в синглетный, используя ферментные системы его восстановления. Связывание в активном центре цитохрома Р450 липофильного вещества RН и молекулы кислорода повышает окислительную активность фермента.
Один атом О2 принимает 2 e и переходит в форму О2-. Донором электронов
служит NADPH, который окисляется NADPH-цитохром Р450 редуктазой.
О2- взаимодействует с протонами:
О2- + 2Н+ → Н2O
Второй атом молекулы О2 включается в субстрат RH, образуя
гидроксильную группу вещества R-OH
RH + O2 + NADPH + Н+ → ROH + Н2O + NADP+.
Субстраты: экзогенные (лекарственные препараты, ксенобиотики) и эндогенные (стероиды, жирные кислоты и др.) вещества.
2. Фаза конъюгация – вторая фаза обезвреживания веществ.
Происходит присоединение к функциональным группам, образующимся на первом этапе, других молекул или групп эндогенного происхождения, увеличивающих гидрофильность и уменьшающих токсичность ксенобиотиков. Все ферменты, функционирующие в конъюгации – трансферазы.
В результате: образуются конъюгаты, которые являются более полярными, лучше растворимыми в воде и менее токсичными, чем чужеродные соединения, происходит понижение токсичности чужеродных соединений (лекарственных препаратов и ядов) и увеличение скорости выделения их из организма.
Глюкуронидная конъюгация
Глюкуроновая кислота образуется из глюкозы. Глюкуроновая кислота со
спиртами, фенолами, карбоновыми кислотами, тиолами, аминами и многими веществами образует конъюгаты, которые называют глюкуронидами.
УДФ-глюкуронилтрансферазы, локализированные в ЭР, присоединяют
остаток глюкуроновой кислоты (от УДФГК) к молекуле вещества, образованного в ходе микросомального окисления
В общем виде реакция с участием УДФ-глюкуронилтрансферазы записывается так:
ROH + УДФ-С6Н9О6 = RO-C6H9O6 + УДФ.
Сульфатная конъюгация
Цитоплазматические сульфотрансферазы катализируют реакцию конъюгации, в
ходе которой остаток серной кислоты (-SO3Н) от 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) присоединяется к фенолам, спиртам или аминокислотам
Регуляция активности микросомальной системы окисления: осуществляется
на уровне транскрипции или посттранскрипционных изменений. Индукция синтеза позволяет увеличить количество ферментов в ответ на поступление или образование в организме веществ , выведение которых невозможно без участия системы микросомального окисления.
К числу индукторов относят: барбитураты, полициклические ароматические
углеводороды, спирты, кетоны и некоторые стероиды.
