
III. хтс
.pdf
К сожалению, из-за того, что реакция окисления диоксида серы – обратимая, она не протекает на 100%. Рассмотренные выше мероприятия позволяют достичь степени превращения SO2 не выше 98-98,5%. Возможность снижения температуры ограничена активностью имеющихся катализаторов, увеличение давления усложняет инженерное оформление процесса, и потому эти методы пока не получили промышленного применения. Количество выбрасываемого в атмосферу SO2 составляет 10-15 т в сутки. В атмосфере SO2 может окисляться до SO3 под действием солнечной энергии и частиц пыли как катализатора (например, оксиды железа – хорощий катализатор окисления, применявшийся в промышленности).
Этого нельзя допустить. Надо искать решения этой экологической проблемы. Кроме температуры, давления, концентрации есть еще один способ сдвига реакции вправоэто удаление продукта реакции. Предлагается на каком-то этапе протекания реакции, удалить из реакционной смеси образовавшийся SO3 а оставшуюся реакционную смесь направить на повторное окисление остатков SO2. В результате была разработана и действует в настоящее время:
Система двойного контактирования и двойной абсорбции (ДК/ДА)..
(для интенсификации процесса (↑степень превращенияSO3) снизить Т ниже 610К в последних слоях катализатора(но ограничено возможностью катализатора), увеличением Р>1,2МПа (↑Р усложняет конструкцию), удаление продукта)
Метод ДК/ДА позволяет решать концепцию более полного использования сырья (повышение степени окисления SO2) и концепцию минимизации отхода по линии основного материального потока.
Подсистема получения сернистого газа (обжиг серосодержащего сырья) принципиально не меняется. Полученный сернистый газ частично окисляется в первом реакторе, после чего в первой (промежуточной) ступени абсорбции из него удаляется SO3. Далее оставшийся SO2, окисляется во втором реакторе, и газ направляется на вторую абсорбцию. В отсутствие SO3, окисление SO2, во втором реакторе будет более полным. Каждый реактор состоит из адиабатических слоев катализатора с промежуточными теплообменниками подобно реактору в схеме одинарного окисления
Организация данной схемы требует двойной нагрев реакционной смеси: в первом реакторе от 320 до 690 К, необходимой перед первым слоем, и после его охлаждения до 320-340 К для промежуточной абсорбции SO3, - перед вторым реактором. Нагрев осуществляется за счет теплоты реакции. Но во второй ступени окисляется низкоконцентрированный газ, теплоты реакции выделяется мало - необходимы теплообменники с большой поверхностью теплообмена. Увеличить общее количество выделяемой теплоты можно за счет увеличения начальной концентрации SO2. По этой причине в системах ДК/ДА используют газ, содержащий не менее 10% SO2, Во избежание перегрева катализатора в первом слое значения температуры на входе не должны превышать 695 К, для чего используют низкотемпературные катализаторы.
Количество непревращенноro SO2 (и, следовательно, выбросов в атмосферу) в системе ДК/ДА уменьшается почти в 10 раз по сравнению с системой однократного контактирования, что требует дополнительных экономических затрат, так как поверхность теплообменников увеличивается в 1,5-1,7 раза.
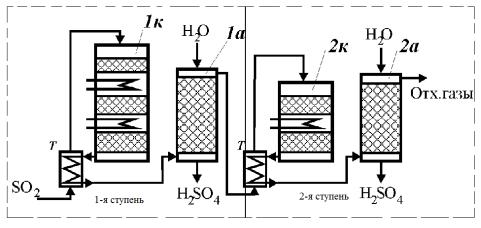
Рис. 4. Технологическая схема контактного отделения окисления SO2 и абсорбции SO3 по методу ДК/ДА: 1к, 2к – контактные аппараты (реакторы); 1а, 2а – абсорберы; Т – теплообменники
На первой ступени окисления использован трехслойный реактор 1к,. Концентрация SO2 в поступающем газе - 9,5-10,5%. Степень превращения на выходе из реактора 90-95%. Промежуточная абсорбция SO3 идет в включает абсорбер 1а,. После него газ содержит только 0,6-1%. Поскольку во второй ступени тепла выделяется мало (из-за низкой концентрации SO2), для нагрева газа до температуры реакции используют теплообменник после второго слоя реактора 2к. Степень превращения оставшегося SO2 составляет примерно 95%, общая степень превращения - 99,6-99,8%. В этой схеме реакционную смесь приходится нагревать дважды сначала до температуры реакции перед головным слоем первого реактора, и после его охлаждения, что необходимо для промежуточной абсорбции SO3 перед вторым реактором. Нагрев осуществляется за счет тепла реакции (прием, который называется регенерация тепла).
Концепция более полного использования сырья в ХТС производ-
ства серной кислоты решается путём повышения степени обжига колчедана, повышения степени окисления диоксида серы и увеличения степени абсорбции триоксида серы.
Концепция эффективного использования энергоресурсов в ХТС производства серной кислоты решается путём использования тепла сгорания серосодержащего сырья в котле-утилизаторе и путём регенерации теп-
ла окисления диоксида серы для подогрева обжигового газа перед его подачей в реактор окисления. Одновременно при этом охлаждается поток га-
за между слоями катализатора так, что процесс окисления диоксида серы протекает вблизи линии оптимальных температур.
ХТС производства азотной кислоты
Немного истории, это интересно. В 1914 г. разработан и в 1916 г. в г. Юзовка (ныне Донецк) пущен в эксплуатацию цех азотной кислоты на основе аммиака из коксового газа. Разработка велась под руководством русского инженера И.И. Андреева. Сейчас получение азотной кислоты из аммиака - основной способ ее производства.
Химическая м функциональная схемы производства азотной кислоты.
Сырьем является синтетический аммиак, кислород воздуха и вода. Протекают
реакции: |
|
окисление аммиака кислородом воздуха |
|
4NH3 + 5O2 = 4NO + 6H2O + Q1; |
(1) |
доокисление оксида азота до диоксида азота |
|
2NO + O2 = 2NO2 + Q2; |
(2) |
поглощение NO2 водой с образованием азотной кислоты |
|
3NO2 + H2O = 2HNO3 + NO + Q3. |
(3) |
Одновременно с третьей реакцией проводят вторую, так что весь NO2 |
можно |
превратить в HNO3. Все реакции экзотермические. |
|
Исходя из химической схемы (1-3), функциональная схема будет включать подсистемы окисления аммиака, последующее охлаждение газов (реакция (1) протекает с выделением тепла при высокой температуре) и утилизация тепла реакции, окисление оксида азота и абсорбцию образовавшихся нитрозных газов водой (рис. 1). Не забыть об отделении очистки аммиачновоздушной смеси (АВС) от разного рода примесей, которые вредят работе катализатора окисления аммиака.
|
|
|
|
|
|
|
|
Отходящие |
|
|
|
|
|
|
|
|
газы |
Воздух |
|
|
|
3 |
|
4 |
|
|
1 |
2 |
|
|
|
||||
Аммиак
НNO3
Рис.1 Функциональная схема производства азотной кислоты:
1 – подсистема очистки АВС; 2 – окисление аммиака и утилизация тепла реакции; 3 – окисления оксида азота и охлаждение нитрозных газов; 4 – абсорбция диоксида азота
Остановимся на физико-химическом обосновании отдельных стадий производства.
Окисление аммиака. Ф и з и к о - х и м и ч е с к и е с в о й с т в а п р о ц е с с а . Окисление аммиака - сложная необратимая экзотермическая каталитическая
реакция. Аммиак окисляется до N2 |
и NO. Превращение описывается двумя |
||
независимыми стехиометрическими уравнениями: |
|
||
4NH3 |
+ 5O2 |
= 4NO + 6H2O + 904 кДж; |
(4) |
4NH3 |
+ 3O2 |
= 2N2 + 6H2O + 1269 кДж. |
(5) |
Катализатор - платина или платинапалладийродиевый сплав (содержание Pt 81-92%). Температура процесса - 1100-1200 К. В этих условиях практически не образуется закись азота N2O. Из-за обратимости экзотермической реакции (2) ее равновесие при температуре окисления аммиака сдвинуто влево, и диоксид азота также отсутствует.
Схема превращения отличается от системы стехиометрических уравнений (4 и 5) - реакция окисления аммиака включает четыре частные реакции, (исключая образование закиси азота):
NO
1
NH3 |
4 |
3 |
(6) |
|
2
N2
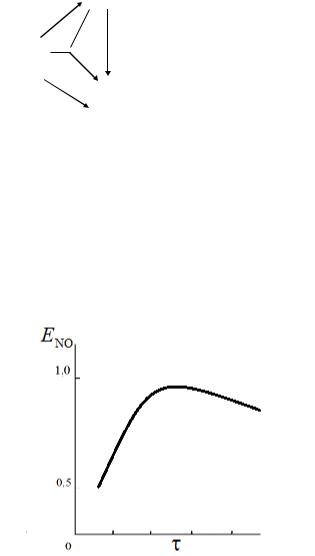
Эта схема была установлена экспериментально: подавая только NO на катализатор, наблюдали образование азота и кислорода по реакции 2NO = N2 + O2; подавая смесь NH3 и NO, наблюдали образование N2 по реакции 4NH3 + 6NO = 5N2 + 6H2O. Такая схема превращения объясняет экстремальную зависимость выхода оксида азота от времени превращения - рис. 2. С ростом реакционная смесь «задерживается» на катализаторе и создаются благоприятные условия для разложения образовавшегося NO до азота.
Рис. 2. Зависимость выхода оксида азота от времени контакта (пребывания)
У с л о в и я п р о ц е с с а . Окисление аммиака относится к гетерогеннокаталитическим процессам. Скорость реакции окисления аммиака при температуре проведения процесса значительно выше по сравнению со скоростью диффузионной стадии, вследствие слабой зависимости коэффициента диффузии от температуры по сравнению с температурной зависимостью константы скорости реакции. Поэтому скорость процесса лимитирует перенос вещёства и тепла из объёма газового потока к внешней поверхности катализатора и сама реакция,
благодаря высокой скорости, протекает как раз на внешней поверхности. Таким образом, процесс идет во внешнедиффузионной области. В этих условиях нет необходимости применять катализатор с развитой внутренней поверхностью. Значительно более важным является развитие внешней (наружной) поверхности, поэтому катализатор представляет собой сетку, сплетённую или связанную из металлической проволоки диаметром 0.06-0,09 мм. Благодаря сетчатой форме и
малому диаметру проволоки |
создаётся большая внешняя поверхность |
катализатора. |
|
Время контакта очень небольшое и составляет (1 2) 10-4 с. Аммиак за это время полностью окисляется, так что выход NO совпадает с селективностью
реакции по оксиду азота. |
|
|
|
|
||||
Во |
|
внешнедиффузионной |
области |
|
|
|
||
концентрации исходных веществ на поверхности |
|
|
|
|||||
много меньше, чем в объеме. У поверхности будет |
|
|
|
|||||
мало как NH3, так и О2. В этих условиях |
|
|
|
|||||
окисление будет протекать в основном до азота по |
|
|
|
|||||
р. (5), там не требуется много О2. Необходим |
|
|
|
|||||
избыток |
О2 |
у поверхности, чтобы NH3 стал |
|
|
|
|||
окисляться до оксида азота. Влияние соотношения |
|
|
|
|||||
O2 : NH3 |
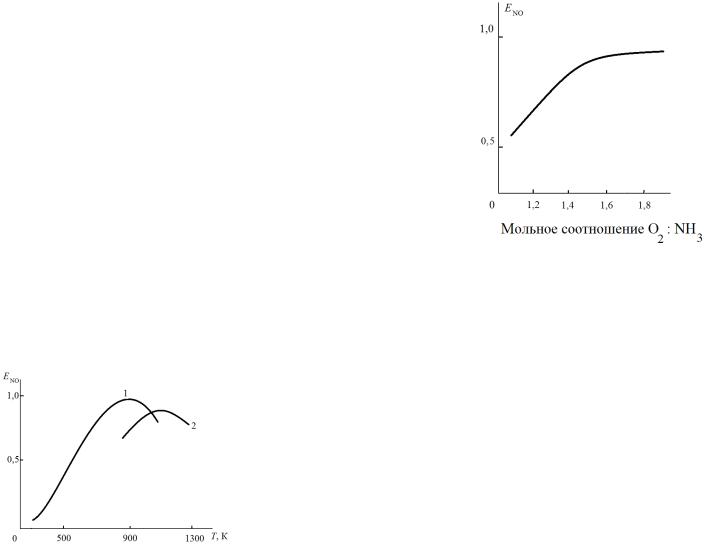
в потоке на выход NO показан на рис. 3. |
|
|
|
||||
При соотношении O2 : NH3 более 1,8 : 1 |
|
|
|
|||||
Рис. 3. Зависимость выхода |
|
|||||||
селективность процесса практически не меняется. |
|
|||||||
Соотношение |
O2:NH3 |
= 1,8 : 1 отвечает |
оксида азота от объемного |
|
||||
отношения О2:NH3 |
|
|||||||
содержанию в аммиачно-воздушной |
смеси 10 |
|
||||||
|
|
|
||||||
об.% NH3 , что и принято в промышленности. |
|
|
|
|||||
|
|
|
||||||
|
|
|
Что касается давления, оно усиливает разложение |
|||||
|
|
|
NO до N2 по этапу 3 в схеме (6) в большей степени, чем в |
|||||
|
|
|
направлении целевой реакции. Таковы данные |
|||||
|
|
|
кинетических исследований. С ростом давления |
|||||
|
|
|
уменьшается выход NO c 97 98% при 0,1 МПа до 95 96% |
|||||
|
|
|
при 0,7 МПа, хотя при этом, согласно закону |
|||||
|
|
|
действующих масс, скорость превращения аммиака |
|||||
|
|
|
увеличивается с ростом парциальных давлений |
|||||
Рис. 4. Зависимость выхода |
реагирующих |
веществ. Соответственно, |
для проведения |
|||||
процесса при 0.1 МПа необходимо 8 12 катализаторных |
||||||||
оксида азота при окислении |
||||||||
аммиака от температуры: |
сеток, а при 0.7 МПа 5 6 сеток. Влияние температуры на |
|||||||
1 – давление 0,1 МПа; 2 – |
выход NO имеет экстремальный характер (рис. 4), и с |
|||||||
давление 0,7 МПа |
повышением |
давления |
температура |
максимального |
||||
|
|
|
||||||
выхода NO увеличивается.

Хотя давление уменьшает выход NO, процесс в промышленности проводят под повышенным давлением. Здесь учитывается свойство ХТС, о котором мы говорили: оптимальный режим элемента вне и внутри ХТС может быть различным. Использование повышенного давления хотя и снижает выход по оксиду азота, но значительно повышает скорость абсорбции NO до NO2. а также окисления оксида азота. В целом получается выигрыш и ХТС в работает в оптимальном режиме. Кроме того, при повышенном давлении можно создать энерготехнологическую систему, замкнутую по энергетике.
Р е а к т о р о к и с л е н и я а м м и а к а представлен на рис. 5. Аммиачно-воздушная смесь (АВС) при
поступлении в реактор, проходя и контактируя с нагретой конусной частью реактора, нагревается за счет теплового излучения, исходящего от слоя катализатора. Окисление аммиака осуществляется на платиноидном катализаторе, выполненном в виде нескольких сеток, после чего реакционные газы охлаждаются в котле-утилизаторе. Для равномерного распределения потока по сечению тонкого слоя катализатора реактор должен иметь распределительную решетку в конусной части реактора.
Тепло газов после окисления аммиака используют для выработки пара в котле-утилизаторе. Конструктивно он совмещен с реактором.
Окисление оксида азота - гомогенная обратимая экзотермическая реакция:
2NO + O2 = 2NO2 + 180,6 кДж.
При температурах ниже 400 К равновесие практически полностью сдвинуто в сторону образования NO2. Реакция может протекать везде - трубопроводах, теплообменниках и в других аппаратах. Установлено, что кинетическая модель отвечает стехиометрии реакции и имеет вид:
r k1PNO2 PO2 k2PNO2 2
Как видно, давление значительно ускоряет реакцию, что также говорит в пользу его повышения в ХТС. Реакция протекает не очень быстро. Потому устанавливают окислитель - полый аппарат, обеспечивающий необходимое время пребывания реакционной смеси для завершения реакции.
Реакция окисления NO - экзотермическая. Необходимо дополнительное охлаждение нитрозного газа. При охлаждении конденсируется вода - ее образуется
в 1,5 раза больше, чем подано аммиака (см уравнения реакции окисления аммиака). Конденсирующаяся вода будет взаимодействовать с нитрозным газом, образуя азотную кислоту. Целесообразно сократить время контакта газа с водой, поэтому используют специальный скоростной теплообменник-конденсатор. В нем образуется 30%-ая кислота. Ее направляют в соответствующее этой концентрации сечение абсорбционной колонны.
Абсорбция оксидов азота. Ф и з и к о - х и м и ч е с к и е с в о й с т в а п р о ц е с с а .
Диоксид азота взаимодействует с водой по схеме |
|
2NO2 + H2O = HNO3 + HNO2; |
(7) |
3HNO2 = HNO3 + 2NO. |
(8) |
Образующаяся по первой реакции азотистая кислота нестойка и сразу |
|
разлагается с выделением части NO в газовую фазу. Суммарно абсорбция |
|
представлено уравнением |
|
3NO2 + H2O = 2HNO3 + NO + 73,6 кДж |
(9) |
Это гетерогенный процесс в системе «Г-Ж». По сравнению с диффузией NO2 химическая реакция (7) протекает быстро, вследствие природы реагирующих веществ: «кислота-основание». Образующийся при этом оксид азота NO частично окисляется в растворе кислородом. В силу плохой растворимости в водных растворах азотной кислоты значительная часть NO выделяется в газовую фазу, где окисляется кислородом. Лимитирующей стадией процесса абсорбции является диффузия диоксида азота NO2 в жидкую фазу. Количество абсорбируемого диоксида азота зависит от скорости W1 первого этапа процесса – переноса NO2 из потока газа через газовый пограничный слой к поверхности раздела фаз (см. курс ПАХТ):
W1 г F ( pNO 2 – pNO 2 * ),
где pNO2 , pNO2 * – парциальное давление NO2 в газовой фазе и равновесное давление
NO2 у поверхности водного раствора азотной кислоты соответственно.
Из уравнения следует, что скорость поглощения диоксида азота водными
растворами азотной |
кислоты |
определяется |
|
температурой, |
|
давлением |
и |
|||||
концентрацией кислоты. С повышением |
|
температуры |
pNO |
* |
увеличивается, |
а |
||||||
|
2 |
|||||||||||
движущая сила процесса переноса ( p |
NO |
2 |
– p |
NO |
* ) уменьшается, что снижает |
|||||||
|
|
|
|
2 |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
||
скорость поглощения |
NO2 |
и соответственно уменьшается |
концентрация |
|||||||||
получаемой азотной кислоты. При понижении температуры и увеличении давления понижается pNO2 * , следовательно, движущая сила процесса абсорбции ( pNO2 –
pNO2 * ) растёт и соответственно повышается скорость поглощения диоксида азота.
По мере протекания абсорбции NO2 концентрация получаемой азотной кислоты возрастает, при этом увеличивается давление оксидов азота над раствором

азотной кислоты pNO2 * , т.е. снижается движущая сила процесса массопереноса. Для
увеличения движущей силы процесса поглощения используется противоток жидкой и газовой фаз в аппарате.
Данный процесс в промышленности проводят при повышенном давлении, так как увеличение давления оказывает положительное воздействие на абсорбцию диоксида азота. Это позволяет вместо 6–8 абсорбционных колонн, используемых при атмосферном давлении, при повышенном давлении использовать одну
колонну, кроме того, уменьшаются габариты остального |
|
||||
В ы б о р о б о р уд о в а н и я . |
|
|
|||
Итак, для полноты поглощения NO2 необходим |
|
||||
противоток жидкой и газовой фаз, хороший |
|
||||
массообмен, пространство для гомогенного окисления |
|
||||
освобождающегося по реакции (8) NO, поддержание |
|
||||
температуры на относительно низком уровне. Такие |
|
||||
условия осуществляются в абсорбционной колонне. |
|
||||
Определим тип насадки в ней. Взаимодействие NO2 с |
|
||||
H2O - реакция быстрая, так что имеет место почти |
|
||||
равновесие |
между HNO3 |
в жидкости и NO2 в газе. |
|
||
Последующее окисление NO (и в газовой, и в жидкой |
|
||||
фазах) |
протекает |
медленнее. |
Необходимо |
|
|
определенное время для его завершения и |
|
||||
пространство, где будет протекать окисление NO. В |
|
||||
основном, окисление образовавшегося NO протекает в |
|
||||
Рис.6. Абсорбционная |
|||||
газовой фазе по реакции (2). Реактор |
образования |
||||
колонна |
|||||
азотной кислоты - абсорбционная колонна с |
|||||
|
|||||
переливными ситчатыми тарелками (рис. 6.). |
|
||||
|
|||||
Пространство между тарелками работает как газофазный окислитель |
|||||
основного количества выделившегося NO. Барботаж в невысоком (на тарелке) слое |
|||||
жидкости обеспечивает интенсивный массообмен с газом, способствуя поглощению компонентов газовой смеси и тем самым образованию HNO3 и жидкофазному окислению NO. Встроенные теплообменники обеспечивают пониженный уровень температуры по высоте абсорбера. Можно считать, что в абсорбционной колонне протекает превращение, описываемое следующим бруттоуравнением как сумма уравнений (2) и (7):
4NO2 + 2H2O + O2 = 4HNO3 . |
(10) |
Из общего балансового уравнения превращения NH3 в HNO3
4NH3 + 8O2 = 4HNO3 + 4H2O
видно, что на 1 объем NH3 расходуется 2 объема кислорода. На стадии окисления аммиака подается 1,8 объема О2 с воздухом. Остальной кислород (воздух) надо подавать в абсорбционную колонну для полноты окисления NO.
С понижением температуры поглощение NO2 улучшается. Для отвода теплоты реакции на тарелках установлены плоские змеевиковые холодильники с циркулирующей в них водой.
Энерготехнологическая система в производстве азотной кислоты.
После абсорбции отходящие газы содержат 0,1 об.% оксидов азота и должны быть очищены. При атмосферном давлении и низкой температуре образуется димер диоксида азота N2O4 - газ буро-желтого цвета. Поэтому выходящий из трубы не очищенный нитрозный газ получил название "лисий хвост". Атмосферные осадки, захватывая оксиды азота, образуют кислые дожди.
Очистку газов от оксидов азота осуществляют каталитическим восстановлением их до N2. Восстановителем может служить аммиак, который дозируют в газы после абсорбции перед реактором-нейтрализатором. Восстановитель может служить также метан (природный газ). Последний удобно использовать при организации энерготехнологической системы.
Газы после абсорбции находятся под повышенным давлением, потенциал которого можно использовать в газовой турбине для привода воздушного компрессора. Но энергии отходящих газов как рабочего тела турбины не достаточно для сжатия воздуха до давления на входе в систему. Во-первых, имеют место потери на преодоление гидравлического сопротивления в аппаратах и трубопроводах, и отходящие газы имеют давление несколько меньшее, чем на входе. Во-вторых, объем отходящего газа также меньше - почти весь кислород расходуется на образование продукта. Энергию рабочего тела можно увеличить, если его нагреть. Для этого в технологическую систему вводят энергетический узел - горелку природного газа (рис. 7).
Энергия сжатого газа увеличивается за счёт увеличения его температуры. Высокая температура отходящих газов используется для каталитической очистки от оксидов азота путём их восстановления с помощью небольшого избытка метана в реакторе очистки. Реактор каталитической очистки при использовании природного газа в качестве восстановителя устанавливают в системе после энергетического узла, так как высокая температура (700–750 0С) позволяет провести процесс восстановления оксидов азота на палладиевом катализаторе.
CH4 + 2NO2 = N2 + 2H2O + CO2
CH4 + 4NO = 2N2 + 2H2O + CO2
Сжатый газ с повышенной энергией подается в газовую турбину, которая находится на одном валу с компрессором для сжатия воздуха перед его смешением с аммиаком.
