
III. хтс
.pdf

Делитель (b). Входит один поток и выходят два. Если происходит только разветвление потока, делитель называют простым, покомпонентный составы входящих и выходящих потоков не меняются. В таких процессах, как испарение, ректификация, абсорбция, фильтрация, составы входящих и выходящих потоков различаются, и такой элемент называют делителем пропорциональным.
Делитель простой разделяет поток на два или более потоков без изменения состава. Допустим, что один из двух выходящих из делителя потоков (пусть это будет 2-й поток) составляет долю входного потока:
G2 = G1, |
G3 = (1 )G1 |
(8) |
Тогда все компоненты разделятся по потокам:
Gi,2 = Gi,1, |
Gi,3 = (1 )Gi,1 |
i = 1, ..., B |
(9) |
Концентрации компонентов в потоках на выходе из простого делителя не изменяются. Аналогичные балансовые уравнения можно получить, если использовать мольные или объёмные потоки.

Реактор (c). Проходит один поток, но его компонентный состав принципиально меняется вследствие протекающих в элементе химических превращений. Элементом "реактор" может быть как отдельный аппарат, так и подсистема из нескольких аппаратов, в которых протекают химические превращения.
Реактор осуществляет химическое превращение во входящем потоке и принципиально меняет его состав. Изменение химического состава реагирующей смеси описывается стехиометрическими уравнениями, которые показывают, в каких соотношениях вещества вступают в реакцию и определяют количественные изменения состава реакционной смеси.
Простая реакция будет описываться одним стехиометрическим уравнением:
AA + BB + … = RR + SS + …+ Qp(- Hp), |
(13) |
Стехиометрические коэффициенты A, B, R, S показывают число молей соответствующих веществ, вступивших и образовавшихся в ходе реакции. Соотношение между количествами превращённых веществ N, также выраженных в молях,
NА |
|
NВ |
|
NR |
|
NS |
|
(14) |
|||
|
|
|
ν |
||||||||
ν |
А |
ν |
В |
ν |
R |
|
|
||||
|
|
|
S |
|
|
||||||
где NA, NB – количества израсходованных исходных веществ А и В; NR, NS – количества образовавшихся веществ R и S.
Если реакция протекает в газовой фазе без изменения объёма, концентрация выражена в мольных, объёмных долях или парциальных давлениях используют также изменение концентраций реагирующих веществ:
сA |
|
сB |
|
сR |
|
сS |
|
(15) |
|
|
|
|
|||||
νA |
νB |
νR |
|
νS |
|
|||
Зная количество одного из веществ после химического превращения, можно определить, как мы уже знаем, количества всех компонентов смеси. Например, если NA – количество оставшегося исходного вещества, то
ν
Ni = Ni,0 ν i (NA,0 – NA), или (16)
A
N |
i |
N |
i,0 |
|
νi |
N |
x |
(17) |
|
||||||||
|
|
|
νА |
|
А,0 А |
|
||
|
|
|
|
|
|
|
|

Знак " " для продукта реакции, знак "+" для исходного вещества. Напомню, что для исходных веществ стехиометрические коэффициенты принимаются отрицательными, а для продуктов – положительными.
Степень превращения исходного вещества (например, А) – доля его количества, вступившего в реакцию:
x |
N А,0 N А |
, |
(18) |
|
|||
А |
N А,0 |
|
|
|
|
|
где NA,0, NA – количество вещества А до и после превращения.
Зная количество хотя бы одного компонента на выходе из реактора или степень превращения исходного компонента, можно определить по уравнениям состояние выходного потока – количества и концентрации всех веществ.
Сложная реакция описывается несколькими стехиометрическими уравнениями. Их называют частными реакциями.
В сложной схеме превращений одна из реакций приводит к образованию полезного продукта, например, R. Другие реакции – побочные, без образования нужного продукта. Для более простого изложения характеристик сложной реакции представим её системой стехиометрических уравнений, в которых:
левая часть содержит одно и то же исходное вещество;
правая часть только одного уравнения содержит полезный продукт.
Например: |
|
|
A + B = R |
x1 |
|
|
x= x1 + x2 |
(19) |
A + C = S |
x2 |
|
Вводится степень превращения исходного вещества в каждом стехиометрическом уравнении. В примере показаны x1 и x2 – степени превращения исходного вещества А в каждой реакции и x – общая степень превращения вещества А.
Задавшись степенью превращения xА,j исходного вещества А в стехиометрическом уравнении, определим количества всех компонентов:
|
R |
ν |
|
|
|
Ni Ni,0 |
|
i, j |
NА,0 |
Х А, j |
, |
|
|||||
|
j |
νА, j |
|
|
|
каждом
(20)
где i,j – стехиометрический коэффициент i-го вещества в j-ой реакции (см. лекцию, раздел «стехиометрические соотношения» или семинар от 14.02.20).
Напомню, для сложных реакций вводятся следующие показатели.
Выход продукта – доля всего количества исходного вещества, превратившаяся в данный продукт. Полагая, что А исходное вещество, выход ER по продукту R:
|
|
ν |
A |
|
N |
|
N |
|
|
|
|
|
|
|
R |
R,0 |
|
||||
|
|
|
|
|||||||
|
|
νR |
|
|
|
|||||
ER |
|
|
|
|
|
|
|
|
|
(21) |
|
|
|
|
NA,0 |
|
|
||||
|
|
|
|
|
|
|
|
|||
В примере (19) ER = x1.
Селективность (избирательность) по продукту доля превратившегося
количества исходного вещества в данный продукт. Полагая, что А исходное вещество, селективность SR по продукту R:
|
|
|
ν |
A |
|
N |
|
N |
|
|
|
|
|
|
|
|
|
R |
R,0 |
|
|||
|
|
|
νR |
|
|
|
|||||
SR |
|
|
|
|
|
|
|
|
|
|
(22) |
|
|
NA,0 |
NA |
|
|||||||
|
|
|
|
|
|
||||||
В примере (19) SR = x1/x.
Для простой реакции SR = 1 и для любого i-го продукта Еi = x. Для сложной реакции ER = SR x.
Таким образом, задавая степени превращения xA,j исходного вещества А во всех стехиометрических уравнениях сложной реакции, можно определить количества Ni всех компонентов в прореагировавшей смеси, выходы продуктов Ei и селективность процесса по продуктам SR.
С т е х и о м е т р и ч е с к и е ур а в н е н и я с " м а с с о в ы м и " с т е х и о м е т р и ч е с к и м и к о э ф ф и ц и е н т а м и . В расчетах материального баланса реакционного элемента используют и другие формы записи химических превращений. Стехиометрические коэффициенты в химических уравнениях показывают количества компонентов, вступающих в химическое взаимодействие. Традиционно эти количества измеряют в молях. Но можно стехиометрические коэффициенты выразить в массовых величинах, умножив "мольные"
коэффициенты на мольную массу. На пример, в "мольном" выражении стехиометрических коэффициентов окисление диоксида серы выглядит так:
SО2 + 1/2 О2 = SО3.
Мольные массы SО2 - 64, О2 - 32, SО3 - 80, и это же уравнение с "массовыми" стехиометрическими уравнениями будет выглядеть так:
64SО2 + 16О2 = 80SО3
В такой записи очевиден материальный баланс: суммарная масса исходных веществ равна массе продукта. Формулы (5.6)-(5.7), (5.9)-(5.10) также можно использовать с "массовыми" стехиометрическими коэффициентами. Естественно, что и другие переменные в них также имеют "массовую" размерность (количества веществ G, а не N, концентрации g, а не С, и другие). Используя уравнение (5.6) с "массовыми" стехиометрическими коэффициентами ij, можно сразу получить массовый баланс в реакционном элементе.
С ум м а р н о е ( б р у т т о - ) с т е х и о м е т р и ч е с к о е ур а в н е н и е . В ряде случаев необходимо получить материальный баланс подсистемы и даже ХТС в целом, где протекают последовательно ряд превращений. Рассмотрим пример: в производстве азотной кислоты определить количество НNО3, образующейся из 1 тонны аммиака. В химико-технологическом процессе протекают следующие реакции:
окисление аммиака
4NН3 |
+ 5О2 = 4NО + 6Н2О |
(23) |
(для простоты объяснения полагаем, что NН3 полностью окисляется до NО), |
|
|
окисление оксида азота |
|
|
|
2NО + О2 = 2NО2 |
(24) |
абсорбция диоксида азота |
|
|
3NО2 |
+ Н2О = 2НNО3 + NО |
(25) |
В абсорбционную колонну подается кислород, и образующийся оксид азота повторно окисляется до NО2 по реакции (24). Таким образом, образование азотной кислоты представлено стехиометрическими уравнениями (23-25). Умножим первое из них на 1, второе - на 3, третье - на 2 и сложим их. Получим суммарное стехиометрическое уравнение (брутто-уравнение)
4NН3 + 8О2 = 4НNО3 + 4Н2О |
(26) |
Конечно, такая реакция неизвестна. Но стехиометрическое |
уравнение |
показывает, в каких соотношениях реагенты вступают во взаимодействие друг с другом не зависимо от схемы превращений, и этому определению отвечает уравнение (5.14). Из него сразу получаем, что 1 моль НNО3 образуется из одного моля аммиака и двух молей кислорода.
Умножим стехиометрические коэффициенты в (5.14) на мольные массы соответствующих компонентов (NН3 - 17, О2 - 32, НNО3 - 63, Н2О - 18) и получим
68NН3 + 256О2 = 252НNО3 + 72Н2О
Из этого уравнения видно, что для производства 252 кг НNО3 надо затратить 68 кг NН3, а на 1т (1000 кг) НNО3 пойдет 68 1000/252 = 270 кг аммиака. Удобство записи суммарного (брутто-) стехиометрического уравнения очевидно.
2. ОБЩИЙ ВИД УРАВНЕНИЙ ТЕПЛОВОГО (ЭНЕРГЕТИЧЕСКОГО) БАЛАНСА
В основу теплового (энергетического) баланса положен закон сохранения энергии, согласно которому приход тепла или энергии в данном процессе равен его расходу в том же процессе (т.е. как и в материальном балансе, приход равен расходу). В общем виде:
q |
q |
(27) |
||
k |
k, вх |
l |
l, вых |
|
|
|
|
||
Для каждого элемента или подсистемы ХТС, в которой протекают экзоэндотермические процессы:
qi,k,вх qi, l,вых |
q j,ист |
(28) |
|||
k |
|
l |
|
j |
|
В этих уравнениях q |
и q |
входные и выходные потоки (внешние |
|||
k |
k, вх |
l |
l, вых |
|
|
|
|
|
|
||
потоки), q j,ист энергетические потоки (источники), |
обусловленные |
||||
j |
|
|
|
|
|
протекание в системе процессов с тепловыми эффектами, главным образом, химические превращения.
Теплота, выделившаяся в реакции, зависит от ее теплового эффекта Qp и глубины протекания реакции - степени превращения x исходного компонента. В
уравнении (13) стехиометрический коэффициент перед А равен A и qp = QpxA/ A |
|||
(кДж/моль). Для сложной реакции q p |
Qpj xAj |
(индекс j относится к j-му |
|
Aj |
|||
j |
|
||
стехиометрическому уравнению). |
|
|
|
j относится к j-му стехиометрическому уравнению). |
|
||
Используемые в справочниках значения сp и Qp - удельные, относящиеся к |
|||
единице количества вещества. Теплоемкость смеси ср - аддитивное свойство |
|
теплоемкостей составляющих ее компонентов срi: c p Cic pi где Сi |
|
i
концентрации компонентов.
Можно принять (на практике), что изменение Т мало отражается на величинеHp (и Qp соответственно). Это обусловлено возрастанием энтальпии как исходных
веществ, так и продуктов реакции. Допущение Hp const означает также малое влияние температуры на разность тепловых емкостей (произведение G cр) исходной и прореагировавшей реакционной смеси. Тепловая емкость смеси в большинстве случаев меняется менее, чем на 10 %. Можно принять средние
значения Hp (Qp) и cр = с р (удельной теплоемкости) в рабочем температурном
интервале и использовать уравнения:
С учетом приведенных рассуждений и сделанных замечаний уравнение теплового баланса будет иметь следующие составляющие:
qвх Gвх срTвх ; |
|
|
|
|
||
|
|
|
Qpj |
xAj |
|
|
qист |
GА,вх |
|
; |
|
||
|
|
|
||||
|
|
|
Aj |
|
(29) |
|
|
|
j |
|
|||
qвых |
Gвых cpTвых . |
|
|
|
||
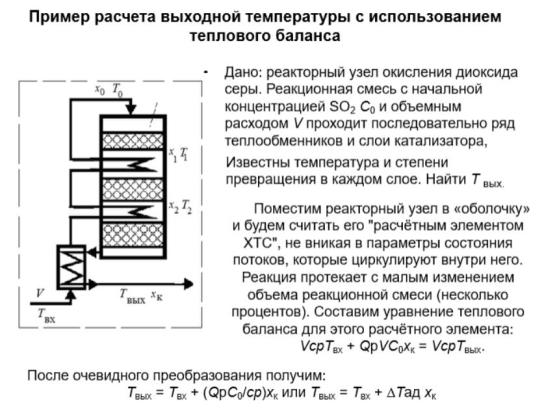
Пример приближенного расчета температуры на выходе.
Здесь входящий поток SO2 VSO2 ,вх VC0 ; хк – конечная степень
превращения в реакторе (на выходе из последнего слоя катализатора).
Разогрев реакционной смеси, несмотря на сложность внутренней структуры реакционного узла, равен адиабатическому разогреву.
Для других источников, не связанных с химическими реакциями, например фазовые превращениями (испарение, конденсация, плавление, сублимация, а также растворение):
qист |
Gi qфп |
j |
iGi qфп |
, |
(30) |
|
j |
j |
j |
|
|
|
|
|
|
где Gi - количество i-го компонента, изменившего свое фазовое состояние в j-м процессе; i - его доля от общего количества Gi; qфп - удельная теплота фазового превращения.
ФОРМА ПРЕДСТАВЛЕНИЯ МАТЕРИАЛЬНОГО БАЛАНСА
Существует несколько способов представления материального баланса ХТС. Например, на технологическую схему ХТС можно нанести показатели потоков (расход, температура, состав), связывающие её отдельные подсистемы или элементы. Такая форма удобна для быстрого контроля баланса по отдельным элементам и оперативного анализа результатов.
Однако наиболее полная и информативная форма представления состояния ХТС в виде сводной таблицы. В ней перечислены, а затем просуммированы все статьи или показатели входных и выходных потоков. Подобные таблицы приводят для отдельных элементов, подсистемы и ХТС в целом. Пример такой форы представления теплового баланса показан в табл. 1.
Таблица 1.
Таблица 1. Тепловой баланс узла окисления аммиака в производстве азотной кислоты (на 1т 100%-ной HNO)
Приход |
|
|
Расход |
|
|
|
|
|
|
|
|
Статья |
количество |
статья |
|
количество |
|
|
теплоты, кДж |
|
|
|
теплоты, кДж |
|
|
|
|
|
|
С аммиачно воздушной |
635,4 |
Нитрозные |
газы |
(на |
1390,7 |
смесью |
|
выходе |
из |
котла |
|
3883,2 |
утилизатора) |
|
|
||
|
|
|
|||
Теплота реакции |
|
|
|
|
3678,4 |
|
|
|
|
|
|
окисления аммиака |
638,3 |
На производство пара |
|
||
|
|
||||
Теплота окисления NO в |
|
Потери в |
окружающую |
87,8 |
|
NO2 (в котле |
|
среду |
|
|
|
утилизаторе) |
|
|
|
|
|
|
|
|
|
|
|
В с е г о |
5156,9 |
В с е г о |
|
|
5156,9 |
|
|
|
|
|
|
Достоинством представления балансов в форме таблиц является полнота и точность представленного материала, удобство практической работы с данными.
Другим способом является графическое оформление результатов балансов в виде диаграмм, наглядно передающим соотношение между какимито показателями потоков как показано на рис. 4 для того же процесса. Ширина потоков между элементами примерно пропорциональна величине демонстрируемого показателя. Такие диаграммы используются скорее для демонстрационных целей, нежели для количественного анализа процесса.
Рис.4. Тепловая диаграмма узла окисления аммиака: 1- реактор окисления, 2- котел-утилизатор.
Тепловой коэффициент полезного действия.
Рис.5. Состав энергетических потоков ХТС
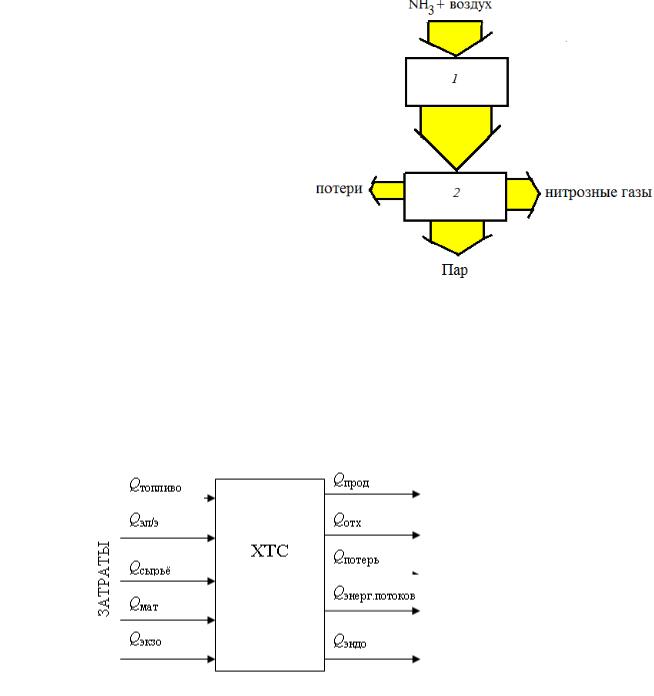
Источниками являются входящие потоки, несущие энергию топлива Qтопл, электроэнергию Qэн, теплоту сырья Qсыр и вспомогательных материалов Qмат, а также экзотермические реакции Qэкз. Их суммарное количество, или потребление, затраты энергии, - Qзатр. Из системы энергия выводится с потоками продуктов Qпрод и отходов производства Qотх, с энергетическими потоками Qэн, затрачивается на проведение эндотермических реакций Qэнд и теряется естественным путем Qпот. Из выходящих энергетических потоков полезно используется Qэн в виде пара котловутилизаторов, нагреваемых в теплообменниках-утилизаторах внешних потоков
