
- •ИНЖЕНЕРНАЯ
- •ВВЕДЕНИЕ
- •ПОЛУЧЕНИЕ ФЕРМЕНТОВ
- •ПОЛУЧЕНИЕ ФЕРМЕНТОВ
- •ПОЛУЧЕНИЕ АМИЛАЗЫ (ПРИМЕР ИЗ ЛЕК)
- •ПОЛУЧЕНИЕ ФЕРМЕНТОВ
- •СПОСОБЫ ИММОБИЛИЗАЦИИ ФЕРМЕНТОВ
- •СПОСОБЫ ИММОБИЛИЗАЦИИ ФЕРМЕНТОВ
- •СПОСОБЫ ИММОБИЛИЗАЦИИ ФЕРМЕНТОВ
- •МЕТОДЫ ИММОБИЛИЗАЦИИ ФЕРМЕНТОВ
- •МЕТОДЫ ИММОБИЛИЗАЦИИ ФЕРМЕНТОВ
- •БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ НА ОСНОВЕ ИММОБИЛИЗОВАННЫХ ФЕРМЕНТОВ
- •БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ НА ОСНОВЕ ИММОБИЛИЗОВАННЫХ ФЕРМЕНТОВ
- •ПОЛУЧЕНИЕ ГЛЮКОЗНО- ФРУКТОЗНЫХ СИРОПОВ
- •ПОЛУЧЕНИЕ БЕЗЛАКТОЗНОГО МОЛОКА
- •БИОСЕНСОРЫ НА ОСНОВЕ ИМБ ФЕРМЕНТОВ
- •ДОПОЛНИТЕЛЬНЫЕ ИСТОЧНИКИ

ИНЖЕНЕРНАЯ
ЭНЗИМОЛОГИЯ

ВВЕДЕНИЕ
Инженерная энзимология - это раздел биотехнологии, к которому относятся методы получения, очистки, стабилизации и применения ферментов.
Задача: конструирование биотех катализатора на основе ферментов и разработка на их базе эффективных и экочистых биотех процессов

ПОЛУЧЕНИЕ ФЕРМЕНТОВ
Получение ферментов с помощью микроорганизмов более выгодно, чем из растительных и животных источников.
Продуценты ферментов: бактерии, дрожжи, грибы
Выбор продуцента необходимого ферменту связан с проверкой активности большого кол-ва культур. Природные культуры не синтезируют ферменты в изб кол-ве, тк процесс их синтеза находится под строгим генетическим контролем
ФЕРМЕНТЫ – специфические катализаторы белковой природы, вырабатываемые клетками и тканями организмов

ПОЛУЧЕНИЕ ФЕРМЕНТОВ
В ре-те изм условий ферментации генетич аппарата клеток мик-ми синтезируются индуцибильные и репрессибельные ферменты
К индуцибильным отн ферменты, имеющие коммерческую ценность
ИНДУКЦИЯ – универсальный процесс для каталитических путей
Для получения индуц фермент, процесс ведут в присутствии субстрата – индуктора. Пример: для получения аммилаз в пит среду вносят крахмал, для получения рибонуклеаз – РНК
Выход ферментов можно увеличить с помощью методов генной инженерии. Пример: с помощью плазмид или бактериофагов можно увеличить кол-во генов кодирующих
синтез целевых ферментов

ПОЛУЧЕНИЕ АМИЛАЗЫ (ПРИМЕР ИЗ ЛЕК)
Увелечение выхода: грибы (продуценты) хорошо растут на синтетичнской среде сахарозы и нитрата. Для увеличения выхода сахарозу надо заменить на крахмал и увлечить концентрацию N и C. После этого активность фермента вырастит в 3 раза. Добавление к этой смеси аминокислот повышает активность еще в 5-6 раз. Оптимизирую состав пит среды можно повысить активность амилазы в 500 раз.
Источники углерода и азота: разложившееся крахмальное сырьё, кукурузный экстракт.
Большое влияние на синтез фермента оказывает наличие солей Mn, Mg, Co, Fe, Zn и тд

ПОЛУЧЕНИЕ ФЕРМЕНТОВ
Способы |
|
|
поверхностн |
|
|
ый |
|
|
|
||
производства |
|
|
|
|
|
||
|
|
|
|
ферментов |
|
глубинный |
|
|
|
|
|
переодическ
ое
непрервыно
е
Глубинный способ
• 3-3 суток
• Непрерывная подача стерильного воздуха
• Стабильная рН и t среды строго в опр условиях
• Важный пример: процесс образования продуцента амилазы не совпадает по времени с макс продукцией ферментов. Условия образования фермента отл от усл для синтеза биомассы, поэтому возможно культивирование в 2х последовательных ферментерах. После завершения ферментации для предвращения инактивации ферментов культуральную жидкость охлаждают и направляют на обработку. В связи с термолабильностью ферментов её ведут при строгоконтролируемых и часто

СПОСОБЫ ИММОБИЛИЗАЦИИ ФЕРМЕНТОВ
ИММОБИЛИЗАЦИЯ ФЕРМЕНТОВ - перевод ферментов в нерастворимое состояние с частичным или полным сохранением их каталитических свойств.
В результате иммобилизации ферменты становятся более устойчивыми к агрессивным воздействиям и стабильными. После иммобилизации ферменты легко удаляются из реакционной смеси и могут быть использованы многократно.
Подходы
иммобилизации
|
|
|
|
|
|
|
|
|
|
|
Добавление |
||
|
|
|
|
|||
Химически |
Иммобилизирую |
стабилизирующе |
||||
го вещества в |
||||||
модифицируют |
т на носителе |
|||||
среду с |
||||||
|
|
|
|
фермнтом |
||
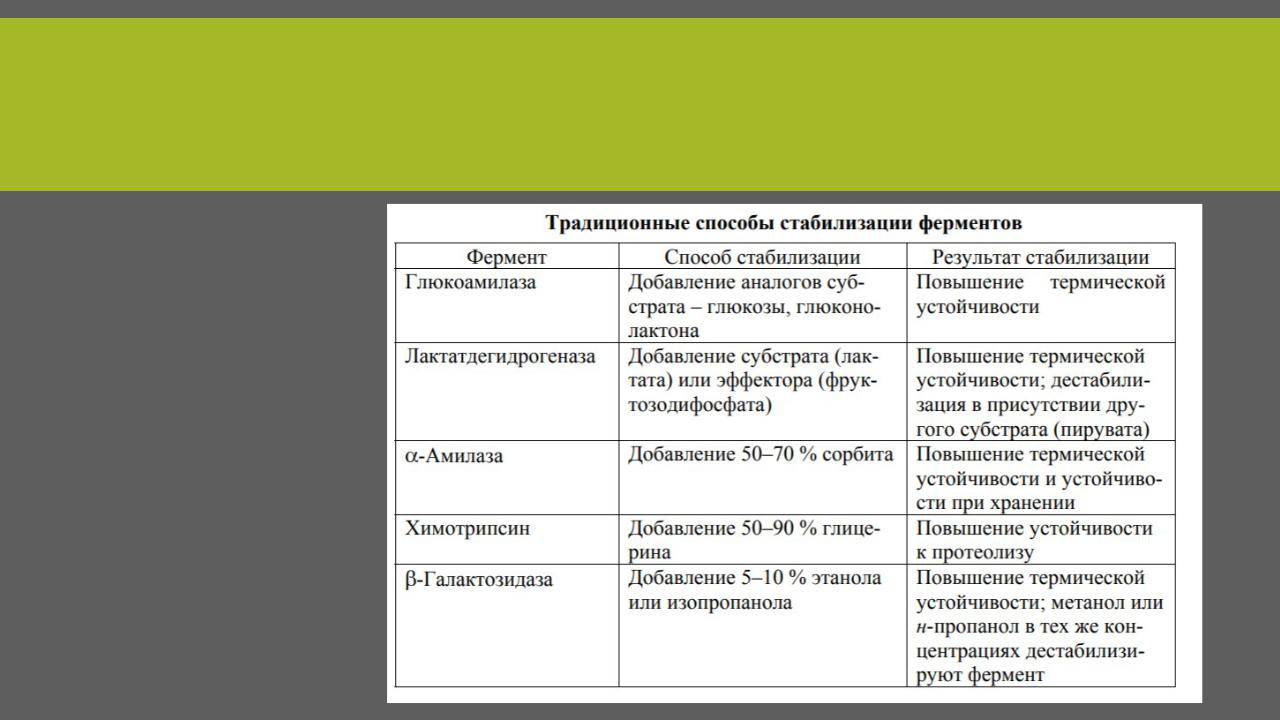
СПОСОБЫ ИММОБИЛИЗАЦИИ ФЕРМЕНТОВ
ПРИМЕРЫ

СПОСОБЫ ИММОБИЛИЗАЦИИ ФЕРМЕНТОВ
Вещества повышающие стабильность: субстраты или их аналоги, органические растворители, соли.
Субстрат связывается с активным центром фермента. Фермент-субстратный комплекс, как правило, более устойчив, чем свободный фермент. Химическая модификация белков является достаточно важным инструментом стабилизации ферментов
ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ – препараты ферментов, молекулы которого связаны с носителем, сохраняя при этом полностью или частично свои свойства

МЕТОДЫ ИММОБИЛИЗАЦИИ ФЕРМЕНТОВ
физические
•Основаны на:
•Адсорбция фермента на носителе*
•Инкапсулирование
•Механическое
включение фермента в гелевые структуры
химические
•Основаны на образовании ковалентных связей
