
імто / МОДЕЛЮВАННЯ МАСООБМІННИХ ПРОЦЕСІВ ХАРЧОВИХ ВИРОБНИЦТВ
.docxЛекція 14. МОДЕЛЮВАННЯ МАСООБМІННИХ ПРОЦЕСІВ ХАРЧОВИХ ВИРОБНИЦТВ
Контрольні питання:
14.1. В яких галузях харчової промисловості здійснюють хімічні та біохімічні процеси?
Хімічні процеси в харчовій промисловості здійснюються:
при очищенні дифузійного соку- Підігрітий до 85 — 90 °С дифузійний сік у дефекаторі двічі обробляється вапняним молоком у кількості 0,25 — 0,3 % від маси буряків — попередня дефекація і 2,0 - 2,25 % СаО — основна дефекація.
Під дією вапна білки й інші речовини, які містяться в дифузійному соку, коагулюють(випадають в осад). Пояснюється це тим, що колоїдні частинки несуть певний електричний заряд, який можна нейтралізувати, ввівши у розчин електроліт з протилежним електричним зарядом. Колоїд, який втратив свій заряд, стає нестійким, переходить у нерозчинний стан і коагулює. Крім того, в процесі дефекації відбуваються реакції між нецукрами дифузійного соку та іонами Са2+ і ОН~.
- освітлення цукрового сиропу
- фруктових соків і вина
14.2. Які особливості має біохімічна кінетика?
Ферменти не порушують рівноваги реакції, і в цьому вони не відрізняються від звичайних каталізаторів абіогенної природи. Ферментативні реакції приводять до повного виходу продуктів без утворення побічних речовин. Швидкість їхнього протікання при м'яких фізіологічних умовах (рН = 7; t = 37 °С) в 1012 —1018 разів більше, ніж без ферменту.
14.3.Який вигляд мають кінетичні рівняння простих та складних реакцій?
Прості:
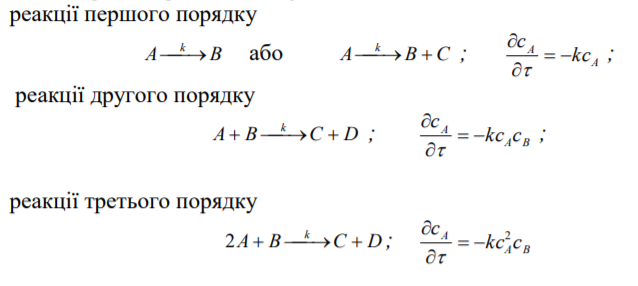
Складні:


14.4. Проведіть аналіз чисельних методів рішення диференціальних рівнянь, що описують динаміку теплообмінників.
В основі методів розрахунку теплообмінників лежить використання відповідної моделі структури потоку з урахуванням джерела тепла, описаного рівнянням теплопередачі. При математичному моделюванні проводиться втілення математичного опису в матеріальну математичну модель. Воно включає в себе розробку алгоритму розрахунку і його реалізацію на ЕОМ и т. д. Математичні моделі теплообмінних апаратів будуються на основі рівнянь теплового балансу і теплопередачі. Рівняння теплового балансу складаються на основі рівнянь гідродинаміки апаратів з урахуванням теплової ємності потоків, акумулювання тепла в нерухомих стінках і теплових ефектів хімічних реакцій. Рівняння теплового балансу складаються на основі рівнянь гідродинаміки апаратів з урахуванням теплової ємності потоків, акумулювання тепла в нерухомих стінках і теплових ефектів хімічних реакцій.
Цілеспрямована корекція ідентифікованих параметрів можлива лише на основі використання інформації про їх вплив на роботу теплообмінника. Мірою виконання цієї умови є середньоквадратичні нев’язкі 𝑄̅ к між розрахунковим теплоенергетичним показниками і реальними на існуючому 69 теплообміннику. Ці нев’язкі 𝑄̅ к залежать від ідентифіціруємих конструктивних параметрів 𝑌̅, що ідентифікуються, змінних стану теплообмінника 𝑋̅ і незмінних конструктивних параметрів 𝑍̅ теплообмінника. Дорівнюючи нев’язкі нулю отримаємо систему рівнянь:
![]()
Для розв`язку даної системи використаємо методом Ньютона-Рафсона [44 ]. У цьому випадку, ітеративна процедура формується так, що на кожній ітерації визначається адитивна похибка ∆𝑌к , т.е
![]()
Поправка ∆𝑌к є рішенням лінійного алгебраїчного рівняння
![]()
де 𝐴к‒ матриця Якобі виду 𝐴к = [ 𝜕Н̅ 𝜕𝑌̅ ]. Визначення елементів 𝐴к матриці Якоби виконується чисельно шляхом послідовного варіювання кожного з конструктивних параметрів 𝑌к і визначення відповідних неув’язок 𝑄̅ к Параметри можуть рахуватися ідентифікованими, якщо виконується умова:
![]()
де n‒число ітерацій, ℇ‒задана допустима похибка.
14.5. Які задачі вирішують при вивченні кінетики хімічних реакцій?
1. Розрахунок концентрації компонентів системи в певний момент часу або часу, протягом якого буде досягнутий заданий ступінь перетворення реагентів, при відомій схемі реакції та величинах констант швидкостей окремих стадій процесу (тобто відомо кінетичне рівняння реакції).
2. Визначення константи швидкостей окремих елементарних стадій за відомою схемою процесу та знайденим дослідним шляхом кінетичним кривим компонентів реакції.
14.6. Який характер мають реакції хімічної кінетики?
Хімічна кінетика вивчає закономірності протікання хімічних процесів у часі й вплив різних умов на хімічні перетворення (концентрації реагуючих речовин, температури, тиску, наявності каталізаторів і т.п.).
Отже, хімічна кінетика вирішує дві конкретні задачі:
1. визначення механізму реакції, тобто встановлення елементарних стадій процесу і послідовності їх протікання;
2. кількісний опис хімічної реакції, а саме: встановлення сурових співвідношень, що дають можливість обчислювати змінення кількості вихідних реагентів і продуктів протягом перебігу реакції.
Як правило, реакція протікає через декілька проміжних стадій, при складанні яких одержують сумарне рівняння реакції, тому кінетичні рівняння, які з урахуванням механізму реакції описують залежність швидкості від концентрації речовин, можна одержати лише експериментально. Встановлення механізму спирається на класифікацію реакції за молекулярністю, що визначається числом молекул, які беруть участь у так званому елементарному акті – одиничному акті взаємодії або перетворення частинок, внаслідок чого утворюються нові частинки продуктів реакції чи проміжних сполук.
14.7. За якою схемою здійснюється біохімічний процес?
Фермент на початку утворить фермент-субстратний комплекс зі своїм субстратом, а потім цей комплекс розпадається зі звільненням вільного ферменту і продукту реакції.
14.8. Здійсніть аналіз математичних моделей Міхаеліса-Ментен, Моно, Моно – Ієрусалимського біохімічного процесу.
Міхаеліса-Ментен:

Константа Міхаеліса:
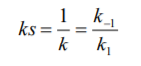
Модель Моно:
модель Моно, яка описує залежність питомої швидкості росту мікроорганізмів від концентрації субстрату:
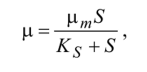
де Ks - константа; х т - максимальна питома швидкість росту мікроорганізмів; S- концентрація субстрату.
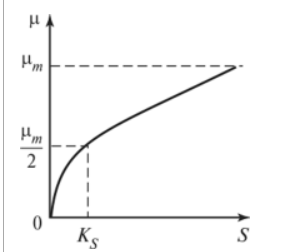
Залежність питомої швидкості росту від концентрації субстрату за моделлю Моно.
Єрусалимський врахував вплив продуктів метаболізму на швидкість росту мікроорганізмів і отримав більш складне вираз, ніж рівняння Моно. В цьому випадку вираз для питомої швидкості росту мікроорганізмів має вигляд:

де Р - концентрація продуктів метаболізму; КР - константа.
У разі малих значень концентрації продуктів метаболізму (при Р = 0) рівняння Моно-Ієрусалимського переходить в рівняння Моно.
Слід зазначити, що зростання культури мікроорганізмів залежить також і від інших чинників, зокрема температури, pH, тиску, присутності стимуляторів і інгібіторів.
