
- •Изменения относительной плотности и состава мочи.
- •Нарушения полового развития и половой функции у лиц генетически мужского пола
- •39.Способы и патогенетические принципы коррекции алкалозов.
- •Причины заболевания
- •44.Роль инсулинорезистентности в патогенезе метаболического синдрома.
- •49.Критерии и маркеры метаболического синдрома. Маркеры метаболического синдрома:
Нарушения полового развития и половой функции у лиц генетически мужского пола
Пубертатный период у мальчиков начинается в возрасте от 9,5 до 13,5 лет и продолжается около 3 лет. Увеличение яичек обычно является первым признаком полового созревания. Также признаками полового созревания являются акне, пубертатная гинекомастия лобковое и подмышечное оволосение и ряд других.
Эндокриногенные нарушения полового развития и половой функции у лиц мужского пола проявляются следующими типовыми формами: преждевременным половым развитием, задержкой полового развития, гипофункцией яичек. Преждевременное половое развитие Преждевременный пубертат - состояние, характеризующееся появлением всех или отдельных вторичных половых признаков у мальчиков до 9-летнего возраста. Нередко это сочетается с эмоциональными и поведенческими расстройствами, а также нарушением социальной адаптации. • Причины и виды. Различают истинное и ложное преждевременное развитие мальчиков.
♦ Истинное (первичное) преждевременное развитие мальчиков является результатом гиперфункции гипоталамо-гипофизарной системы и характеризуется полным преждевременным половым развитием (включая активацию сперматогенеза в яичках). Причина: преждевременная активация секреции гонадолиберина нейронами гипоталамуса.
♦ Ложное (вторичное) преждевременное развитие у мальчиков возникает в результате автономной гиперпродукции андрогенов. Характеризуется неполным преждевременным половым развитием (появлением признаков вирилизации без активации сперматогенеза). Наиболее частые причины: андрогенпродуцирующие опухоли яичек, гиперплазия клеток Лейдига и синтез ими избытка тестостерона, гиперсекреция андрогенов корой надпочечников. • Проявления преждевременного пубертата.
♦ Признаки вирилизации (появление лобкового и подмышечного оволосения, огрубение голоса, увеличение яичек и полового члена).
♦ Низкий рост (обусловлен преждевременным прекращением эпифизарного роста костей).
Задержка полового созревания и гипогонадизм Отсутствие у мальчиков признаков полового созревания к 14-летнему возрасту считается задержкой пубертата. • Причины задержки полового созревания у мальчиков и гипогонадизма у мужчин: ♦ Дефицит гонадолиберинов гипоталамуса или гонадотропинов аденогипофиза. ♦ Сниженная выработка тестостерона яичками (в результате их травмы, роста новообразований, нарушения развития, орхита и т.п.). ♦ Пониженная чувствительность тканей-мишеней к действию тестостерона.
• Проявления задержки полового созревания: ♦ Евнухоидизм (недоразвитые яички и пенис, отсутствие или слабо выраженные вторичные половые признаки, женоподобный (девичий) голос, ожирение, диспропорция скелета). ♦ Сниженное содержание тестостерона в крови.
• Проявления мужского гипогонадизма: ♦ Половое развитие у мужчин не нарушено. В связи с этим телосложение и тембр голоса у них в диапазоне нормы. ♦ Снижение полового влечения. ♦ Импотенция. ♦ Бесплодие. 55. Патофизиология тимуса и эпифиза. Виды, механизмы, проявления. Тимус как железа внутренней секреции. Гипофункция тимуса представлена в виде следующих синдромов: Ди-Джорджи. При этом генетическом заболевании тимус не закладывается во время внутриутробного развития. Наследуется оно по аутосомно-доминантному механизму. MEDAC-синдром. При этом синдроме развивается агрессия организма на собственные клетки. Страдает не только вилочковая железа, но и надпочечники, паращитовидные. Проявляется синдром в виде инсулинзависимого сахарного диабета, недостаточности надпочечников и паращитовидных желез. Для постановки диагноза не обязательно наличие всего комплекса, проявиться этот синдром может и в виде двух из описанных заболеваний. Гиперфункция тимуса встречается гораздо чаще, чем гипофункция и представлена таким заболеванием как тимома или тимомегалия. Увеличенный орган способен сдавливать крупные сосуды (верхнюю полую вену) трахею. Если такое происходит, у больного развивается сухой кашель, расширяются подкожные вены лица, верхнего отдела грудной клетки и верхних конечностей. Гипоплазия эпифиза Этиология и патогенез. При гипоплазии эпифиза в организме происходят изменения, связанные с нарушением его функции. Особое влияние при гипоплазии эпифиза на организм проявляется в случае ее возникновения в детском возрасте. У плода уже с первой половины внутриутробной жизни проявляется гормональная активность эпифиза. Эта железа до определенного возраста осуществляет свою тормозящую функцию во взаимосвязи со средним мозгом, поэтому при воспалительных и дегенеративных процессах в эпифизе, при органических и функциональных нарушениях эпифизарной области развивается так называемый эпифизарный синдром, свидетельствующий о поражении эпифиза. Клиника. При гипоплазии эпифиза у детей развивается преждевременное половое созревание и наблюдается отклонение в физическом развитии. Обычно дети до 5-7-летнего возраста опережают свой фактический возраст и половое развитие. Опухоли эпифиза Этиология. Опухоли эпифиза отнесены к нейроэктодермальным опухолям и подразделяются на пинеоцитомы и пинеобластомы. Патогенез. Патогенез связан с нарушением функций эпифиза. Клиническая картина. Клинические проявления при опухолях эпифиза весьма разнообразны, выделены определенные синдромы: 1) общемозговой; 2) стволовой (мезэнцефальный, четверохолмный, диэнцефальный, преждевременного полового созревания и физического развития); 3) мозжечковый; 4) синдром спонтанного прорыва в желудочковой системе. В связи с ростом опухоли, прежде всего, отмечают окклюзионную гидроцефалию. Венозный застой, вызванный опухолью, приводит к отеку мозга, блокаде сильвиева водопровода и скоплению ликвора в желудочковой системе. Отмечаются рвота, головокружение и двоение в глазах, шум в ушах, нарушение речи, обонятельные галлюцинации. Больные вялы, сонливы, инициатива у них отсутствует. Различают две основные формы патологических изменений эпифиза: гиперфункция (синдром Марбурга—Милку) и недостаточность эпифизарного мелатонина (синдром Пеллицци). Синдром Ма́рбурга—Ми́лку — гиперпродукция эпифизарного мелатонина вследствие гиперплазии пинеоцитов или опухоли (пинеалома). Помимо эпифиза мелатонин вырабатывается в других органах, например, апудоцитами кишечника. Эпифизарный мелатонин является антагонистом ряда тропных гормонов гипофиза (липотропинов, тиреотропного гормона и гонадотропинов), поэтому при его избытке развиваются (1) ожирение (эпифизарное ожирение), (2) гипотиреоз и (3) гипогенитализм. Синдром Пелли́цци — гипофункция эпифиза. Отсутствие тормозящего влияния мелатонина на формирование половой системы проявляется в её преждевременном созревании (к концу первого десятилетия жизни, а в ряде случаев и раньше). Болеют преимущественно мальчики (андротропизм). 56. Общая этиология и патогенез нарушений деятельности нервной системы. Причины повреждения элементов нервной системы могут быть экзогенными и эндогенными. • Экзогенные причины могут иметь физическую, химическую, биологическую природу или быть психогенными (например, психотравмирующие ситуации, устрашающие образы, звуки, ощущения). • Эндогенные факторы: нарушение циркуляции крови и ликвора в головном мозге, дисбаланс БАВ или их эффектов (гормонов, цитокинов, нейромедиаторов), гипоксия, чрезмерная активация СПОЛ, эндокринные заболевания, нарушение теплового и водноэлектролитного гомеостаза организма. Основными звеньями патогенеза большинства форм патологии нервной системы являются: повреждение нейронов, нарушение межнейронных взаимодействий, расстройство интегративной деятельности нервной системы. Повреждение нейронов Механизмы повреждения нейронов могут носить специфический и неспецифический характер. Неспецифические механизмы подробно рассмотрены в главе 4 «Патология клетки». К ним относятся: нарушение энергетического обеспечения, апоптоз нейронов, расстройства биосинтеза белка, аутолиз компонентов нейронов, дисбаланс ионов и жидкости, повреждение мембран. Специфические механизмы. Патогенетическую основу большинства форм нарушений нервной деятельности составляют раздельные или сочетанные расстройства специфических для нейрона процессов метаболизма различных нейромедиаторов. К специфическим механизмам повреждения нейронов относят следующие: ♦ расстройства синтеза нейромедиаторов; ♦ нарушения аксонного транспорта нейромедиаторов; ♦ расстройства секреции нейромедиатора; ♦ нарушения удаления нейромедиатора; ♦ расстройства взаимодействия нейромедиатора с его рецепторами. Нарушения межнейронных взаимодействий Эти нарушения реализуются посредством следующих механизмов: • Расстройства физико-химических процессов межклеточных взаимодействий (нарушения электрогенеза, расстройства восприятия возбуждения нейронами, нарушения аксонного транспорта). • Расстройства форм функционального взаимодействия нейронов: нарушение соотношения жёстко детерминированной и стохастической (вероятностно-статистической) формы реагирования на воздействие. Расстройства интегративной деятельности нервной системы подразумевают нарушение функционирования одного или нескольких звеньев нервной системы: афферентного, центрального и эфферентного. Это приводит к нарушениям деятельности функциональных и физиологических систем организма, а при тяжёлых поражениях - к их распаду. 57. Современные представления о механизмах развития нервной дистрофии. Нейрогенные расстройства трофики В рамках концепции нейротрофического контроля рассматривается несколько возможных механизмов его реализации: ♦ Изменение импульсной активности в аксонах (частота ПД, интервалы между ними). Предполагается, что вид импульсов имеет информационное значение. ♦ Образование специализированных нейротрофических факторов, транспортируемых по отросткам нервных клеток, секретируемых в синаптическую щель и взаимодействующих с постсинаптическими партнёрами. ♦ Изменение уровня функционирования постсинаптического пар- тнёра (старая идея атрофии органа от неупотребления). ♦ Сохранение постоянной синаптической передачи - состояния иннервированности. Развитие денервационного синдрома после повреждения нерва или блокады аксонного транспорта в нём является серьёзным следствием нарушения этого механизма. Нейродистрофический процесс Нарушение трофической функции нервной системы составляет патогенетическую основу нейродистрофического процесса. Нейродистрофический процесс может возникать как в периферических органах и тканях, так и в самой нервной системе. • В типичном варианте нейродистрофический процесс развивается при денервационном синдроме. Существенно, что при денервации снижается резистентность денервированного органа или ткани к повреждающим факторам: инфекции, механической травме, температурным и другим воздействиям. • Деафферентация. Нейтрофические расстройства развиваются при повреждении и афферентных структур нервной системы. Так, перерезка чувствительного нерва может приводить к не менее выраженным трофическим нарушениям в органе, чем его двигательная денервация. 58. Неврозы; принципы и методы моделирования. Значение типов высшей нервной деятельности в возникновении неврозов. Термин «невроз» применяют для обозначения функциональных расстройств нервной системы - нарушений ВНД. Неврозы относят к «болезням цивилизации» и связывают широкую их распространённость с нарастающей урбанизацией населения, информационными перегрузками, уменьшением доли физического труда в жизни современного человека, воздействием на него неблагоприятных социально-бытовых факторов, многочисленных психотравмирующих ситуаций. Неврозы характеризуются: ♦ расстройствами ВНД; ♦ развитием фазовых состояний в нервной системе; ♦ нейрогенными нарушениями вегетативных функций, движения, чувствительности, трофики; ♦ снижением резистентности организма к различным эндо- и экзогенным патогенным агентам. • Условия развития невроза: ♦ Биологические: наследственная предрасположенность, пол (невроз реже возникает у мужчин), возраст (невроз чаще развивается в пубертатном и климактерическом периодах), конституциональные особенности человека (к неврозам более склонны астеники),перенесённые и текущие заболевания, снижающие резистентность организма. ♦ Социальные: особенности профессиональной деятельности (например, информационные перегрузки, однообразие трудовых операций), неблагополучное семейное положение, неудовлетворительные бытовые условия, особенности сексуального воспитания и др. ♦ Психогенные: личностные особенности, психические травмы в детстве. Экспериментальное воспроизведение неврозов базируется на едином принципе: поставить перед животным непосильную для него задачу. С этой целью применяются воздействия, вызывающие перенапряжение и срыв процессов возбуждения или торможения, а также столкновение инстинктов альтернативной биологической значимости. Современные подходы к методам экспериментального воспроизведения неврозов у животных направлены на максимальное приближение к условиям их возникновения у человека. К таким методам относятся: ♦ Ограничение «рефлекса-инстинкта свободы» (например, насильственная фиксация животного в станке). ♦ Нарушение естественного суточного режима питания или светоритма, связанных со сменой дня и ночи. ♦ Изменение привычных стадно-иерархических или стадно-половых отношений (например, у обезьян). ♦ Предварительная астенизация нервной системы (например, под влиянием хронического шума, ионизирующей радиации, изоляции животного от родителей в раннем детском возрасте). Роль особенностей ВНД в возникновении неврозов Одни и те же психические травмы нередко вызывают различные нарушения нервных процессов в высших отделах нервной системы. Большое значение при этом имеет тип ВНД. • Меланхолик (слабый тип ВНД) наиболее подвержен невротическим расстройствам. Для таких людей характерна быстрая истощаемость возбудительного процесса, слабость внутреннего коркового торможения, пассивность реакции на воздействие. Это предопределяет возникновение невроза с развитием торможения и формированием пассивно-оборонительных реакций. • Холерик (сильный неуравновешенный тип). Этот тип отличается сильным возбудительным процессом, слабым корковым торможением, активными реакциями на раздражители. Это обусловливает развитие невроза возбудительного типа с формированием активнопоисковых реакций. • Флегматик (сильный уравновешенный инертный тип). Характеризуется развитием невроза с патологической подвижностью нервных процессов. • Сангвиник (сильный уравновешенный подвижный тип). Наиболее устойчив к воспроизведению неврозов в связи с высокой резистентностью его к различного рода патогенным агентам. 59. Расстройства в организме при неврозах, их основные проявления. Вегетоневроз. • Невроз навязчивых состояний. Все разновидности навязчивых состояний характеризуются повторяющимся чувством страха, боязни (фобии) чего-либо или кого-либо: определённых предметов, деятельности, ситуаций. Примеры подобных расстройств: ♦ клаустрофобия - боязнь закрытых помещений; ♦ агорофобия - боязнь открытых пространств; ♦ канцерофобия - боязнь опухолевых заболеваний. • Истерический невроз. Для истерии типична очень пёстрая и изменчивая симптоматика. Симптоматика истерии может быть сведена к нескольким группам болезненных проявлений. ♦ Неадекватное поведение. Больные отличаются повышенной аффективностью, впечатлительностью, внушаемостью и самовнушаемостью, неустойчивостью настроения, забывчивостью. ♦ Вегетативные расстройства (см. ниже). ♦ Двигательные расстройства. При истерии могут развиваться судорожные припадки (без потери сознания), преходящие парезы и параличи. ♦ Сенсорные нарушения. Истерический невроз нередко сопровождается преходящей слепотой, глухотой, потерей обоняния, вкуса, парестезиями. ♦ Сексуальные отклонения (например, импотенция, снижение либидо). • Неврастения считается наиболее распространённой формой невроза. Проявления: ♦ Вегетативные расстройства (см. ниже). ♦ Повышенные возбудимость, утомляемость и истощаемость нервной системы. ♦ Расстройства внимания, нарушение его концентрации. ♦ Сниженная работоспособность, вялость. ♦ Неустойчивость настроения, нередко - подавленность. ♦ Расстройства сна (нарушение засыпания, беспокойный сон, неприятные сновидения). ♦ Сексуальные нарушения (например, снижение сексуального влечения, импотенция). В процессе развития невротического состояния имеется закономерная последовательность включения в структуру невроза различных систем и, как следствие - формирование общих проявлений: • Неадекватность вегетативных реакций воздействию (например, тахикардия, аритмия, одышка, повышенная потливость, покраснение или побледнение кожи и слизистых, гипо- и гипертензивные реакции, нарушения сна и аппетита, ощущение болей в сердце, возникающих в ответ на воздействие, которому пациент придаёт особое значение). • Развитие патологических сенсомоторных реакций (например, повышенная чувствительность к различным внешним воздействиям или изменениям в организме, суетливость, бессмысленные излишние движения, жестикуляция, проходящие парезы и параличи, неадекватная событию мимика). • Частые аффективные реакции - бурное эмоциональное реагирование на воздействие или ситуацию (например, тревога, страх смерти, эмоциональное напряжение, рыдания, брань). • Интеллектуальный анализ болезненного состояния и принятие решения о форме поведения (выработка мер компенсации). Они направлены на преодоление сложившейся ситуации и болезненных ощущений. Указанная последовательность формирования проявлений в процессе развития неврозов выявляется у большинства пациентов. Существенно, что и в онтогенезе порядок включения реакций организма на различные воздействия носит ту же последовательность: вначале наблюдаются вегетативные реакции, а затем включаются сенсомоторные, аффективные и идеаторные. ПОНЯТИЕ О «ВЕГЕТОНЕВРОЗЕ» Одним из общих, постоянных и ранних компонентов невроза являются вегетативные расстройства: разнообразные синдромы нарушения функций внутренних органов и их физиологических систем (кровообращения, дыхания, пищеварения, половой и других). Они являются результатом центрогенных расстройств регуляции их деятельности нейрогенного генеза. В клинической литературе эти расстройства обозначают различными терминами: «нейроциркуляторная дистония», «вегетоневроз», «вегетодистония», «вегетативно-сосудистая дистония» и многими другими. Невротические состояния нередко предшествуют соматическим патологиям: ИБС, гипертонической болезни, язвенной болезни желудка и двенадцатиперстной кишки, различным эндокринопатиям. 60. Основные типы неврозов у человека. Невроз как предболезнь. Невроз является реакцией личности на трудную, часто не разрешимую для него ситуацию. Отношение личности к конкретной ситуации, которое делает невозможным и «непосильным» её рациональное решение. • Невроз навязчивых состояний. Все разновидности навязчивых состояний характеризуются повторяющимся чувством страха, боязни (фобии) чего-либо или кого-либо: определённых предметов, деятельности, ситуаций. Примеры подобных расстройств: ♦ клаустрофобия - боязнь закрытых помещений; ♦ агорофобия - боязнь открытых пространств; ♦ канцерофобия - боязнь опухолевых заболеваний. • Истерический невроз. Для истерии типична очень пёстрая и изменчивая симптоматика. Симптоматика истерии может быть сведена к нескольким группам болезненных проявлений. ♦ Неадекватное поведение. Больные отличаются повышенной аффективностью, впечатлительностью, внушаемостью и самовнушаемостью, неустойчивостью настроения, забывчивостью. ♦ Вегетативные расстройства (см. ниже). ♦ Двигательные расстройства. При истерии могут развиваться судорожные припадки (без потери сознания), преходящие парезы и параличи. ♦ Сенсорные нарушения. Истерический невроз нередко сопровождается преходящей слепотой, глухотой, потерей обоняния, вкуса, парестезиями. ♦ Сексуальные отклонения (например, импотенция, снижение либидо). • Неврастения считается наиболее распространённой формой невроза. Проявления: ♦ Вегетативные расстройства (см. ниже). ♦ Повышенные возбудимость, утомляемость и истощаемость нервной системы. ♦ Расстройства внимания, нарушение его концентрации. ♦ Сниженная работоспособность, вялость. ♦ Неустойчивость настроения, нередко - подавленность. ♦ Расстройства сна (нарушение засыпания, беспокойный сон, неприятные сновидения). ♦ Сексуальные нарушения (например, снижение сексуального влечения, импотенция). В процессе развития невротического состояния имеется закономерная последовательность включения в структуру невроза различных систем и, как следствие - формирование общих проявлений: • Неадекватность вегетативных реакций воздействию (например, тахикардия, аритмия, одышка, повышенная потливость, покраснение или побледнение кожи и слизистых, гипо- и гипертензивные реакции, нарушения сна и аппетита, ощущение болей в сердце, возникающих в ответ на воздействие, которому пациент придаёт особое значение). • Развитие патологических сенсомоторных реакций (например, повышенная чувствительность к различным внешним воздействиям или изменениям в организме, суетливость, бессмысленные излишние движения, жестикуляция, проходящие парезы и параличи, неадекватная событию мимика). • Частые аффективные реакции - бурное эмоциональное реагирование на воздействие или ситуацию (например, тревога, страх смерти, эмоциональное напряжение, рыдания, брань). • Интеллектуальный анализ болезненного состояния и принятие решения о форме поведения (выработка мер компенсации). Они направлены на преодоление сложившейся ситуации и болезненных ощущений. Указанная последовательность формирования проявлений в процессе развития неврозов выявляется у большинства пациентов. Существенно, что и в онтогенезе порядок включения реакций организма на различные воздействия носит ту же последовательность: вначале наблюдаются вегетативные реакции, а затем включаются сенсомоторные, аффективные и идеаторные. 61. Патофизиологические механизмы наркоманий. Наркомания - типовая форма психосоматической патологии, вызываемая средствами, включёнными в официальный список наркотиков. Каннабизм (от лат. Cannabis sativa - конопля индийская) развивается вследствие применения препаратов каннабиса: марихуаны, анаши,гашиша и др., содержащих психоактивное вещество тетрагидроканнабинол. • Эффекты от попадания тетрагидроканнабинола в кровь: ♦ Ощущение общей релаксации.
♦ Эйфория (напоминающая приём малой дозы алкоголя).
♦ Расстройства мышления.
♦ Нарушения концентрации внимания, снижение сообразительности.
♦ Поведенческие расстройства (аналогичные наблюдающимся при алкогольной интоксикации). • Метаболизм: в печени тетрагидроканнабинол превращается в соединения с более низким психоактивным эффектом. Кокаинизм развивается при употреблении кокаина, выделяемого из листьев растения Erythroxylon coca. Используется в виде белого кристаллического порошка. Действующее начало - метиловый эфир бензилэкгонина - стимулятор ЦНС, местный анестетик, вазоконстриктор. • Механизм действия: блокада трансмембранного переноса биогенных аминов в нейроны, торможение захвата катехоламинов окончаниями адренергических нервных волокон. • Эффекты: при применении кокаина улучшается настроение и самочувствие, увеличиваются ЧСС и АД (нередко - развитие гипертензивных реакций), повышается температура тела (иногда - гипертермия). • Метаболизм: кокаин разрушается в крови под действием эстераз. Его метаболиты выделяются с мочой. Опийная наркомания развивается при использовании опиатов: морфина, кодеина (3-метоксиморфина). Их получают из млечного сока опийного мака (Papaver somniferum). Из морфина производят полусинтетические соединения: гидроморфон, диацетилморфин (героин), оксикодон. Синтетический опиоид - тримеперидин. • Механизм и эффекты. Опиоиды взаимодействуют с опиатными рецепторами, имеющимися у клеток, в том числе - в нервных. Естественными лигандами для опиатных рецепторов являются эндогенные опиоидные пептиды: энкефалины, эндорфины, динорфин. При взаимодействии опиатов с рецепторами ЦНС развиваются следующие симптомы.
♦ Снижение остроты болевых ощущений. Опосредуется нейронами спинного мозга, таламуса и серого вещества в области сильвиевого водопровода.
♦ Седативный эффект. Реализуется при участии ретикулярной формации и полосатого тела.
♦ Эйфория. Развивается в связи с активацией лимбической системы.
♦ Угнетение дыхания. Обусловлено снижением чувствительности нейронов дыхательного центра к pCO2 в крови.
♦ Тошнота, рвота. Эффекты опосредуются нейронами продолговатого мозга. • Метаболизм. Опиоиды трансформируются в печени (в основном, путём конъюгирования с глюкуроновой кислотой). Выводятся из организма метаболиты опиоидов с калом, а также с мочой. Наркомания, вызванная галлюциногенами. Диэтиламид лизергиновой кислоты (ЛСД), мескалин и псилоцибин с лечебной целью не используются. При однократном применении оказывают психомиметический эффект и вызывают острые психозы. Повторное их использование быстро приводит к психической зависимости. Эффекты: ЛСД и мескалин - сильнодействующие и быстродействующие средства. Обычно уже через несколько минут регистрируются тахикардия, артериальная гипертензия, гипертермия, изменения настроения, нарушение реалистичности восприятия окружающей действительности, галлюцинации, синестезии. Могут развиться и состояния немотивированной паники, чреватые антисоциальными действиями (провокацией насилия, разрушением предметов и т.п.). Полинаркомании - одновременное или попеременное использование двух или нескольких наркотических средств. Особенности: потенцирование токсических эффектов потребляемых наркотиков, усугубление степени физической зависимости, тяжёлые расстройства жизнедеятельности организма, снижение эффективности терапевтических мероприятий. 3КЛИНИКА. 1.Патогенетические стадии раневого процесса, краткая характеристика. Раневой процесс – сложный комплекс биологических реакций организма, развивающийся в ответ на повреждение тканей и направленных на их заживление. Фаза воспаления 1-4 сут(имеет два периода: сосудистых изменений и очищения раны от некротических тканей.). Процесс заживления раны начинается с того момента, когда в ране под действием плазменных факторов свертывания и тромбоцитарного звена гемостаза останавливается кровотечение. В ране и окружающих тканях формируется ацидоз вследствие нарушения кровоснабжения поврежденных участков и накопления органических кислот. Если нормальное значение рН внутренней среды организма 7,3, в ране рН может снижаться до 5 и даже ниже. Параллельно с развитием ацидоза возникает и гиперкалиемия. Происходит активная экссудация в рану, что способствует ее очищению. Одновременные отек и набухание краев раны приводят к их сближению и совмещению, благодаря чему зона воспаления отграничивается от окружающей среды. Одновременно происходит склеивание краев раны при точном их сопоставлении благодаря выпадению фибрина на стенках раны. В ране происходит изменение метаболизма, обменные процессы сдвигаются в сторону катаболизма. Одновременно наблюдается миграция клеток воспаления в рану. Эти клетки под действием медиаторов воспаления производят выброс в рану ферментов и биологически активных веществ. Протеазы способствуют лизису нежизнеспособных тканей. Оксидаза препятствует чрезмерному накоплению токсинов. Супероксиддисмутаза приводит к накоплению активных форм кислорода, которые оказывают токсическое действие на микроорганизмы. Липаза разрушает защитные оболочки микробных клеток и делает их доступными для действия других факторов защиты. В конце фазы воспаления наблюдаются очищение раны от продуктов распада. Фаза пролиферации. 14-18 д. Характеризуется преобладанием процессов гранулирования. Грануляции – это молодая соединительная ткань, которая содержит большое количество клеточных элементов, способных к пролиферации. Улучшается трофика тканей, происходит врастание новых капилляров во вновь образованные ткани, улучшаются процессы микроциркуляции, уменьшается отек тканей. Метаболические процессы опять сдвигаются в сторону анаболизма. Фаза рубцевания. В зависимости от того как происходило заживление раны (первичным или вторичным натяжением), либо наблюдается эпителизация раны путем наползания эпителия с краев раны (происходит заживление под струпом или первичным натяжением), либо формируется грубый соединительнотканный рубец (происходит заживление вторичным натяжением). 2.Особенности течения раневого процесса по сравнению с воспалением в глубоких тканях. Первичное и вторичное инфицирование, секвестр, грануляционная ткань, раневая контракция, эпителизация. Воспаление - рефлекторная реакция организма, возникающая под влиянием болезнетворных раздражителей. Это преимущественно местное проявление общей реакции организма, которая выражается в виде комплекса местных повреждений ткани и органов и возникающих в них нарушений трофики, обмена веществ и кровообращения. Первичное инфицирование 24ч— это внесение бактериальной флоры в рану с инструмента или травмирующего агента в момент повреждения тканей с одежды пострадавшего, с его кожи или из поврежденных органов. Все раны, в том числе и операционные, как в хирургии так и в травматологии считаются первично загрязненными, поскольку какое-то количество микробов попадает на раневую поверхность из воздуха даже при безукоризненном соблюдении правил асептики и антисептики. Вторичное инфицирование 48ч— это занесение бактериальной флоры в рану через некоторое время после нанесения травмы, что обычно связано с оказанием помощи, перевязкой и определяется качеством, а также квалификацией первичной и лечебной помощи. Секвестр — участок омертвевшей ткани, свободно располагающейся среди живых тканей. Грануляционная ткань или грануляции — молодая соединительная ткань, образующаяся при процессах заживления дефектов в различных тканях и органах. Строение грануляционной ткани. В грануляционной ткани различают шесть слоёв, каждый из которых выполняет определённую функцию. 1. Поверхностный лейкоцитарно-некротический слой состоит из лейкоцитов, детрита и слущивающихся клеток. Он существует в течение всего периода заживления раны. 2. Слой сосудистых петель содержит, помимо сосудов, полибласты. При длительном течении раневого процесса в этом слое могут образоваться коллагеновые волокна, располагающиеся параллельно поверхности раны. 3. Слой вертикальных сосудов построен из периваскулярных элементов и аморфного межуточного вещества. Из клеток этого слоя образуются фибробласты. Этот слой наиболее выражен в раннем периоде заживления раны. 4. Созревающий слой - по существу, более глубокая часть предыдущего слоя. Здесь околососудистые фибробласты принимают горизонтальное положение и отходят от сосудов, между ними развиваются коллагеновые и аргирофильные волокна. Этот слой, характеризующийся полиморфизмом клеточных образований, остаётся одинаковым по толщине в течение всего процесса заживления раны. 5. Слой горизонтальных фибробластов - непосредственное продолжение предыдущего слоя. Он состоит из более мономорфных клеточных элементов, богат коллагеновыми волокнами и постепенно утолщается.6. Фиброзный слой отражает процесс созревания грануляций. КОНТРАКЦИЯ - сокращение раны в размерах по направлению к центру в результате образования в ее краях рубцовой ткани; Под эпителизацией тканей понимают процессы формирования эпителия в зонах повреждения кожного покрова либо слизистых оболочек, способствующие восполнению дефектов. 3.Воздействие раневого процесса на состояние и жизнедеятельность организма. Рана как тканевой дефект возникает вследствие механического повреждения покровов и глубжележащих тканей, она является сильным раздражителем, включающим подкорковые центры, ретикулярную формацию, систему гипоталамус – гипофиз – кора надпочечников. Возникающий в результате такого включения рефлекторной и эндокринной систем реактивный процесс оказывается анатомически локализованным (местным), а физиологически генерализованным (общим). При раневом процессе местная и общая реакция организма находится в прямой зависимости от тяжести и особенностей повреждений тканей и органов, а также от вида и вирулентности раневой инфекции. Раневая болезнь достаточно хорошо выражена при значительных кровотечениях, наличии в ране мёртвых тканей, обширном нагноении, затруднённом выделении из раны гнойного и ихорозного экссудата, как правило, при полостных ранениях и раневой инфекции. Клинически раневая болезнь характеризуется высокой общей температурой, угнетением, потерей аппетита, ухудшением функции органов пищеварения, стойкими, нередко прогрессирующими отеками, некрозами в зоне раны и другими признаками. Для 1-й фазы (1-4-е сутки после ранения) характерно возбуждение симпатического отдела вегетативной нервной системы, сопровождающееся повышенным выбросом адреналина в кровь, под влиянием которого повышается жизнедеятельность организма, основной обмен, усиливается распад белков, жиров и гликогена, снижется проницаемость клеточных мембран, угнетаются механизмы регенерации, повышается свертываемость крови. Повышается активность коркового вещества надпочечников, выделяющего глюкокортикоидные гормоны, которые оказывают противовоспалительное действие. В первой фазе, которая называется катаболической, длительностью 1-4 дня после травмы, характеризуется усилением всех процессов жизнедеятельности, повышением температуры, снижением массы тела в связи с повышением распада белков, жира и гликогена. Наряду с этим снижается проницаемость клеточных мембран, подавляется синтез белка. Эти изменения происходят на фоне выделения в кровь адреналина, кортикотропина и глюкокортикоидов, обладающих индуцирующим эффектом. Для 2-й фазы (4-10-е сутки после ранения) характерно повышенное влияние парасимпатического отдела вегетативной нервной системы, действие минералокортикоидных гормонов, альдостерона, активируется процесс регенерации. В этой фазе происходит нормализация обмена веществ, особенно белкового, активизируется процесс заживления раны. Происходит повышение массы тела, нормализация белкового обмена, мобилизуются репаративные возможности организма. При неосложненном течении к 4-5-суткам купируются явления воспаления и интоксикации, стихает боль, прекращается лихорадка, нормализуются лабораторные показатели крови и мочи. При наличии осложнений в ране длительность и выраженность фаз меняется. 4.Заживление ран первичным и вторичным натяжением, условия, последствия. Заживление первичным натяжением происходит в более короткие сроки с образованием тонкого, относительно прочного рубца. В данном случае речь идет о ранах с небольшой потерей ткани, имеющих гладкие края. Края раны находятся недалеко друг от друга, рана чистая, не загрязненная микробами или инородными телами и не содержит некротической (мертвой) ткани. Кроме того, ткань вокруг раны хорошо снабжается кровью. Примером подобных ран могут служить небольшие послеоперационные рубцы, края которых плотно соединяются путем наложения швов. При воспалении раны заживление происходит только с образованием обширного рубца (вторичное заживление). Случайные поверхностные раны небольшого размера с расхождением краев до одного сантиметра также могут заживать первичным натяжением без наложения швов. Это происходит из-за сближения краев под воздействием отека окружающих тканей, а в дальнейшем их удерживает образующаяся «первичная фибриновая спайка». Таким образом, при данном способе заживления между краями и стенками раны никакой полости нет, и образующаяся ткань служит лишь для фиксации и укрепления срастающихся поверхностей. Первичным натяжением заживают операционные раны, когда края раны соприкасаются друг с другом (соединены швами). Количество некротических тканей в ране при этом небольшое, воспаление выражено незначительно. условия: · отсутствие в ране инфекции; · плотное соприкосновение краев раны; · отсутствие гематом и инородных тел в ране; · отсутствие некротических тканей в ране; · удовлетворительное общее состояние больного. 2. Заживление вторичным натяжением – заживление через нагноение, через развитие грануляционной ткани. В этом случае, когда заживление происходит после выраженного воспалительного процесса, в результате которого рана очищается от некроза. Для заживления ран вторичным натяжением необходимы условия, противоположные тем, которые способствуют первичному натяжению: · значительное микробное загрязнение раны; · значительный по размерам дефект кожных покровов; · наличие некротических тканей; · неблагоприятное состояние организма больного. При вторичном натяжении присутствует две фазы заживления, каждая из которых имеет определенные отличия. В первом периоде воспаления выражены гораздо больше, и очищение раны протекает намного длительнее. На границе воспаления образуется выраженный лейкоцитарный вал. Он способствует отграничению здоровых тканей от инфицированных. Постепенно происходит демаркация, лизис. В результате в конце первой фазы образуется раневая полость и наступает вторая фаза – фаза регенерации. (Заживление вторичным натяжением длительный процесс (несколько недель). Рубец при этом грубый. При его сморщивании могут наступить контрактура сустава (если рана располагалась в области сустава) и деформация данного участка тела.) Различают заживление под струпом, которое наблюдается при небольших поверхностных повреждениях раны, чаще ссадинах, потертостях, ожогах, когда раневой дефект покрывается коркой из подсохшей крови, лимфы и межтканевой жидкости (струп). Образовавшийся струп выполняет защитную функцию, под ним идет процесс заполнения дефекта нежной грануляционной тканью и регенерации эпидермиса. 5.Способы и принципы лечения ран. В основу современных методов лечения ран положены: профилактика и борьба с раневой инфекцией и интоксикацией; учет местной и общей реакции организма на травму и инфекцию раны; динамические данные (период или фаза раневого процесса); индивидуализация больного, его возрастные типологические особенности. В 1-м периоде, или фазе, раневого процесса рекомендуется покой, физическая и химическая антисептика, повышение экссудации, содействие активной гиперемии, набуханию коллоидов, ферментативному расщеплению омертвевающих тканей, повышению фагоцитоза и уменьшению вирулентности микробов. Не рекомендуются травмирующие перевязки, сосудосуживающие средства и средства, уменьшающие гидратацию и высушивающие рану (частые перевязки, лед, кальций, сухие повязки и др.). Наиболее приемлемыми средствами в этом периоде будут осмотические средства, бактерицидные, антисептические препараты (пенициллин, сульфаниламиды, грамицидин, хлорамин, хлорацид, мазь Вишневского), бактериофаги, ферменты и др. Во 2-м периоде, когда рана почти очищена от продуктов распада, когда имеется прочный раневой барьер, когда большая часть бактерий фагоцитирована или потеряла свою активность, когда морфологически мы имеем мононуклеарную реакцию и частичный переход макрофагов в стадию фибробластов, средства, применяемые в 1-й период воспалительного процесса, во 2-м периоде применять нельзя: противопоказаны гипертонические растворы, влажные повязки, антисептические средства и др. Во 2-м периоде раневого процесса надо защищать грануляции от повреждений и вторичной инфекции, способствовать грануляции, рубцеванию и эпителизации. Рекомендуются повязки с рыбьим жиром, вазелином, стерильным индифферентным порошком, тальком или открытое лечение. Применяются физиотерапевтические процедуры. Лечение хронических ран должно быть максимально атравматичным и соответствовать принципу, принятому всеми современными хирургами: «Не вводите в рану то, что не ввели бы в собственный глаз». Использования дезинфицирующих средств йод-повидона, перекиси водорода, гипохлорида натрия следует избегать, поскольку они не только уничтожают микробы, но и повреждают нормальную ткань. Полезнее промывать рану стерильным физиологическим раствором. 6.Полиорганная недостаточность, определение, общая характеристика причин. Полиорганная недостаточность — тяжёлая неспецифическая стресс-реакция организма, совокупность недостаточности нескольких функциональных систем, универсальное поражение всех органов и тканей организма агрессивными медиаторами критического состояния с временным преобладанием симптомов той или иной органной недостаточности - легочной, сердечной, почечной и т. д. Полиорганная недостаточность развивается как исход тяжёлой сочетанной травмы, эклампсии, сепсиса, инфекционно-токсического и геморрагического шока, асистолии, комы, вызванной диабетом, менингоэнцефалитом, отравлениями. В развитии синдрома ПОН выделяют три основных фазы: •Индукционную фазу, результатом которой является синтез целого ряда гуморальных факторов, запускающих реакцию системного воспалительного ответа. •Каскадную фазу, сопровождающуюся развитием острого легочного повреждения, активацией каскадов калликреин-кининовой системы, системы арахидоновой кислоты, свертывающей системы крови и других. •Фазу вторичной аутоагресии, предельно выраженной органной дисфункции и стабильного гиперметаболизма, в которую организм больного теряет способность к самостоятельной регуляции гомеостаза. В основе: Синдром системного воспалительного ответа: общей воспалительной реакции организма в ответ на тяжелое поражение, вне зависимости от локализации очага. Процесс идет при участии медиаторов воспаления с вовлечением практически всех систем организма. Воспалительная реакция организма в ответ на внедрение в организм инфекции, обширные травмы, развития некроза тканей, тяжелые ожоги развивается по одним и тем же общим закономерностям. Эта реакция является приспособительной функцией организма и направлена на уничтожение агента, вызвавшего процесс, и восстановление поврежденной ткани. При легких поражениях воспалительный процесс ограничивается локальными воспалительными изменениями и умеренной, малозаметной общей реакцией органов и систем. 1. Локально цитокины защита и заживление. 2. Цитокины в кровоток, активация макрофагов, тромбоцитов, роста. 3.Генерализация воспалительной реакции, доминирование деструктивных эффектов цитокинов, нарушение проницаемости эндотелия и полиорганная дисфункция. Гиперметаболизм (из-за гипоксии): Для энергии. Расстройства обмена протеинов характеризуются перераспределением белков в организме. Ускоренный распад протеинов является донатором предшественников для активного печеночного глюконеогенеза и синтеза острофазовых белков. Однако имеющий место синтез белка не позволяет компенсировать возросший катаболизм мышечных и висцеральных протеинов, что приводит к отрицательному азотистому балансу. Липиды являются наиболее расходуемым при критических состояниях источником энергии. Жировая ткань распадается на жирные кислоты, попадающие в системный кровоток, а затем и в печень. Неадекватная перфузия ткани тормозит липолиз. Выброс цитокинов способствует снижению утилизации жирных кислот и триглицеридов за счет подавления активности липопротеинлипазы. Кишечник: играет центральную роль в патогенезе. Стенка кишечника богато выполнена лимфоидной тканью, которая взаимодействует с бактериальной флорой кишечника и факторами питания; в норме бактерии и токсины из просвета кишечника в небольшом количестве проникают через систему портальной вены в печень, где осуществляется их клиренс Купферовскими и ретикулоэндотелиальными клетками. Слизистая кишечника постоянно обновляется, имеет высокую степень метаболической активности и, таким образом, является более уязвимой для ишемии и атрофии. Если эпителиоциты лишены номинального притока питательных веществ, то имеет место снижение активности репродукции и миграции клеток, а также синтеза ДНК и барьерной функции кишечника. Высокое содержание бактерий в просвете кишечника, предрасположенность слизистой к ишемии, гипоксии и атрофии - все это служит основой гипотезы о бактериальной транслокации при критических состояниях. Условнопатогенные и патогенные ГР- выделяют токсины, + медиаторы= увеличение проницаемости = перемещению эндотоксинов и бактерий в мезентериальные лимфатические узлы, а затем в кровеносные сосуды. Высокое содержание бактерий в просвете кишечника, предрасположенность слизистой к ишемии, гипоксии и атрофии - все это служит основой гипотезы о бактериальной транслокации при критических состояниях. Респираторный дистресс: Отек, приводит к гипоксии. Острое состояние, характеризующееся двусторонней инфильтрацией лёгких. В основе ОРДС лежит диффузное воспаление лёгких. Цитокины=увеличение проницаемости=отек. Это приводит к повреждению эндотелия капилляров и эпителия альвеол, нарушая альвеолярно-капиллярный барьер. В результате экссудат проникает в лёгочную паренхиму и альвеолярное воздушное пространство. 7.Роль синдрома системного воспалительного ответа в патогенезе полиорганной недостаточности. Синдром системного воспалительного ответа: общей воспалительной реакции организма в ответ на тяжелое поражение, вне зависимости от локализации очага. Процесс идет при участии медиаторов воспаления с вовлечением практически всех систем организма. Воспалительная реакция организма в ответ на внедрение в организм инфекции, обширные травмы, развития некроза тканей, тяжелые ожоги развивается по одним и тем же общим закономерностям. Эта реакция является приспособительной функцией организма и направлена на уничтожение агента, вызвавшего процесс, и восстановление поврежденной ткани. При легких поражениях воспалительный процесс ограничивается локальными воспалительными изменениями и умеренной, малозаметной общей реакцией органов и систем. 1. Локально цитокины защита и заживление. 2. Цитокины в кровоток, активация макрофагов, тромбоцитов, роста. 3.Генерализация воспалительной реакции, доминирование деструктивных эффектов цитокинов, нарушение проницаемости эндотелия и полиорганная дисфункция. SIRS - симптомокомплекс, характеризующийся воспалительной реакцией в системе эндотелиоцитов, обуславливающий направленность воспалительного ответа на повреждение. Первый, начальный – период гипервоспаления, характеризующийся выбросом сверхвысоких концентраций провоспалительных цитокинов, окиси азота (NO), что сопровождается развитием шока и ранним формированием синдрома полиорганной недостаточности. Однако уже в данный момент происходит компенсаторное выделение противовоспалительных цитокинов; В результате дисфункции печени, почек, кишечника появляются новые факторы повреждающего воздействия. В роли таковых выступают промежуточные и конечные продукты нормального обмена в высоких концентрациях (лактат, мочевина, креатинин, билирубин); накопленные в патологических концентрациях компоненты и эффекторы регуляторных систем (калликреин-кининовой, свертывающей, фибринолитической, перекисного окисления липидов, нейромедиаторы); продукты извращенного обмена (альдегиды, кетоны, высшие спирты), вещества кишечного происхождения типа индола, скатола. 8.Провоспалительные и противовоспалительные медиаторы, их роль в патогенезе местного воспаления и в патогенезе синдрома полиорганной недостаточности. Провоспалительные медиаторы( медиаторы альтерации и экссудации) Цитокины: Наиболее значимыми являются фактор некроза опухоли (TNF) и интерлейкины 1, 6, 10. Они способны оказывать как местное так и дистальное воздействие (на отдаленные органы и ткани). Общим для всей группы является усиление адгезии и агрегации лейкоцитов, а также гиперкатаболический и гипердинамические эффекты. Именно цитокины являются медиаторами первого ряда, которые сами способны вызывать каскады гуморальных реакций. Основными цитокинами , отвечающими за стимуляцию системного ответа в острой фазе являются интерлейкин-1, интерлейкин-6 и фактор накроза опухоли, при этом интерлейкин-6 играет доминирующую роль. Первичное действие цитокинов направлено на изменение генного ответа. TNF и интерлейкин-1 показали способность к прямому транскрипционному воздействию на продукцию интерлейкина-6. Гидролитические ферменты лизосом–нейтральные и кислые протеазы, липазы, гликозидазы, фосфатазы-разрушение коллагена, эластина, базальных мембран, гликопротеидов, компонентов межклеточного вещества, липидов и т.д , и активация полипептидных каскадных медиаторных систем (калликреин-кининовая, свертывающая система, система комплемента, система фибринолиза),активация образования эйкозаноидов (Совокупные эффекты характеризуются раз-витием бронхоконстрикции, повышенной проницаемостью мембран, микротромбозом, адгезией, агрегацией, дегрануляцией лейкоцитов.) и др. производных арахидонового каскада. Биогенные амины: - Гистамин (тканевые базофилы, тромбоциты, эндотелий, гладкомышечные клетки). - Серотонин(энтерохромаффинные клетки, тромбоциты, эозинофилы) - агрегация тромбоцитов, бронхоспазм, расширение артериол, повышение проницаемости, спазм поврежденных сосудов,стимуляция стероидогенеза. - Адреналин, норадреналин (тромбоциты) – спазм сосудов, снижение проницаемости, агрегация тромбоцитов. Кинины: Фибронектин - белок, существующий в двух основных формах. Тканевая - обеспечивает непроницаемость волокон и соединений клеток. Циркулирующая - вызывает адгезию частиц, подлежащих уничтожению, к макрофагам и эндотелию. Комплемент: С5а-сверхсильный анафилотоксин, освобождает гистамин из мастоцитов и базофилов, повышение проницаемости эндотелия посткапиллярных венул, хемоаттрактант нейтрофилов, базофилов, эозинофилов, макрофагов, ингибитор миграции макрофагов, стимулятор липоксигеназы фагоцитов, спазм гладких мышц, стимуляция лейкоцитарной адгезии, увеличивает освобождение ИЛ-1 (интерлейкина –1) и ФАТ (фактора активации тромбоцитов). С3а-анафилотоксин средней силы, эффекты сходны с С5а, хемоаттрактантное действие очень слабое, не активирует липооксигеназу. С2а-вазоактивный пептид, расширяет микроциркуляторные сосуды, увеличивает сосудистую проницаемость, эффектор наследственного ангионевротического отека. С3b,С4b-маргинация лейкоцитов, синтез простагландинов, опсонизация клеток, стимуляция экзоцитоза и фагоцитоза. С5b67-хемоаттрактант лейкоцитов. Эйкосаноиды - продукты распада арахидоновой кислоты. К ним относят тромбоксаны, лейкотриены, эпоксиды. Совокупные эффекты характеризуются развитием бронхоконстрикции, повышенной проницаемостью мембран, микротромбозом, адгезией, агрегацией, дегрануляцией лейкоцитов. Противовоспалительные медиаторы( медиаторы пролиферации). -Гепарин (мастоциты, эозинофилы, базофилы, макрофаги, фибробласты). –связывает биогенные амины, ингибирует комплемент, коагуляцию, адгезию, агрегацию, снижает активность кининовой системы,служит структурным компонентом межклеточного вещества соединительной ткани. Ингибиторы протеаз – альфа-1-антитрипсин, альфа-2-макроглобулин, антиплазмин, антитромбин – III, ингибиторы комплемента и др. – подавляют активность лизосомальных гидролаз и сторожевой контактной полисистемы крови, уменьшают альтерацию и ликвидируют последствия экзоцитоза. Антифосфолипазы – макрокортин, ренокортин, липомодулин –ингибируют образование эйкозаноидов. Антиоксиданты - церулоплазмин, гаптоглобин, гемопексин, транскобаламин, пероксидаза, супероксиддисмутаза, бета-2-микроглобулин, амилоид-А, С-реактивный белок - инактивация активных кислородных радикалов и липоперекисей. ИЛ-10 ( Т-лимфоциты) – ингибитор продукции цитокинов, блокирует функции Th1-хелперов. 9.Роль эндотелия в патогенезе полиорганной недостаточности. − эндотелий активно меняет проницаемость сосудистой стенки посредством медиаторов, вырабатываемых эндотелиоцитами; Окись азота (NO) - эндотелий-расслабляющий фактор, вазодилататор, воздействующий через систему гуанилатциклазы и вызывающий вазоплегию, часто сопровождающую клинику рефрактерного шока. − эндотелий вырабатывает ряд вазоактивных веществ, действующих на сосудистые и гладкие мышцы, расширяющих или суживающих сосуды, и регулирует, таким образом, объем и скорость кровотока определенных участков тканей; − в эндотелии синтезируются факторы свертывающей, антикоагулянтной и фибринолитической систем, на его поверхности осуществляется взаимодействие этих факторов; сосудистая стенка также принимает активное участие в атерогенезе; − взаимодействие клеток крови (лейкоцитов и тромбоцитов) - адгезия,агрегация и трансформация - осуществляется при активном участии эндотелия. 10.Метаболические нарушения в патогенезе полиорганной недостаточности. представляет собой генерализованную реакцию, при которой происходит мобилизация энергии и субстратов для поддержания воспаления, иммунных реакции и регенерации ткани. Увеличение потребления кислорода и выработки углекислоты является следствием возрастающей почти в два раза энергопотребности покоя. Индукционную фазу, результатом которой является синтез целого ряда гуморальных факторов, запускающих реакцию системного воспалительного ответа; Каскадную фазу, сопровождающуюся развитием острого легочного повреждения, активацией каскадов калликреин-кининовой системы, системы арахидоновой кислоты, свертывающей системы крови и других; Фазу вторичной аутоагресии, предельно выраженной органной дисфункции и стабильного гипер-метаболизма, в которую организм больного теряет способность к самостоятельной регуляции гомеостаза; Основной чертой всей совокупности изложенных изменений обмена веществ является сочетание гиперпотребности организма в различных субстратах для адаптации к повышенным затратам энергии с толерантностью тканей к этим же субстратам - синдром гиперметаболизма (гиперкатаболизма, "аутоканнибализма"). Этому синдрому отводится ведущая роль в патогенезе полиорганной недостаточности. Гиперметаболизм (из-за гипоксии): Для энергии. сопровождается значительным увеличением потребления кислорода, отрицательным азотистым балансом, гиперпродукцией С02, что может потребовать увеличения минутной вентиляции до 15-20 л/мин. Тканевая дизоксия служит базой для формирования аномального механизма экстракции кислорода периферическими тканями. Происходит это за счет недостаточной десатурации поступающего в капиллярах гемоглобина. Системный выброс цитокинов, катехоламинов, ангиотензина II, простогландинов способствует формированию тканевого шунта со снижением перфузии. Расстройства обмена протеинов характеризуются перераспределением белков в организме. Ускоренный распад протеинов является донатором предшественников для активного печеночного глюконеогенеза и синтеза острофазовых белков. Однако имеющий место синтез белка не позволяет компенсировать возросший катаболизм мышечных и висцеральных протеинов, что приводит к отрицательному азотистому балансу. Липиды являются наиболее расходуемым при критических состояниях источником энергии. Жировая ткань распадается на жирные кислоты, попадающие в системный кровоток, а затем и в печень. Неадекватная перфузия ткани тормозит липолиз. Выброс цитокинов способствует снижению утилизации жирных кислот и триглицеридов за счет подавления активности липопротеинлипазы.. В терминальной стадии заболевания выражен катаболизм протеинов мышц. Он возникает из-за углеводов и жиров, если пациент находится в очень тяжелом состоянии, и если формируется невосполнимый энергетический дефицит. Развивается протеинозависимый энергетический обмен, в основе которого лежат активация протеолиза и распад структурных белков жизненно важных органов, мышечной ткани. Активированные вирусные и микробные токсины, а также мастоциты и макрофаги выделяют вещества, которые, в свою очередь, могут провоцировать тканевые и клеточные повреждения. В патогенез имеет месте свободнорадикальное окисление. Оно повреждает клетки. Следствием прогрессирующего течения гиперметаболизма является не только специфичная органная дисфункция, но и белково-энергетическая недостаточность с последующим истощением (кахексией), что логически замыкает порочный круг синдрома ПОН. 11.Роль кишечной микрофлоры и лимфоидной ткани кишечника в патогенезе полиорганной недостаточности. Кишечник играет центральную роль в патогенезе развития полиорганной недостаточности при критических состояниях. Кишечник: играет центральную роль в патогенезе. Стенка кишечника богато выполнена лимфоидной тканью, которая взаимодействует с бактериальной флорой кишечника и факторами питания; в норме бактерии и токсины из просвета кишечника в небольшом количестве проникают через систему портальной вены в печень, где осуществляется их клиренс Купферовскими и ретикулоэндотелиальными клетками. Условнопатогенные и патогенные ГР- выделяют токсины, + медиаторы= увеличение проницаемости = перемещению эндотоксинов и бактерий в мезентериальные лимфатические узлы, а затем в кровеносные сосуды. Высокое содержание бактерий в просвете кишечника, предрасположенность слизистой к ишемии, гипоксии и атрофии - все это служит основой гипотезы о бактериальной транслокации при критических состояниях. Транслокация эндотоксина может грубо повреждать физиологические процессы, что проявляется развитием септического состояния. В наиболее тяжелой форме это проявляется в виде синдрома ПОН. Желудочно-кишечный тракт имеет значительную протяжённость микроциркуляторного русла, нарушение перфузии кишечника становится причиной активации эндотелия, адгезии к эндотелию нейтрофнлов, их миграции в ткани, секреции цитокинов и запуску ССВО. Повышенная проницаемость кишечника при СНОП способствует транслокации бактерий и токсинов через кишечную стенку и сохранению и поддержанию ССВО. Бактерии из желудочно-кишечного тракта даже без системного распространения, оставаясь в мезентсриальных лимфоузлах, способны запускать ССВО и способствовать поражению отдалённых органов. В дополнение к бактериям и эндотоксинам, повреждение кишечника может привести к активации нейтрофилов и выбросу мощных медиаторов системного воспаления - цитокинов, эйкосаноидов и др. Это обстоятельство усугубляет расстройства органной перфузии и дисфункцию. 12.Механизмы нарушений микроциркуляции при полиорганной недостаточности. Микроциркуляторный механизм развития ПОН обусловлен, в первую очередь, снижением капиллярного кровотока, имеющим место при всех видах шока. Нарушение деформабильности эритроцитов - важный фактор, способствующий нарушению микроциркуляции. Разрушенные эритроциты являются источником свободного гемоглобина и гема, который является мощным окислителем и инициирует образование активных форм кислорода, интенсифицируя оксидативный стресс и, таким образом, повреждение тканей. (При геморрагическом шоке это происходит за счет снижения ОЦК и централизации кровообращения. При септическом шоке под влиянием эндотоксинов открываются артерио-венозные шунты и кровь, минуя капиллярную сеть, попадает из артериального в венозное русло. При анафилактическом шоке гистамин вызывает резкое снижение сосудистого тонуса и депо- нирование крови в капиллярах и венах. При кардиогенном шоке централизация кровообращения обусловлена падением сократительной способности миокарда.) В результате снижения кровотока в микроциркуляторном русле происходит локальное нарушение обмена веществ, приводящее к развитию метаболического ацидоза. Под влиянием ацидоза нарушается регуляция сосудистого тонуса артериол и вен и повышается свертываемость крови. Из-за накопления кислых продуктов прекапиллярные сфинктеры открываются, а посткапиллярные остаются суженными. В результате кровь поступает в капилляры и депонируется, из-за повышения гидростатического давления в капиллярах плазма переходит через эндотелий в интерстиций. Происходит сгущение крови, агрегация тромбоцитов, эритроцитов, в легких формируются агрегаты нейтрофилов. Кровоток в капиллярах может замедлиться вплоть до полной остановки. 13.Респираторный дистресс-синдром в патогенезе полиорганной недостаточности. Респираторный дистресс: Отек, приводит к гипоксии. Гиперметаболизм тоже приводит. Острое состояние, характеризующееся двусторонней инфильтрацией лёгких. форма лёгочного отёка, вызванная повышенной капиллярной проницаемостью. В основе ОРДС лежит диффузное воспаление лёгких. Этиологические (причинные) факторы приводят к тому, что в интерстициальной ткани легких и в капиллярах органа собираются активированные лейкоциты и тромбоциты в большом количестве. Они повреждают альвеолярный эпителий и эндотелий сосудов, меняют реактивность сосудов, тонус бронхиальной мускулатуры, способствуют развитию фиброза. Выше перечисленные биологические вещества оказывают влияние на повреждение альвеолярного эпителия и эндотелия капилляров легких. За короткий промежуток времени увеличивается проницаемость сосудов, происходит спазм легочных капилляров, повышается давление внутри них. Исследователи выдвигают предположение, что происходит выделением ими множества биологически активных веществ Цитокины=увеличение проницаемости=отек. Это приводит к повреждению эндотелия капилляров и эпителия альвеол, нарушая альвеолярно-капиллярный барьер. В результате экссудат проникает в лёгочную паренхиму и альвеолярное воздушное пространство. В начальной фазе ОПЛ на фоне замедления кровотока в микроциркуляторном русле легких и образования тромбоцитарных микроагрегатов происходит адгезия и активация нейтрофилов. Последние через поврежденный эндотелий легочных капилляров проникают в просвет альвеол. Нейтрофилы, эндотелиоциты и альвеолярные макрофаги продуцируют цитокины, протеазы (эластаза, коллагеназа) и другие вещества, которые повреждают альвеолокапиллярную мембрану. Эйкосаноиды увеличивают проницаемость мембраны, вызывают бронхиоло- и вазоспазм, усиливают тромбообразование. Активация свободнорадикальных реакций дополняет повреждающее действие цитокинов и эйкосаноидов на клеточные мембраны. В конечном счете вследствие нарушения целостности альвеолокапиллярной мембраны развивается некардиогенный отек легких. В острой фазе синдрома легочная паренхима представляет мозаику воздушных, коллабированных и отечных участков. Перфузия невентилируемых областей является причиной легочного шунта, который может составлять более 60 % (норма 3–7 %) сердечного выброса и являться главной причиной артериальной гипоксемии. В результате вышеописанных патологических изменений возникает несоответствие между вентиляцией и перфузией, которое приводит к возникновению легочного шунта и тяжелой артериальной гипоксемии. Нарушение продукции сурфактанта на фоне альвеолярного отека, воспаления и фиброза приводит к снижению комплайенса легких и повышению «энергетической цены» дыхания. 14.Принципы профилактики и лечения полиорганной недостаточности. Наиболее эффективной и предпочтительной лечебной тактикой при ПОН является ее профилактика, что диктует необходимость и важность энергичного проведения всего комплекса мер интенсивной терапии у больных с тяжелыми стадиями шока, сепсисом и другими критическими состояниями.систему функциональной оценки и мониторинга, адекватное обезболивание, восстановление перфузии, нарушений гемокоагуляционной системы. лечение1. Первое по значимости и времени направление - устранение действия пускового фактора или заболевания, запустившего и поддерживающего агрессивное воздействие на организм больного (гнойная деструкция, тяжелая гиповолемия, легочная гипоксия, высокоинвазивная инфекция и т. д.). При неустранённом этиологическом факторе любое, самое интенсивное лечение ПОН, безрезультатно. 2. Второе направление - коррекция нарушений кислородного потока, включающая восстановление кислородтранспортной функции крови, терапию гиповолемии и гемоконцентрации, купирование расстройств гемореологии. 3. Третье направление - замещение, хотя бы временное, функции повреждённого органа или системы с помощью медикаментозных и экстракоропоральных методов. диализ, плазмаферез, гемосорбцию, гемофильтрацию и т.д. 15.Коллапс: виды, причины, механизмы развития. Коллапс - острое общее патологическое состояние, возникающее в результате значительного несоответствия ОЦК повышенной ёмкости сосудистого русла. Характеризуется недостаточностью кровообращения, низким АД, первично циркуляторной гипоксией, расстройством функций тканей, органов и их систем. Виды: Гиповолемический; Постгеморрагический, дегидратационный, токсико-инфекционный, ортостатический. Кардиогенный;Постинфарктный, аритмический, кардиомиопатический. Вазодилятационный. Гипертермический, ортостатический, токсикационный. инфекционно – токсический, вызванный наличием бактерий при инфекционных заболеваниях, что приводит к нарушению работы сердца и сосудов; токсический – результат общей интоксикации организма; гипоксемический, возникающий при нехватке кислорода или в условиях высокого атмосферного давления; панкреатический, вызванный травмой поджелудочной железы; ожоговый, возникающий после глубоких ожогов кожного покрова; гипертермический, наступающий после сильного перегрева, солнечного удара; дегидратационный, обусловленный потерей жидкости в больших объемах; геморрагический, вызванный массовым кровотечением, в последнее время рассматривают как глубокий шок; кардиогенный, связанный с патологией сердечной мышцы; плазморрагический, возникающий вследствие потери плазмы при тяжелых формах диареи, множественных ожогах; ортостатический, наступающий при приведении тела в вертикальное положение; Причины коллапса. Типичны следующие циркуляторные расстройства: - сниженные ударный и сердечный выбросы крови; - острая артериальная гипотензия; - венозная гиперемия; - перераспределение кровотока (депонирование крови в ёмкостных сосудах брюшной полости, лёгких, селезёнки и гипоперфузия мозга, сердца, других органов); - нарушения микроциркуляции крови и лимфы; - развитие капиллярно-трофической недостаточности. Непосредственная причина коллапса - быстро развивающееся значительное превышение ёмкости сосудистого русла по сравнению с ОЦК. В зависимости от причин, нарушающих это соответствие, выделяют несколько: • При снижении величины сердечного выброса развивается кардиогенный коллапс. Это наблюдается при острой сердечной недостаточности; состояниях, затрудняющих приток крови к сердцу (при стенозах клапанных отверстий, эмболии или стенозе сосудов системы лёгочной артерии). • При уменьшении ОЦК развивается гиповолемический коллапс. К этому приводят острое массивное кровотечение, быстрое и значительное обезвоживание организма, потеря большого объёма плазмы крови (например, при обширных ожогах). • При снижении ОПСС развивается вазодилатационный коллапс. Это может произойти при тяжёлых инфекциях, интоксикациях, гипертермии, эндокринопатиях (при гипотиреоидных состояниях, надпочечниковой недостаточности), передозировке сосудорасширяющих ЛС, гипокапнии, глубокой гипоксии и ряде других состояний. ПАТОГЕНЕЗ. Отмечаемое при коллапсе перераспределение крови в сосудистом русле обычно характеризуется увеличением кровенаполнения органов брюшной полости и уменьшением кровенаполнения других органов (кожи, мышц, головного мозга). Коллапс возникает в результате несоответствия между возросшими метаболическими потребностями мозга и сниженным поступлением в его структуры (особенно кору больших полушарий) крови. Последнее, главным образом, определяется снижением системного АД, обусловленного уменьшением либо общего периферического сопротивления сосудов, либо объема ОЦК, либо сердечного выброса, либо их сочетания. 1) Резкое уменьшение объема циркулирующей крови: абсолютное(при острой массивной кровопотере,значительном обезвоживании организма при профузных поносах,неукротимой рвоте,массивной полиурии) или относительное(всл избыточного депонирования крови при выраженном снижении тонуса мелких сосудов,сердечной нед-ти правожелудочкового типа сопровождающейся застоем крови в венах большого круга кровообращения). В результате развивается гипоперфузия органов и тканей. Это приводит к нарастающей вначале циркуляторной, а затем (с присоединением гемической и тканевой) - смешанной гипоксии. 2) Первичное значительное уменьшение сердечного выброса, обусловленное ослаблением сократительной ф-и сердца или нарушением венозного возврата к нему(при инф миокарда, тампонаде сердца, некоторых видах аритмии, тяжелых токсических поражениях миокарда). 3)Первичное падение общего периферического сопротивления в рез воздействий снижающих нейрогенный и миогенный компоненты тонуса резистивных и емкостных сосудов. Важный фактор риска - снижение реактивных свойств стенок резистивных сосудов к вазопрессорным веществам: катехоламинам, ангиотензину и другим. Важную роль в механизмах развития этого несоответствия играют: - возбуждение ПСНС, в том числе М-холинорецепторов органов (сердца, сосудов и др.), ганлиев ПСНС, вазодилататорного отдела сердечно-сосудистого центра (ССЦ); - избыточное образование и действие вазодилататорных ФАВ (ацетилхолина, гистамина, кининов, простагландинов E, I, A; оксида азота, аденозина, молочной, пировинаградной и кетоновых кислот и др.); - угнетение СНС, в том числе a-адренорецепторов, ганглиев СНС, вазоконстрикторного отдела ССЦ; - недостаточное образование и действие вазоконстрикторных ФАВ ( HA, A, PgF2, AT-2 и AT-3, вазопрессина и др.); -неадекватная компенсаторная реакция симпатоадреналовой гипофиз-кортикоадреналовой, ренин-ангиотензин-альдостероновой системы (РААС) и гипоталамо-нейрогипофизарной вазопрессиновой системы; - резкое уменьшение содержание в организме ионов натрия и кальция и увеличение ионов калия; - повышение проницаемости кровеносных сосудов; -развитие расстройств микроциркуляции и капиллярно-трофической недостаточности; - расстройство систем крови и гемостаза; - развитие печеночной недостаточности; - парез гладких мышц сосудов и др. 16. Проявления колллапса, последствия. Принципы терапии коллапса. Нарушения газообменной функции лёгких при коллапсе. Об этом свидетельствуют: - частое и поверхностное дыхание; - гипоксемия; - гиперкапнии в оттекающей от лёгких крови. Расстройство экскреторной функции почек при коллапсе. Учитывая, что коллапс характеризуется острой системной артериальной гипотензиеи и в связи с этим — гипоперфузией почек, у пациентов часто выявляется: - олигурия; - гиперстенурия; - гиперазотемия. Расстройства систем крови и гемостаза при коллапсе: - гиповолемия; - повышение вязкости крови (в связи с выходом её жидкой части через стенки сосудов, проницаемость которых в условиях гипоксии увеличена); - гиперагрегация тромбоцитов и эритроцитов; - образование тромбов; - развитие феномена сладжа. Нарушение функции ССС является инициальным и главным патогенетическим звеном коллапса и характеризуется неадекватностью кровоснабжения органов и тканей. Большей частью внезапно развиваются ощущения общей слабости, головокружение, больной жалуется на зябкость, озноб, жажду; температура тела снижена. Черты лица заострены, конечности холодные, кожные покровы и слизистые оболочки бледны с цианотичным оттенком, лоб, виски, иногда все тело покрыто холодным потом, малый и слабый пульс, обычно учащенный, вены спавшиеся, АД понижено. Сердце не расширено, тоны его глухие, иногда аритмичные, дыхание поверхностное, учащенное, но, несмотря на одышку, больной не испытывает удушья, лежит с низко расположенной головой. Диурез снижен. Сознание сохранено или затемнено, к окружающему больной безучастен, реакция зрачков на свет вялая, наблюдаются тремор пальцев рук, иногда судороги. Объем циркулирующей крови всегда снижен, часто определяются декомпенсированный метаболический ацидоз, гематокрит повышен. Дифференциальный диагноз проводится с обмороком, при котором функциональные нарушения выражены значительно слабее, АД нормальное, а также с сердечной недостаточностью, отличающейся от коллапса ортопноэ, увеличением объема циркулирующей крови, нормальным АД. МЕТОДЫ ЛЕЧЕНИЯ КОЛЛАПСа Этиотропное лечение направлено на прекращение действия экстремального фактора или снижение степени его повреждающего влияния: останавливают кровотечение, вводят антитоксины, антидоты, антимикробные ЛС. Патогенетический принцип реализуется путём устранения или снижения степени последствий несоответствия ёмкости сосудистого русла и ОЦК. С этой целью пациентам вливают препараты крови, крове или плазмозаменители, буферные растворы; вводят ЛС, повышающие тонус стенок резистивных и ёмкостных сосудов, активирующие функцию сердца и дыхательного центра; проводят оксигенотерапию; при наличии признаков надпочечниковой недостаточности используют кортикостероиды. Саногенетическая терапия подразумевает стимуляцию механизмов адаптации: активацию гемопоэза, системы ИБН, детоксицирующей и других функций печени, экскреторной способности почек. Симптоматическое лечение включает мероприятия по устранению тягостных, неприятных и усугубляющих состояние пациента проявлений коллапса: болевого синдрома, чувства страха смерти, подавленности, тревоги и др. В зависимости от конкретной ситуации применяют антидепрессанты, нейролептики, седативные и болеутоляющие средства, психостимуляторы, транквилизаторы. 17.Шок: характеристика понятия, виды. Общий патогенез шоковых состояний; сходство и различия отдельных видов шока. Шок - общее, крайне тяжёлое экстремальное состояние. Возникает под действием сверхсильных, разрушительных факторов и характеризуется стадийным прогрессирующим расстройством жизнедеятельности организма вследствие нарушения функций жизненно важных систем. Виды шока: Единой классификации шока нет. В качестве критерия для дифференцировки шоковых состояний служат, главным образом, их причина и тяжесть течения. • В зависимости от причины различают шок травматический (раневой), геморрагический, ожоговый, посттрансфузионный, аллергический (анафилактический), электрический, кардиогенный, токсический, психогенный (психический) и др. • В зависимости от тяжести течения выделяют: шок I степени (лёгкий), шок II степени (средней тяжести), шок III степени (тяжёлый). Общий патогенез и проявления шока Независимо от причины и тяжести клинических проявлений, различают две последовательных стадии шока. В основе шока лежат генерализованные нарушения перфузии, приводящие к гипоксии органов и тканей и расстройствам клеточного метаболизма. Системные нарушения кровообращения являются следствием снижения сердечного выброса (СВ) и изменения сосудистого сопротивления. • Сначала возникает активация специфических и неспецифических адаптивных реакций. Эту стадию ранее называли стадией генерализованного возбуждения, или эректильной. В последние годы её называют стадией адаптации, или компенсации. Характеризуется мобилизацией и максимальным напряжением адаптивных механизмов организма, перераспределением пластических и энергетических ресурсов в пользу жизненно важных органов, что сопровождается значительными изменениями их функций. На стадии компенсации основное значение имеют нейроэндокринное, гемодинамическое, гипоксическое, токсемическое и метаболическое звенья патогенеза. • Если процессы адаптации недостаточны, развивается вторая стадия шока. Ранее её называли стадией общего торможения или торпидной. В настоящее время её называют стадией дезадаптации, или декомпенсации. Нейроэндокринное звено. Вследствие гиперафферентации значительно усиливается выброс в кровь гормонов симпатикоадреналовой и гипоталамо-гипофизарно-надпочечниковой систем, а также щитовидной, поджелудочной и других эндокринных желёз. Эффекты: • Гиперфункция ССС и дыхательной системы, почек, печени, других органов и тканей. Это проявляется гипертензивными реакциями, тахикардией, учащением и углублением дыхания, перераспределением кровотока в разных регионах сосудистого русла, выбросом крови из депо.• По мере нарастания степени повреждения эти реакции принимают избыточный, неадекватный и некоординированный характер, что в значительной мере снижает их эффективность. Это и определяет в значительной мере тяжёлое или даже необратимое само усугубляющееся течение шоковых состояний. • Сознание при шоке не утрачивается. В эту стадию обычно возникает нервное, психическое и двигательное возбуждение, проявляющееся излишней суетливостью, ажитированной речью, гиперрефлексией. Гемодинамическое звено. Нарушение гемодинамики при шоке является результатом расстройств деятельности сердца, изменения тонуса резистивных и ёмкостных сосудов, уменьшения ОЦК, изменения вязкости крови, а также активности факторов системы гемостаза. ♦ Причины: прямое действие на сердце экстремального фактора; кардиотоксический эффект высокого уровня в крови катехоламинов, гормонов коры надпочечников и щитовидной железы. ♦ Проявления: значительная тахикардия, различные нарушения ритма сердца, снижение ударного и сердечного выбросов, нарушения центральной, органно-тканевой и микрогемоциркуляции, системный застой венозной крови, замедление тока крови в сосудах микроциркуляторного русла. • Изменение тонуса резистивных и ёмкостных сосудов. ♦ Вначале тонус сосудов, как правило, возрастает вследствие гиперкатехоламинемии. В течение какого-то времени повышенный тонус стенок резистивных сосудов (артериол) способствует поддержанию системного АД, а ёмкостных сосудов (венул) - адекватного притока крови к сердцу. ♦ Позднее накапливается избыточное количество БАВ, снижающих тонус стенок сосудов (таких как аденозин, биогенные амины, гистамин, NO, ПгЕ, I2). Пониженное АД. • Перераспределение кровотока. Происходит увеличение кровотока в артериях сердца и мозга при одновременном его уменьшении в сосудах кожи, мышц, органов брюшной полости, почек. Этот феномен получил название централизации кровотока. ♦ Причины феномена: неравномерное содержание адренорецепторов и рецепторов к другим биологически активным веществам в разных сосудистых регионах (наибольшее их число выявлено в стенках сосудов мышц, кожи, органов брюшной полости, почек и значительно меньшее - в сосудах сердца и головного мозга), образование в ткани миокарда и мозга большого количества сосудорасширяющих БАВ. ♦ Значение феномена: адаптивное (кровоснабжение сердца и мозга в таких условиях способствует поддержанию жизнедеятельности организма в целом); патогенное (нарушение функций гипоперфузируемых органов, изменение реологических свойств крови в сосудах вследствие стаза и выхода жидкой части крови в ткани). • Уменьшение ОЦК, изменение вязкости крови и активности факторов системы гемостаза выявляются уже на раннем этапе шоковых состояний. Гипоксическое звено. • Причины. Первоначально гипоксия обычно является следствием расстройств гемодинамики и носит циркуляторный характер. По мере усугубления состояния гипоксия становится смешанной. Это является результатом прогрессирующих расстройств дыхания, изменений в системе крови и тканевого метаболизма.• Последствия. Снижение эффективности биологического окисления потенцирует нарушение функций тканей и органов, а также - обмена веществ в них. Накопление избытка активных форм кислорода является одной из причин недостаточности системы антиоксидантной защиты тканей и активации перекисных реакций. Токсемическое звено. Причины: ♦ Сам экстремальный фактор может являться токсином (например, при токсическом, токсико-инфекционном шоке). ♦ Повреждение экстремальным фактором клеток и высвобождение из них избытка БАВ, продуктов нормального и нарушенного метаболизма, ионов, денатурированных соединений. ♦ Нарушение инактивации или экскреции токсичных соединений печенью, почками, другими органами и тканями. • Последствия: нарастание интоксикации потенцирует гипоксию, нарушения гемодинамики и полиорганную недостаточность. Метаболическое звено.• Причины: чрезмерное усиление нервных и гуморальных влияний на ткани и органы, расстройство гемодинамики в тканях и органах, гипоксия, токсемия. • Последствия. В целом изменения метаболизма характеризуются преобладанием процессов катаболизма: протеолиза, липолиза и СПОЛ, гликогенолиза и других. Содержание макроэргических соединений уменьшается, а уровень ионов и жидкости в тканях возрастает. При неэффективности адаптивных механизмов и усугублении описанного выше комплекса расстройств развивается стадия декомпенсации шока. ДЕКОМПЕНСАЦИЯ. Нейроэндокринное звено. Сознание на стадии декомпенсации также не утрачивается, но отмечаются признаки заторможенности и спутанности сознания, развивается гипорефлексия. Эффекты нервных и гормональных влияний прогрессирующе уменьшаются вплоть до отсутствия. Гемодинамическое звено. Причины: ♦ Прогрессирующее нарушение функции сердца и развитие сердечной недостаточности. ♦ Тотальное снижение тонуса резистивных и ёмкостных сосудов. Это устраняет адаптивный феномен централизации кровообращения. Снижение систолического АД до 60-40 мм рт.ст. чревато прекращением процесса фильтрации в клубочках почек и развитием острой почечной недостаточности. ♦ Дальнейшее снижение ОЦК и повышение её вязкости в связи с выходом жидкой части крови в межклеточное пространство.• Проявления: тотальная гипоперфузия органов и тканей, существенное расстройство микроциркуляции, капилляро-трофическая недостаточность. Система гемостаза. Изменения в системе гемостаза заключаются в развитии дисбаланса концентрации или активности факторов свёртывающей, противосвёртывающей и фибринолитической систем. Последствия: развитие ДВС-синдрома, ишемии и некроза тканей, геморрагий в них. Гипоксическое звено. Развивается выраженная гипоксия смешанного типа и некомпенсированный ацидоз вследствие системных расстройств гемодинамики, гиповентиляции лёгких, уменьшения ОЦК, почечной недостаточности, расстройства обмена веществ. Токсемическое звено характеризуется увеличением содержания в крови и других биологических жидкостях продуктов нормального и нарушенного метаболизма; накоплением в крови соединений, высвобождающихся из повреждённых и разрушенных клеток (ферментов, денатурированных белков, ионов, различных включений); БАВ и других. Указанные вещества значительно усугубляют повреждение органов. Метаболическое звено шока на стадии декомпенсации проявляется доминированием процессов катаболизма белков, липидов, углеводов, минимизацией пластических процессов в клетках, гипергидратацией клеток, накоплением в биологических жидкостях недоокисленных веществ, увеличением в тканях уровня продуктов липопероксидации. Клеточное звено патогенеза шока на стадии декомпенсации характеризуется нарастающим подавлением активности ферментов и жизнедеятельности клеток, повреждением и разрушением клеточных мембран, нарушениями межклеточных взаимодействий. 18.Стадии шока, основные функциональные и структурные нарушения на разных его стадиях. Первая стадия — непрогрессирующая (компенсированная). Перфузия жизненно важных органов сохраняется за счет компенсаторных механизмов; как правило, не наблюдается выраженной гипотензии вследствие повышение общего периферического сосудистого сопротивления. На этой стадии отсутствуют порочные круги. Вторая стадия — прогрессирующая. Компенсаторные механизмы не в состоянии обеспечить достаточную перфузию, запускаются и прогрессируют все патогенетические механизмы развития шока. Третья стадия — стадия необратимых изменений. На этой стадии никакие современные противошоковые средства не позволяют вывести больного из этого состояния. На этой стадии врачебное вмешательство может вернуть на короткий период времени артериальное давление и минутный объём сердца к норме, но это не останавливает разрушительные процессы в организме. Среди причин необратимости шока на этой стадии отмечают нарушение гомеостаза, которое сопровождается тяжёлыми повреждениями всех органов, особенное значения имеет повреждение сердца. 19. Патофизиологические основы профилактики и терапии шока. Методы лечения шока. Чем раньше после воздействия экстремального фактора начато лечение шоковых состояний, тем выше его эффективность и благоприятнее прогноз. Этиотропное лечение проводят путём устранения или ослабления действия шокогенного фактора, предотвращения или снижения выраженности избыточной патогенной афферентации от болевых и других экстеро-, интеро- и проприорецепторов. Патогенетическое лечение направлено на разрыв ключевых звеньев механизма развития шока, а также на стимуляцию адаптивных реакций и процессов. • Устранение расстройств центральной, органно-тканевой и микрогемоциркуляции. ♦ Пациентам вливают кровь, плазму или плазмозаменители (последние включают высокомолекулярные коллоиды, препятствующие выходу жидкости во внесосудистое русло). ♦ Применяют вазоактивные и кардиотропные препараты, позволяющие нормализовать сократительную функцию миокарда, тонус сосудов и устранить сердечную недостаточность. ♦ Используют средства, уменьшающие проницаемость стенки сосудов: препараты кальция и кортикостероиды. • Ликвидация или уменьшение степени расстройств кровоснабжения органов и тканей. • Устранение (или уменьшение степени) недостаточности внешнего дыхания. Реализуется с помощью ИВЛ, использованием газовых смесей с повышенным содержанием кислорода и гипербарической оксигенации, применением дыхательных аналептиков. • Улучшение кровоснабжения почек, а в тяжёлых случаях - использование аппарата «искусственная почка» (при наличии признаков почечной недостаточности). • Коррекция отклонений КЩР и ионного баланса. Достигается, как правило, в результате нормализации кровообращения, дыхания, функций почек и других органов. Также используют растворы гидрокарбоната натрия и хлорида калия для нормализации КЩР, а также жидкости, содержащие различные ионы, для устранения их дисбаланса. • Уменьшение степени токсемии. С этой целью проводят гемосорбцию и плазмафарез, введение антидотов и антитоксинов, инъекции коллоидных растворов (адсорбирующих токсичные вещества), плазмы и плазмозаменителей, мочегонных препаратов. Симптоматическая терапия направлена на уменьшение тягостных и неприятных ощущений, чувства страха, тревоги и беспокойства, обычно сопровождающие шоковые состояния. Для этого используют, например, различные психотропные средства. 20.Понятие о синдроме длительного раздавливания, его причины и основные звенья патогенеза. Синдром длительного сдавления - тяжелое состояние, обусловленное патологическими расстройствами органов и систем вследствие токсемии после длительного массивного раздавливания мягких тканей или сдавления магистральных сосудов конечностей. Основой патогенеза вышеперечисленных сходных патологических состояний является эндогенная интоксикация продуктами ишемии и реперфузии тканей. В сдавленных тканях вместе с участками прямого травматического некроза образуются зоны ишемии, где накапливаются кислые продукты анаэробного обмена. После освобождения раненых от сдавления происходит возобновление крово- и лимфообращения в ишемизированных тканях, характеризующихся повышенной проницаемостью капилляров. Это называется реперфузией тканей. При этом токсические вещества (миоглобин, продукты нарушенного перекисного окисления липидов, калий, фосфор, полипептиды, тканевые ферменты - гистамин, брадикинин и др.) выходят в общий кровоток. Происходит токсическое поражение внутренних органов, в первую очередь легких, с формированием ОДН. Гиперкалиемия может приводить к острому нарушению деятельности сердца. Из ишемизированных тканей вымываются также недоокисленные продукты анаэробного обмена (молочная кислота и др.), которые вызывают выраженный метаболический ацидоз. Наиболее опасно высвобождение в кровь из ишемизированных поперечно-полосатых мышц больших количеств белка миоглобина. Миоглобин свободно фильтруется в почечных клубочках, но закупоривает почечные канальцы, образуя в условиях метаболического ацидоза нерастворимый солянокислый гематин (если рН мочи больше 6, вероятность развития почечной недостаточности при СДС снижается). Кроме этого миоглобин оказывает прямое токсическое действие на эпителий канальцев почек, что в совокупности приводит к миоглобинурийному нефрозу и острой почечной недостаточности (ОП Н ). Быстро развивающийся постишемический отек поврежденных и длительно сдавленных тканей вызывает острую гиповолемию с гемо-концентрацией (ОЦК уменьшается на 20-40% и более). Это сопровождается клиникой шока и, в конечном итоге, также способствует ухудшению функции почек. 21.Сепсис, особенности патогенеза. Септический шок, условия развития, патогенез. Сепсис — патологический процесс, в основе которого лежит реакция организма в виде генерализованного (системного) воспаления на инфекцию различной природы (бактериальную, вирусную, грибковую). Ключевые этапы современного патогенеза сепсиса: 1-ый этап – локальная продукция ряда цитокинов клетками-эффекторами воспаления (Т-лимфоциты, макрофаги, эндотелиоциты, тромбоциты) в ответ на воздействие микроорганизма; на этом этапе цитокины выполняют защитные функции на местном уровне (участвуют в процессах репарации, активируют другие клетки-эффекторы воспаления и т. д.). 2-й этап – выброс малого количества цитокинов в системный кровоток; на данном этапе цитокины также выполняют защитные функции, но уже на системном уровне, при этом существует равновесие между провоспалительными (ИЛ-1,6,8, TNF) и противовоспалительными (ИЛ-4,10,14, растворимые рецепторы к TNF) медиаторами. 3-й этап – генерализация воспалительной реакции — при выраженном воспалении и измененной реактивности макроорганизма цитокины накапливаются в системном кровотоке в сверхвысоких количествах, при этом начинают доминировать их деструктивные эффекты (повреждение эндотелия, запуск ДВС-синдрома, моно — и полиорганная дисфункция); в результате полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин, продукты ПОЛ, нейромедиаторы, альдегиды и т. д.), потенцирующие деструктивные процессы. Тяжелый сепсис – это сепсис с нарушением функций органов. Сердечно-сосудистая недостаточность, как правило, проявляется гипотонией, нарушением дыхания – гипоксемией, почечной недостаточностью – олигурией и/или азотемией и гематологическими нарушениями – коагулопатией. Септический шок представляет собой сепсис, который характеризуется артериальной гипотонией ниже 90 мм.рт. ст., а также симптомами гипоперфузии.,невзирая на адекватную инфузионную терапию. Запускают септический шок в основном грамотрицательные микроорганизмы из мочеполовой системы или из желудочно-кишечного тракта. Патогенез септического шока (СШ): Микробный агент вызывает эндотоксикоз. Токсико-биологические активные вещества, проникая в клетку, поражают ее элементы (митахондрии, лизосомальный аппарат и др.). Нарушается выработка энергии. Воздействие токсинов микроорганизмов, выделение большого количества продуктов метаболизма (кининов, простагландинов, лейкотриенов, свободных радикалов О2, миоперекисей и др.) сопровождается парезом периферических сосудов, компенсаторным ростом ЧСС, сердечного выброса, что обеспечивает поддержание АД. Возрастает протеолитическая активность, нарушаются ферментативные реакции, нейрогуморальная регуляция. Вазодилятация связана с повышенным уровнем ФНО, IL-1. NO. Нарушается потребление кислорода и выработка энергии. Формируется недостаточность дыхания, кровообращения, обмена веществ, свертываемости крови - развивается полиорганная недостаточность. По характеру напоминает анафилактический шок. Различают септический шок, вызванный граммотрицательной (около 2/3 всех случаев) и граммположительный (1/3). Граммотрицательные микробы (кишечная палочка, протей, сальмонеллы, синегнойная палочка и др.) не выделяют экзотоксины, легко разрушаются и действуют на организм эндотонсином, являющимся липополисахаридным или полисахаридным комплексом, а шок называют эндотоксическим. Другие элементы септического шока: острый респираторный дистресс-синдром (ОРДС), острая почечная недостаточность, нарушения сознания вызванные ишемией ЦНС и воздействием медиаторов воспаления, расстройства пищеварительного тракта — паралитическая непроходимость кишечника вследствие его ишемии и повреждения слизистой оболочки, что приводит к перемещению бактерий с просвета желудочно-кишечного тракта в кровь (бактериальная транслокация) и кровотечения геморрагическая гастропатия. 22.Токсический шок, условия развития, патогенез, лечение. Причины токсического шока. Причины токсического шока в большинстве случаев связаны с инфицированием бактериями. Они вырабатывают токсины, которые и приводят к развитию токсического шока. Патогенез инфекционно токсического шока - на уровне мелких сосудов характеризуется тем, что в кровеносную систему поступает большое количество токсинов. Выделяются они бактериями-сапрофитами. Данное явление приводит к резкому выбросу адреналины и прочих биологически активных веществ. Они способны вызвать спазм посткапилярных венул и артериол. Кровь, которая циркулирует по открывшимся артериовенозным шунтам, не может выполнять свою прямую функцию. На фоне этого возникает ишемия тканей и метаболический ацидоз. Ухудшение циркуляции приводит к появлению гипоксии тканей, из-за дефицита кислорода происходит анаэробный метаболизм. На уровне систем органов патогенез инфекционно токсичного шока проявляет себя в виде депонирования крови в капиллярах и выходом ее жидкой части в межклеточное пространство. Сначала происходит относительная, а затем уже и абсолютная гиповолемия. Не исключено уменьшение перфузии почек. Это приводит к чрезмерному падению клубочковой фильтрации. Развивающийся на этом фоне отек вызывает острую почечную недостаточность. Схожие процессы происходят и в легких. Паралитическая дилятация венозных сосудов под влиянием бактериальных токсинов, выключение вследствие этого из кровотока большого количества крови и падение ОЦК. Развитие ДВС. Гипоксия органов и тканей, метаболический ацидоз. Лечение. · Устранение источника инфекции, для чего производится хирургическая обработка раны, · Интенсивную жидкостную терапию для восполнения внутрисосудистого объема, · Борьбу с симптомами шока и осложнениями в работе жизненно важных систем организма, · Проведение тщательного контроля диуреза и почечной функции, · Антибиотикотерапию, оказывающую специфическое воздействие на микроорганизмы. Реополиглюкин, преднизолон, гепарин (двс), кислород. 23.Диабетическая кома, ее разновидности, патогенез проявлений, лечение. Диабети́ческая ко́ма — состояние, развивающееся в результате недостатка инсулина в организме у больных сахарным диабетом. Диабетический кетоацидоз. Диабетический кетоацидоз развивается при дефиците инсулина. Выраженный кетоацидоз приводит к развитию кетоацидотической комы. • Причины: недостаточное содержание в крови инсулина и повышение концентрации контринсулярных гормонов. • Факторы риска: невозможность введения достаточной дозы инсулина, стресс, хирургические вмешательства, травмы, злоупотребление алкоголем, беременность, острые или обострение хронических заболеваний. • Механизм развития: дефицит энергии в клетках вызывает активацию глюконеогенеза и гликогенолиза, протеолиза и липолиза. В условиях дефицита инсулина нарушается транспорт глюкозы в клетки и нарастает гипергликемия, а катаболизм ВЖК протекает с образованием КТ и развитием ацидоза. Развивающаяся диабетическая полиурия (увеличение суточного количества мочи) приводит к сильному обезвоживанию организма, несмотря на то что, количество потребляемой жидкости больным возрастает. Объем крови, циркулирующей в сосудах, за счет этого снижается, и давление резко падает, приводя к нарушению трофики всех органов и тканей, в том числе и головного мозга. Вместе с водой из организма, как правило, удаляются и электролиты. В первую очередь, это такие макроэлементы, как калий и магний, что приводит к серьезным нарушениям работы всех органов и систем. Чтобы скомпенсировать избыток глюкозы в тканях, организм начинает активно расщеплять запасы жира и гликогена. В связи с этим значительно увеличивается количество кетоновых тел и молочной кислоты в крови, развивается гиперацидоз. Лечение: введением инсулина. Обычно больные сахарным диабетом информированы о возможности развития осложнения и о необходимом лечении. Рекомендуется ограничить потребление углеводов, начать приём препаратов калия и магния, пить щелочные минеральные воды – все это поможет устранить гиперацидоз. Гиперосмолярная кома. Гиперосмолярная (гипергликемическая некетоацидотическая) кома наиболее характерна для пожилых пациентов с СД 2-го типа. Она развивается существенно медленнее, чем кетоацидотическая, однако летальность при ней выше. Состояние, при котором отмечается повышенное содержание высокоосмотических соединений в крови, таких как натрий и глюкоза, называется гиперосмолярностью. В результате слабой диффузии этих веществ внутрь клеток появляется достаточно выраженная разница онкотического давления между вне– и внутриклеточной жидкостью. В результате сначала развивается внутриклеточная дегидратация, что в дальнейшем ведет к общему обезвоживанию организма. Внутриклеточной дегидратации подвергаются прежде всего клетки головного мозга. Гиперосмолярная кома сопровождается высоким уровнем гликемии, который может составлять 50 ммоль/л и более. При гиперосмолярной коме явление кетоацидоза отсутствует. Гиперосмолярная кома является более тяжелым осложнением сахарного диабета, нежели кетоацидотическая кома. Лечение: В данном случае терапия направлена на устранение дегидратации в организме, борьбу с гиповолемическим шоком, а также на нормализацию показателей кислотно-щелочного состояния. На догоспитальном этапе лечения проводят промывание желудка, введение мочевого катетера. Необходимым мероприятием является налаживание оксигенотерапии. Гипогликемическая кома. Причины:♦ Передозировка инсулина.♦ Задержка очередного приёма пищи или голодание.♦ Длительная интенсивная физическая нагрузка.♦ Дефицит контринсулярных гормонов. Это одна из частых причин гипогликемической комы, поскольку синтез глюкагона и катехоламинов у этих пациентов обычно снижен.Гипогликемия обусловливает нарушение ресинтеза АТФ в нейронах ЦНС и активацию симпатикоадреналовой системы. Катехоламины тормозят развитие тяжёлой гипогликемии, стимулируя гликогенолиз. Также они вызывают тахикардию, аритмии, дрожь, мышечную слабость, неприятные ощущения в области сердца, потливость, заставляющие пациента немедленно принять глюкозу.При недостаточности компенсаторных возможностей организма развивается гипогликемическая кома с утратой сознания, судорогами, остановкой дыхания, отсутствием сокращений сердца и нарушением гемодинамики. Кетоацидотическая кома. Абсолютная инсулиновая недостаточность, приводящая к снижению утилизации глюкозы инсулинзависимыми тканями и, соответственно гипергликемии, и тяжелому энергетическому голоду в них. Последнее обстоятельство является причиной резкого повышения в крови уровня всех контринсулиновых гормонов (глюкагона, кортизола, катехоламинов, АКТГ, СТГ), стимуляции процессов гликогенолиза, протеолиза и липолиза, поставляющих субстраты для глюконеогенеза в печени и в меньшей степени в почках. Глюконеогенез в сочетании с прямым нарушением утилизации глюкозы тканями в связи с абсолютным дефицитом инсулина является важнейшей причиной быстро нарастающей гипергликемии, повышения осмолярности плазмы, внутриклеточной дегидратации и осмотического диуреза. Дегидратация и гиповолемия являются причиной снижения мозгового, почечного и периферического кровотока, что, в свою очередь, усиливает имеющуюся гипоксию ЦНС и периферических тканей и приводит к развитию олигурии и анурии. Гипоксия периферических тканей способствует активизации в них процессов анаэробного гликолиза и постепенному нарастанию уровня лактата. Относительный дефицит лактатдегидрогеназы при дефиците инсулина и невозможность полной утилизации лактата в цикле Кори являются причиной возникновения лактацидоза при декомпенсации ИЗСД. Дефицит инсулина и резкое повышение концентрации всех контринсулиновых гормонов являются причиной активизации липолиза и мобилизации свободных жирных кислот (СЖК), что способствует активной продукции кетоновых тел. Усиленное образование ацетил-КоА, предшественника ацетоацетата (и ацетона при его декарбоксилировании), и В-гидроксибутирата обеспечивается в данных условиях активным поступлением СЖК в печень вследствие их мобилизации из периферических тканей и преобладанием процессов липолиза над липогенезом в самой клетке печени. Лечение: Основными целями терапии кетоацидоза являются борьба с дегидратацией и гиповолемическим шоком, восстановление физиологического КОС, нормализация электролитного баланса, ликвидация интоксикации и лечение сопутствующих заболеваний. Лактатацидемическая (молочнокислая); 24.Причины и механизмы развития артериальных гипотензий, проявления, принципы лечения. ГИПОтензии. Артериальная гипотония – стойкое или регулярное понижение артериального давления ниже 100/60 мм. рт. ст. Причины: Вариант нормы спортсмена. Адаптивная для высокогорья. Коллапс. Механизмы. Нейрогенные артериальные гипотензии Среди нейрогенных артериальных гипотензий выделяют гипотензии центрогенные и рефлекторные. Центрогенные артериальные гипотензии: • Артериальные гипотензии вследствие нарушений ВНД. ♦ Причина: длительный и повторный стресс, что ведёт к развитию невротического состояния. ♦ Механизм развития. Активация парасимпатических влияний (встречается реже, чем симпатических) на ССС обусловливает снижение сократительной функции миокарда, сердечного выброса крови и тонуса резистивных сосудов. • Артериальные гипотензии вследствие органических изменений в структурах мозга. ♦ Наиболее частые причины: травмы головного мозга, нарушения мозгового кровообращения, дегенеративные изменения в веществе головного мозга, синдром Шая-Дрейджера. ♦ Патогенез: снижение активности симпатикоадреналовой системы и выраженности её эффектов на ССС ведёт к снижению тонуса стенок артериол, ОПСС, сердечного выброса. Рефлекторные артериальные гипотензии • Причина: нарушение проведения эфферентных гипертензивных импульсов от сосудодвигательного центра продолговатого мозга к стенкам сосудов и сердцу. Наиболее часто это развивается при нейросифилисе, боковом амиотрофическом склерозе, сирингомиелии, периферических невропатиях различного генеза. • Механизм развития заключается в значительном уменьшении или прекращении тонических влияний симпатической нервной системы на стенки сосудов и сердца. Эндокринные артериальные гипотензии: Различают артериальные гипотензии надпочечникового, гипофизарного и гипотиреоидного генеза. • Причины: ♦ Надпочечниковая недостаточность развивается при гипотрофии коры надпочечников, опухоли коры надпочечников с разрушением их паренхимы, кровоизлиянии в надпочечник (один или оба), травмах, инфекционных или аутоиммунном поражениях надпочечников. Эти процессы приводят к дефициту катехоламинов, минерало- и глюкокортикоидов. ♦ Питуитарная недостаточность обусловливает развитие артериальной гипотензии вследствие недостаточного эффекта вазопрессина, АКТГ, ТТГ, СТГ.♦ Гипотиреоз приводит к развитию артериальной гипотензии вследствие дефицита T3 и T4 или их эффектов. • Патогенез. Указанные выше причины прямо или опосредованно (через уменьшение тонуса симпатической нервной системы) вызывают снижение ОЦК, сердечного выброса и тонуса артериол. Метаболические артериальные гипотензии встречаются редко. Они развиваются при дистрофических изменениях в органах и тканях, участвующих в синтезе метаболитов с гипертензивным действием. Гипогидратация организма. Вызвана уменьшением объема жидкости в организме в связи со снижением интенсивности метаболизма. Последний, как известно, сопровождается образованием воды. Патогенез.Основными звеньями патогенеза являются снижение тонуса гладкомышечных клеток стенок сосудов и вследствие этого – ОПСС, падение сократительной функции сердца, ведущее к уменьшению сердечного выброса крови, уменьшение содержания воды в организме, в т.ч. объема циркулирующей жидкости. В совокупности указанные факторы обусловливают стойкое снижение АД ниже нормы – артериальную гипотензию. Лечение артериальной гипотензии.В первую очередь быть направлено на лечение той формы патологии, которая вызвала развитие артериальной гипотензии. Нефармакологическое лечение включает в себя методы, направленные на компрессию нижних конечностей для повышения венозного возврата; прием жидкости до 480 мл. за один прием; физические нагрузки; приемNaCl(1-2 г. три раза в сутки). Фармакологическое лечение включает в себя прием синтетических минералокортикоидов, агонистов альфа-1-адренорецепторов, а также ингибиторов холинэстеразы. 25.Причины и механизмы развития артериальных гипертензий, проявления, принципы лечения. Артериальная гипертензия - это повышение артериального давления. 1) первичные (эссенциальные) - до 85%. Это собственно гипертоническая болезнь, связана с нарушением нейрогуморальной регуляции сосудистого тонуса. 2) вторичные (симптоматические) - связаны с патологией эндокринных желез (гипофиза, надпочечников) и почек - встречаются в 15% случаев. Факторы риска артериальных гипертензий: отягощённый семейный анамнез, ожирение, СД, заболевания почек, злоупотребление алкоголем, избыточное употребление поваренной соли, стресс, гиподинамия, курение, тип личности пациента. Механизм. Нейрогенные артериальные гипертензии. Эти гипертензии характеризуются либо повышением гипертензивных нейрогенных влияний, либо ослаблением гипотензивных нейрогенных эффектов, либо сочетанием того и другого. Нейрогенные гипертензии составляют примерно половину всех артериальных гипертензий. Их подразделяют на рефлекторные (рефлексогенные) и центрогенные. Центрогенные артериальные гипертензии могут возникать либо при нарушениях ВНД, либо при органических поражениях структур мозга, регулирующих системную гемодинамику. Психоэмоциональный стресс нарушает корково-подкорковые отношения, наблюдается расстройство нейродинамики, Повышается возбудимость гипоталамуса. Повышается активность гипоталамических структур, симпатической нервной системы, что вызывает избыточную выработку катехоламинов - адреналина и норадреналина. Адреналин вызывает возбуждение 1-адренорецепторов миокарда, что приводит к его гиперфункции, увеличению сердечного выброса и повышению систолического АД. Это - гипердинамическая форма артериальной гипертензии. При повышенной секреции норадреналина реагируют альфа-адренорецепторы сосудов, возрастает диастолическое АД. Стресс ------- Гипоталамус -----СНС ------ Катехоламины --------Адреналин.♦ Одновременно активируется система «гипоталамус-гипофиз-надпочечники». Это сопровождается увеличением продукции и концентрации в крови гормонов с гипертензивным действием (АДГ, АКТГ и кортикостероидов, катехоламинов, тиреоидных гормонов).♦ Указанные вещества потенцируют степень и длительность сужения артериол и венул, повышения ОЦК и сердечного выброса. Это ведёт к стойкому повышению АД - развивается артериальная гипертензия. Рефлекторные артериальные гипертензии могут развиваться на основе условных и безусловных рефлексов.• Условнорефлекторные артериальные гипертензии. ♦ Причина: повторное сочетание индифферентных (условных) сигналов (например, информации о предстоящем публичном выступлении, важном соревновании или событии) с действием агентов, вызывающих повышение АД (например, кофеина, алкоголя или наркотиков). После определённого числа сочетаний увеличение АД регистрируется уже только на индифферентный сигнал и может развиться стойкое повышение АД. • Безусловнорефлекторные артериальные гипертензии. ♦ Причина: хроническое раздражение экстра- и интрарецепторов, нервных стволов и нервных центров (например, при длительно протекающих каузалгических синдромах, энцефалитах, опухолях мозга). Эти состояния способствуют прекращению «депрессорной» афферентной импульсации к кардиовазомоторному (прессорному) центру. Повышение тонуса последнего обусловливает стойкое увеличение АД. Эндокринные (эндокриногенные) артериальные гипертензии. В этих механизмах принимают участие гипоталамус, гипофиз, надпочечники, половые железы. • Артериальная гипертензия при эндокринопатиях надпочечников. ♦ Минералокортикоидные артериальные гипертензии обусловлены избыточным синтезом альдостерона (гиперальдостеронизмом). Альдостерон задерживает натрий в организме и способствует его поступлению в сосудистую стенку. Она набухает за счет накопления воды. Внутренний диаметр сосуда уменьшается, что ведет к повышению АД. ♦ Глюкокортикоидные артериальные гипертензии являются результатом гиперпродукции глюкокортикоидов, в основном кортизола (реже кортизона и кортикостерона). ЮГА -------Ренин ----------- АТ-1 -----АТ-2 ------ Миогенный тонус--------Альдостерон ------ Na+----------- Практически все артериальные гипертензии глюкокортикоидного генеза развиваются при болезни и синдроме Иценко-Кушинга.♦ Катехоламиновые артериальные гипертензии развиваются в связи со значительным увеличением в крови адреналина и норадреналина, вырабатываемых хромафинными клетками. В большинстве случаев такой гипертензии обнаруживают феохромоцитому. • Артериальная гипертензия при эндокринопатиях щитовидной железы (чаще при гипертиреозе). ♦ Гипертиреоз. Для гипертиреоза характерно - увеличение ЧСС, ударного и сердечного выбросов, преимущественно изолированная систолическая артериальная гипертензия с низким (или нормальным) диастолическим АД. В основе развития артериальной гипертензии при гипертиреозе лежит кардиотонический эффект T3 и T4. ♦ Гипотиреоз. Характеризуется увеличением диастолического АД, снижением ЧСС и сердечного выброса. • Артериальная гипертензия при расстройствах эндокринной функции гипоталамо-гипофизарной системы. ♦ Гиперпродукция АДГ. Патогенез: активация реабсорбции жидкости из первичной мочи приводит к гиперволемии; повышение тонуса ГМК артериол вызывает сужение их просвета и повышение ОПСС. В совокупности эти механизмы обеспечивают стойкое повышение АД. ♦ Гиперпродукция АКТГ. При этом развивается болезнь Иценко Кушинга. Артериальные гипертензии, вызванные гипоксией. Артериальные гипертензии, развивающиеся в результате гипоксии органов (особенно мозга и почек), нередко встречаются в клинической практике. К ним относят артериальные гипертензии, в основе патогенеза которых лежат нарушения метаболизма веществ с гипо- и гипертензивным действием. Возникают эти гипертензии в результате расстройств кровообращения и последующей гипоксии различных внутренних органов. Общий патогенез гипоксических артериальных гипертензий.♦ Гиперпродукция или активация метаболитов с гипертензивным действием.♦ Гипопродукция или инактивация метаболитов с гипотензивным действием.♦ Изменение чувствительности рецепторов сердца и сосудов к этим метаболитам. Алкогольная:Стимуляция СНС, захват кальция и повышение ОПСС. Лечение: Этиотропное: устранение причины. диуретики;бета-блокаторы;блокаторы кальциевых каналов (БКК);ингибиторы АПФ (ИАПФ);блокаторы рецепторов ангиотензина II (БРА);альфа-блокаторы. 26. Гипертонические кризы, виды, патогенез, патогенетические принципы лечения. Гипертонический криз — резкое, внезапное и длительное повышение артериального давления в связи со спазмом артериол, морфологически характеризующийся спазмом артериол, плазморрагиями и фибриноидным некрозом стенок, периваскулярными диапедезными кровоизлияниями. Осложнённый гипертонический криз — экстренное состояние, сопровождающееся поражением органов-мишеней; может привести к летальному исходу, требуется немедленная медицинская помощь и срочная госпитализация в стационар. Неосложненный гипертонический криз — состояние, при котором происходит значительное повышение артериального давления при относительно сохранных органах-мишенях. Требует медицинской помощи в течение 24 часов после начала; госпитализация, как правило, не требуется. Выделяют три клинических варианта гипертензивных кризов с: 1) преобладанием нервно-вегетативного синдрома (нейровегетативная форма); 2) проявлением водно-солевого синдрома (водно-солевая форма); 3) гипертензивной энцефалопатией ("судорожная форма"). Патогенез: Важное значение имеют нейрогуморальные механизмы развития гипертонического криза. Гиперстимуляция РААС запускает порочную цепную реакцию, которая включает повреждение сосудов, ишемию тканей и дальнейшее перепроизводство ренина. В организме образуется излишнее количество ангиотензина II, катехоламинов, вазопрессина, альдостерона, эндотелина-1, тромбоксана. А эндогенных вазодилататоров не хватает. Потому местная регуляция периферического сопротивления. Если артериальное давление постепенно повышается и достигает индивидуального предела, срывается эндотелиальная регуляция сосудистого тонуса. В результате гиперперфузии вслед за повреждением эндотелия развивается фибриноидный некроз артериол, повышается проницаемость сосудов, что приводит к периваскулярному отеку. Немаловажным аспектом клинических проявлений и прогноза считают сопутствующую активацию тромбоцитов и системы коагуляции, что в комплексе с потерей эндотелием фибринолитической активности способствует диссеминированному внутрисосудистому свертыванию. Лечение: Тактика врача должна быть строго индивидуальна. При выборе препарата для купирования гипертонического криза необходимо определить его тип, оценить тяжесть клинической картины (наличие или отсутствие осложнений), выяснить причины острого повышения АД, длительность и кратность предшествующей базовой терапии, наметить уровень и скорость ожидаемого снижения АД. В целом, скорость уменьшения давления не должна быть больше, чем на 25% в первые 2 часа. Профилактика. Предупреждение гипертензивного кардиального и церебрального ишемического кризов эффективно только при использовании адекватной антигипертензивной терапии, проводимой во II и III стадии гипертонической болезни. При склонности к частому развитию церебрального ангиогипотонического криза на фоне даже умеренно выраженных подъемов АД больному необходимо исключить работу с наклонами туловища и подъемом тяжестей, а также длительное пребывание в фиксированной позе за письменным столом. При частом возникновении типичной утренней головной боли больному следует спать в положении с приподнятой верхней половиной туловища, избегать охлаждения головы, предупреждать запоры. 27. Фибрилляция сердца. Причины и механизмы развития. Дефибрилляция. Понятие об искусственных водителях ритма. Фибрилля́ция предсе́рдий — разновидность наджелудочковой тахиаритмии с хаотической электрической активностью предсердий с частотой импульсов 350—700 в минуту, что исключает возможность их координированного сокращения. Причины: врожденные пороки развития сердечной мышцы, инфаркт миокарда, перикардиты разной этиологии, инфекционные поражения вирусной природы, артериальная гипертензия, стабильная стенокардия напряжения, расширение полостей сердца, митральная недостаточность, заболевания щитовидной железы. Патогенез: Органические заболевания сердца могут вызывать структурное ремоделирование предсердий и желудочков. В предсердиях этот процесс обусловлен пролиферацией и дифференцировкой фибробластов в миофибробласты, повышенным отложением соединительной ткани и фиброзом. Всё это приводит к электрической диссоциации мышечных пучков и неоднородности проведения, тем самым способствуя развитию и сохранению ФП. ФП возникает в результате поступления множества импульсов из автономных очагов, которые чаще всего расположены в устьях лёгочных вен или по задней стенке левого предсердия около соединения с лёгочной веной. Снижается сократительная функция предсердий вследствие замедления поступления ионов кальция в клетки, нарушения выделения ионов кальция из внутриклеточных депо и нарушения обмена энергии в миофибриллах. Замедляется кровоток в предсердиях из-за нарушения их сокращения, что приводит к образованию тромбов преимущественно в ушке левого предсердия. Фибрилляция желудочков — форма сердечной аритмии, характеризющаяся полной асинхронностью сокращения отдельных волокон миокарда желудочков, обусловливающей утрату эффективной систолы и сердечного выброса. ФЖ означает остановку кровообращения и равносильна смерти, если не проводить кардиореанимационные мероприятия. Во время фибрилляции желудочков их полноценные сокращения прекращаются, что клинически проявляется остановкой кровообращения, сопровождающейся потерей сознания, отсутствием пульсации и АД на крупных артериях, отсутствием сердечных тонов и дыхания. Причины: Аритмии, инфаркт миокарда, ОКН, Пороки, Миокардиты, Кардиосклероз,Травмы. Дефибрилляция — устранение фибрилляции желудочков сердца или предсердий. ее цель — устранить разрозненные, хаотичные сокращения отдельных мышечных пучков (фибрилл), восстановить эффективную сократительную деятельность желудочков сердца и вывести больного из состояния клинической смерти. При фибрилляции предсердий дефибрилляция является терапевтическим мероприятием, направленным на восстановление синусового ритма сокращений сердца. При неоказании своевременной помощи, фибрилляция переходит в асистолию. Связано это с тем, что клетки сердца тоже страдают от кислородного голодания и токсических отходов и гибнут. Это приводит к подавлению всех электрических импульсов, направление которых не совпадает с направлением тока дефибриллятора. Все патологические очаги возбуждения угнетаются, остаются только те, которые дают суммарный вектор нормального сердечного сокращения. Эффективная работа сердца восстанавливается. Искусственный водитель ритма (электростимулятор) — это устройство, генерирующее электрические импульсы с заданной частотой и предназначенное для увеличения ЧСС у больных с брадиаритмиями. Электростимулятор может быть установлен временно или постоянно. Временные электростимуляторы используют для лечения преходящей брадиаритмии, а также для стабилизации состояния больных, нуждающихся в постоянном искусственном водителе ритма. Например, при брадиаритмиях, возникающих в результате токсического эффекта лекарственных средств, электростимулятор устанавливают на время, достаточное для полного исчезновения побочных эффектов препаратов. Существуют временные электростимуляторы двух типов. Первый используют для трансторакальной электрокардиостимуляции: непрямую стимуляцию сердца проводят с помощью внешних электродов, установленных на поверхности грудной клетки больного. Очевидно, что эта процедура сопряжена с большим дискомфортом, поскольку в этом случае стимулируется сокращение всех грудных мышц. С другой стороны, такой электростимулятор можно быстро установить (например, при необходимости экстренного вмешательства). Временные электростимуляторы другого типа предназначены для трансвенозной электрокардиостимуляции: снабженный электродом катетер вводят через одну из периферических вен в полость сердца и подключают к внешнему источнику тока. Такой электростимулятор можно использовать в течение нескольких дней, однако уже через 48—72 ч значительно возрастает риск катетерной инфекции и тромбоза вен. В отличие от временных электростимуляторов, постоянные водители ритма представляют собой гораздо более сложные электронные устройства, способные регистрировать электрическую активность предсердий и/или желудочков. Обычно электроды проводят (трансвенозно) в правые отделы сердца, а источник тока, размером не превышающий монету, имплантируют подкожно. Срок службы такого источника составляет 5—15 лет. Современные постоянные водители ритма являются программируемыми устройствами, работой которых можно управлять с помощью внешних радиосигналов, воспринимаемых имплантированным генератором. 28.Нарушения функции сердца при патологии перикарда. Острая тампонада сердца, патогенез, симптомы, лечение. Патология перикарда. Перикард выполняет разные функции, удерживает сердце и его сосуды в средостении, предохраняет их от механических повреждений и инфекций, участвует в регуляции диастолы, является рефлексогенной зоной, регулирует частоту и силу сердечных сокращений. Патологии: Перикардит – воспаление перикарда. Чаще встречается у КРС – травматический перикардит, при инфекциях. При этом в полости перикарда скапливается экссудат, который сдавливает сердце, затрудняет его работу. Экссудат всасывается в кровь, развивается интоксикация. Возникает застой крови в большом круге, особенно в портальной системе. Появляется компенсаторная тахикардия. Гидроперикард – водянка перикарда. Возникает при нарушении водно-солевого обмена и снижении онкотического давления крови. В полости скапливается транссудат. Транссудат скапливается медленно, он не токсичен. Тампонада сердца – скопление в околосердечной сумке жидкости ( выпота при перикардите , крови при ранении или разрыве сердца), препятствующей достаточному наполнению камер сердца во время диастолы с развитием острой сердечной недостаточности. Острая тампонада сердца- состояние, развивающееся при нарастающем накоплении в полости сердечной сорочки большого объема жидкости (экссудат, транссудат, кровь). Накапливающаяся жидкость сдавливает камеры сердца, в результате чего страдает диастолическое расслабление миокарда. Это приводит, с одной стороны, к уменьшению сердечного выброса, а с другой, - к нарастанию давления в предсердиях и значительному повышению венозного давления как в малом, так и в большом круге кровообращения. Одновременно вследствие растяжения устья полых вен начинает урежаться сердечный ритм (рефлекс Бейнбриджа). Наступающая брадикардия усугубляется за счет включения и другого рефлекса - с растянутого жидкостью перикарда. Все вкупе приводит в конечном итоге к остановке сердца и смерти. Причины: Наиболее частой причиной тампонады сердца является кровотечение в перикард (гемоперикард) после хирургических операций, травм, включая ятрогенные (перфорация сердца катетером, сердечно-легочная реанимация), при наружном разрыве сердца вследствие инфаркта миокарда, расслоении аневризмы аорты, гемофилии, а также при лечении антикоагулянтами больного с острым перикардитом любого генеза. Реже тампонада осложняет инфекционный перикардит, особенно гнойный или туберкулезный, и выпот неопластического или уремического генеза. Клиническая картина – “классическая” триада Бека: • гипотония и тахикардия с парадоксальным пульсом (ослабление пульса на вдохе), • цианоз и набухание шейных вен (в случаях, когда нет гиповолемического синдрома), • большое сердце (перкуторно), ослабление сердечных тонов (аускультативно). Типичным является и Куссмауля, который проявляется как увеличение набухания шейных вен на вдохе. При острой тамнонаде сердца жалоб также может не быть, или они не типичны для данного диагноза: нарастающая одышка, тяжесть в грудной клетке, периодический страх, дисфагия. Позже может проявиться спутанность сознания, возбужденное состояние. При обследовании находят набухшие шейные вены, одышку, тахикардию, глухость сердечных тонов. С помощью перкуссии фиксируют расширение границ сердца. Без неотложного перикардоцентеза больной теряет сознание и умирает. Лечение: Экссудативный перикардит с тампонадой сердца лечат в стационаре. Желательно учесть природу заболевания. Эффективным средством лечения являются нестероидные противовоспалительные препараты, назначаемые в средних дозировках. Такое лечение проводится и при сухом перикардите. Также иногда применяют глюкокортикостероиды. Благодаря этому препарату быстро рассасывается выпот. Если на протяжении 2-недельного лечения глюкокортикостероидами (ГК) нет ожидаемого эффекта, выпот в большом количестве присутствует, то делают пункцию перикарда с введением ГК в полость сердечной сумки. Тактика ведения больного зависит также от объема жидкости в полости перикарда. При небольшом количестве жидкости терапия не требуется. Для улучшения гемодинамики при гипотонии вводят жидкость — плазму, коллоидные или солевые растворы в количестве 400-500 мл внутривенно. Эффективность этих мероприятий контролируют по повышению систолического давления и систолического выброса. Какой бы вид тампонады сердца не был зафиксирован, нужно вовремя сделать пункцию перикарда. Часто именно это помогает улучшить в значительной мере состояние пациента. 28.Расстройства физиологических функций при кровопотере и в постгеморрагических состояниях. Принципы терапии кровопотерь: переливание крови и кровезаменителей, механизмы действия гемотрансфузии. Постгемотрансфузионные осложнения, механизмы и профилактика. Кровопотеря — выхождение значительного количества крови из сосудистого русла. Кровопотеря характеризуется патологическими нарушениями органов и тканей и комплексом компенсаторных реакций организма, направленных на борьбу с нарушениями микроциркуляции, гипоксией тканей и метаболическим ацидозом. Смерть наступает от паралича дыхательного центра и остановки сердца в случае, если человек теряет более половины объема крови. Донорскую кровь в организм больного вводят внутривенно, виутриартериалыю, внутрикостно, внутрисердечно, подкожно, наиболее часто - внутривенно. Готовясь к переливанию крови, врач должен использовать следующий алгоритм переливания крови: обосновать и записать в истории болезни необходимость гемотрансфузии, отсутствие противопоказаний к ней, проверить группу крови донора и реципиента, их резуспринадлежность, провести реакцию на индивидуальную совместимость и биологическую пробу. Это касается каждого флакона крови, используемого для переливания. В каждом флаконе по окончании переливания следует оставить 5 - 8 мл крови и хранить их в течение суток в холодильнике для проведения исследования в том случае, если возникает пострансфузионное осложнение. Механизм действия перелитой крови: Биологические эффекты гемотрансфузии обусловлены сложнейшими регуляторными механизмами. Перелитая кровь действует на элементы нервной рецепции, а также ферментные и гормональные системы обмена, изменяя его на всех уровнях: от молекулярного до органно-тканевого. Эффекты: Заместительное действие заключается в возмещении утраченной организмом части крови. Введённые в организм эритроциты восстанавливают объём крови и её газотранспортную функцию. Лейкоциты повышают иммунные способности организма. Тромбоциты корригируют систему свёртывания крови. Плазма и альбумин обладают гемодинамическим действием. Иммуноглобулины плазмы создают пассивный иммунитет. Факторы свёртывания крови и фибринолиза регулируют агрегатное состояние крови. Вводимые вместе с кровью питательные вещества (жиры, белки и углеводы) включаются в цепь биохимических реакций. Эритроциты перелитой крови функционируют в сосудистом русле реципиента до 30 сут и более. Клетки белой крови покидают сосудистое русло вскоре после переливания, белки плазмы донорской крови циркулируют в сосудистом русле реципиента 18-36 дней. Гемодинамический эффект Переливание крови оказывает всестороннее воздействие на сердечно-сосудистую систему. У больных с острой кровопотерей и травматическим шоком оно приводит к стойкому увеличению ОЦК, увеличению венозного притока к правым отделам сердца, усилению работы сердца и повышению минутного объёма крови. Улучшается микроциркуляция: расширяются артериолы и венулы, раскрывается сеть капилляров, в них ускоряется движение крови, сокращаются артериовенозные шунты, в результате чего редуцируется утечка крови из артериальной системы в венозную. Через 24- 48 ч после переливания крови у реципиента начинается усиленный приток тканевой лимфы в кровеносное русло, что также увеличивает ОЦК. Поэтому иногда после трансфузии прирост ОЦК превосходит объём перелитой крови. Гемотрансфузия усиливает иммунологические свойства организма реципиента. За счёт введения гранулоцитов, макрофагов, лимфоцитов, компонентов комплемента, иммуноглобулинов, цитокинов, различные антибактериальных и антитоксических антител возрастает фагоцитарная активность лейкоцитов, активируется образование антител. Переливание крови оказывает стимулирующее действие на систему гемостаза реципиента, вызывая умеренную гиперкоагуляцию, обусловленную увеличением тромбопластической и снижением антикоагулянтной активности крови. Кровезаменители. Переливание цельной крови, её компонентов и препаратов, несмотря на множество положительных моментов, несёт опасность переноса инфекционных заболеваний, а также развития реакций несовместимости, поэтому по возможности функции крови стараются заместить специальными препаратами, получившими название «кровезамещающие растворы» (или «кровезаменители»). К кровезаменителям относятся кровезамещающие жидкости: кровезамещающие растворы, плазмозамещающие растворы, кровезаменители, плазмозаменители, гемокорректоры. Эти средства применяются с лечебной целью в качестве заменителей или корректоров крови. Вводятся они внутривенно, внутриартериально, внутрикостно, подкожно, через зонд в желудочно-кишечный тракт. К кровезаменителям относятся: Препараты гемодинамического действия (противошоковые кровезаменители) предназначены для нормализации показателей центральной и периферической гемодинамики. Растворы этой группы обладают высокой молекулярной массой и выраженными коллоидно-осмотическими свойствами, за счёт чего длительно циркулируют в сосудистом русле и привлекают в него межклеточную жидкость, значительно увеличивая ОЦК (волемический эффект). Помимо основного действия, гемодинамические кровезаменители обладают и дезинтоксикационным действием, улучшают микроциркуляцию и реологические свойства крови. (Декстрин, желатин). Кровезаменители для парентерального питания: наряду с белками, углеводами и жирами в парентеральном питании важную роль играют электролиты: калий, натрий, кальций, фосфор, железо, магний, хлор, а также микроэлементы марганец, кобальт, цинк, молибден, фтор, йод, никель и др. Первые принимают участие в важнейших метаболических и физиологических процессах, входят в структуру клеток, в том числе и форменных элементов крови, необходимы для регуляции осмотических процессов и т.д. Вторые регулируют функциональную активность ферментов, гормонов и т.д. Для усиления эффекта парентерального питания дополнительно назначают витамины и анаболические гормоны. Регуляторы водно-солевого обмена и кислотно-щелочного состояния. Кристаллоидные растворы имеют низкую молекулярную массу и быстро проникают через стенку капилляров в межклеточное пространство, восстанавливая дефицит жидкости в интерстиции. Они довольно быстро покидают сосудистое русло. В связи с этим целесообразно сочетанное применение кристаллоидных и коллоидных растворов. При этом не только восполняется дефицит внеклеточной жидкости, происходят компенсация метаболического ацидоза и детоксикация, но и возникает некоторый гемодинамический эффект, заключающийся в частичной коррекции гиповолемии и стабилизации АД. Переносчики кислорода: Создание кровезаменителей (так называемой «искусственной крови»), выполняющих перенос кислорода к тканям организма (основную функцию крови), - важная, но очень трудная задача. Инфузионные антигипоксанты - самая молодая группа кровезаменителей. Они предназначены для повышения энергетического потенциала клетки. Основные препараты - мафусол, полиоксифумарин. препараты этой группы восстанавливают клеточный метаболизм, адаптируя клетки к недостатку кислорода; Осложнения механического характера: • острое расширение сердца- Причина этого осложнения перегрузка сердца большим количеством быстро введённой в венозное русло крови. В системе полых вен и правого предсердия возникает застой крови, нарушается общий и коронарный кровоток; Лечение: состоит в немедленном прекращении гемотрансфузии, небольшом кровопускании для разгрузки правых отделов сердца, внутривенном введении кардиотонических средств. • воздушная эмболия; • тромбозы и эмболии; • нарушение кровообращения в конечности после внутриартериальных трансфузий. Осложнения реактивного характера - наиболее серьёзные, опасные и часто встречающиеся осложнения гемотрансфузии. Их разви- тие обусловлено несовместимостью переливаемой донорской крови или реакцией организма на трансфузионную среду. Пирогенные реакции: Причины развития пирогенных реакций не связаны с иммунобиологической несовместимостью и бывают следствием образования в трансфузионной среде пирогенных веществ - продуктов распада белков донорской крови или жизнедеятельности микроорганизмов, проникающих в кровь при её заготовке, хранении или нарушении правил асептики в момент переливания. Лечение. При реакции лёгкой степени особых мероприятий не тре- буется. При развитии тяжёлой реакции или реакции средней тяжести необходимо прекратить гемотрансфузию, ввести жаропонижающие средства (метамизол натрий), наркотические анальгетики (тримеперидин), антигистаминные препараты (дифенгидрамин, клемастин). Профилактика заключается в соблюдении правил заготовки, хранения и переливания крови. С применением одноразовых пластиковых контейнеров для заготовки крови и её компонентов и одноразовых систем для трансфузий частота таких реакций значительно снижается. Антигенные (негемолитические) реакции: Причины возникновения этих реакций не связаны с бактериальными пирогенами, а обусловлены сенсибилизацией антигенами лейкоцитов, тромбоцитов и белков плазмы в результате ранее проведённых гемотрансфузий и беременностей. В 50% случаев развитие реакций связано с антилейкоцитарными антителами. Лечение. Возникновение посттрансфузионных реакций негемолитического типа требует энергичной терапии с применением антигистаминных средств, сердечно-сосудистых препаратов, наркотических анальгетиков, детоксикационных и противошоковых растворов. Профилактика несовместимых гемотрансфузий основана на соблюдении правил определения групп крови, проведении пробы на групповую совместимость, техники переливания крови. Такие осложнения, как почечная недостаточность или болевой синдром, подвергаются обычной терапии. При большом числе антиген-позитивных эритроцитов должен быть рассмотрен вариант обменного переливания. Предотвращение заражения пациента при переливании крови или ее компонентов, как говорилось выше, перечисленными инфекциями осуществляется на основе строго регламентированного клинического и лабораторного обследования донора и его крови до и после забора крови. Профилактика острого расширения сердца состоит в уменьшении скорости и объёма инфузионной терапии, контроле ЦВД и диуреза. 30.Печеночная кома; виды, причины возникновения, патогенез. Патогенез и дифференциальная диагностика желтух. Печеночная кома - это терминальная стадия печеночной энцефалопатии, характеризующаяся утратой сознания, отсутствием рефлексов и нарушением основных функций органов. этап развития прогрессирующей печеночной недостаточности, когда на фоне интоксикации организма выявляются признаки выраженного повреждения прежде всего центральной нервной системы. Причиной печеночной комы является интоксикация продуктами обмена, трансформация, обезвреживание и выделение которых при повреждении печени грубо нарушаются. Выделяют 4 вида комы: 1) Эндогенная (истинная) кома развивается при массивном некрозе гепатоцитов в случаях острой печеночной недостаточности, при этом характерно нарушение многих функций печени, у пациентов отмечаются выраженная кровоточивость, повышение уровня свободного билирубина в крови, гиперазотемия печеночного типа, печеночный запах изо рта. Лечению поддается с трудом. 2) Экзогенная (шунтовая, обходная) кома чаще возникает при циррозах в случае развития мощных коллатералей между системами воротной и нижней полой вен. Также может возникать при искусственном наложении портокавальных анастомозов, по которым кровь из кишечника, богатая биологически активными веществами (БАВ - аммиак, кадаверин, путресцин и др.), минуя печень, вливается в общий кровоток и оказывает токсический эффект на мозг. Эта форма легче поддается терапии (диализ крови, очищение кишечника, антибиотики широкого спектра действия), имеет более благоприятный прогноз. экзогенная; 3) Чаще наблюдается смешанная кома, которая развивается при далеко зашедшем циррозе печени с гибелью большого числа гепатоцитов и наличием портокавальных анастомозов. 4) Электролитная кома связана с развитием гипокалиемии. В патогенезе играют роль вторичный альдостеронизм, применение мочегонных препаратов, не сберегающих калий, частые рвоты, поносы, что приводит к нарушению электролитного баланса (гипокалиемия, алкалоз). Проявляется резкой слабостью, снижением тонуса мышц, адинамией, судорожными подергиваниями икроножных мышц, нарушением сердечной деятельности (тахикардия, ритм «дятла»), нарушением дыхания. Лечение электролитной комы - применение препаратов калия. Причины: Чаще всего причиной печеночной комы является декомпенсация уже имеющегося у пациента хронического заболевания печени (цирроза, гепатита, злокачественной опухоли и др.). К срыву компенсации могут привести желудочно-кишечное кровотечение, длительное злоупотребление алкоголем, разлитой перитонит, сепсис, анестезия с использованием фторотана, прием некоторых лекарственных препаратов (седативных, противотуберкулезных средств, анальгетиков, диуретиков), хроническая толстокишечная непроходимость, а также длительное хирургическое вмешательство. Наиболее частыми причинами являются острый и хронический гепатит различной этиологии, а также цирроз печени. Различают три основных вида печеночной комы: 1) печеночно-клеточная (эндогенная); 2) порто-кавальная (шунтовая или экзогенная); 3) смешанная. Главную роль в патогенезе печеночной комы играет накопление в крови церебротоксических веществ (аммиак, фенол, некоторые жирные кислоты). Их токсический эффект усиливается нарушениями кислотно-щелочного равновесия, гипокалиемией. Шунтовая печеночная кома чаще всего возникаег вследствие цирроза печени, при котором закономерно повышается давление в воротной вене. Стойкая и длительная портальная гипертензия ведет к развитию порто-кавальных анастомозов (по типу обратной фистулы Экка-Павлова) через геморроидальные, пищеводные, пупочную вены. По этим венам значительная часть крови, оттекающая от желудочно-кишечного тракта, минуя печень, проходит прямо в общий кровоток. Поскольку такая кровь содержит много не обезвреженных печенью токсических продуктов обмена (прежде всего продуктов белкового распада - аммиака, карбаминовокислого аммония, путресцина, кадаверина, метионина и др.), развивается интоксикация организма этими метаболитами, в норме подвергающихся инактивации в печени. Печеночно-клеточная кома возникает при массивном некрозе паренхимы печени, когда происходит существенное расстройство всех ее функций. В основе развития комы лежат несколько патогенетических механизмов. Во-первых, это повышение в крови содержания веществ, оказывающих общетоксическое и, в особенности, церебротоксическое действие. Среда подобных веществ важнейшую роль играет свободный аммиак. Известно, что только гепатоциты имеют такой метаболический механизм как орнитиновый цикл, в ходе которого происходит трансформация постоянно образующегося в процессе белкового обмена NH3 в мочевину. Синтез мочевины в печени нарушается в случае повреждения не менее 80% всех печеночных клеток. Дополнительным источником накопления NH3 в организме является часть мочевины, экскретируемая слизистой оболочкой кишечника и расщепляющаяся в нем уреазами бактерий с образованием аммиака, который всасывается в кровь. Избыток аммиака оказывает прямое повреждающее действие на органы и ткани, ингибируя активность многих важнейших ферментов и, в частности, ферментов цикла Кребса. При этом часть аммиака связывается с α-кетоглютаровой кислотой с образованием глютаминовой кислоты. Возникающий в связи с этим дефицит α-кетоглютаровой кислоты значительно снижает интенсивность окислительных процессов, оказывает разобщающий эффект (уменьшает степень сопряженности окисления и фосфорилирования), что в итоге приводит к дефициту АТФ. к этим нарушениям присоединяются расстройства свертывающей системы крови (дефицит коагулянтов) и ухудшение ее реологических свойств, создающих в совокупности благоприятные условия для развития кровотечений и сладжирования крови в микрососудах становится понятным происхождение еще одного звена в патогенезе печеночной комы - прогрессирующей гипоксии смешанного характера. Существенное значение в механизме развития комы имеет то обстоятельство, что пораженная печень не способна поддерживать не только должное абсолютное количество, но и необходимое для организма соотношение отдельных аминокислот и фракций белков крови. Избыток одних и дефицит других аминокислот делает невозможным нормальный обмен белков в тканях организма. Важным механизмом развития печеночной комы являются гипогликемия и ацидоз, коррекция которых позволяет значительно улучшить состояние больных. Развитию нарушений кислотно-основного состояния нередко предшествуют гипонатриемия, гипокалиемия, нарушение баланса в организме магния и цинка. Желтуха — синдром, возникающий при увеличении содержания в крови билирубина и характеризующийся желтой окраской кожи, слизистых оболочек, склер в результате отложения в них желчных пигментов при нарушении желчеобразования и желчевыделения. Выделяют такие виды желтухи: 1) надпеченочную, вызванную повышенной продукцией билирубина, главным образом в связи с усилением распада эритроцитов (гемолитическая желтуха) и реже при нарушении плазменного транспорта билирубина; 2) печеночную желтуху, обусловленную нарушением захвата, конъюгации и экскреции билирубина гепатоцитами вследствие их повреждения при различных патологических процессах, а также приобретенных и наследственных дефектах структуры гепатоцитов и ферментов, участвующих в метаболизме и транспорте билирубина в клетках печени; 3) подпеченочную желтуху (механическую), возникающую при затруднении оттока желчи по внепеченочным желчевыводящим путям. Надпеченочная: Гемолитическая. Патогенез. При усиленном гемолизе эритроцитов в звездчатых эндотелиоцитах печени, макрофагах селезенки, костного мозга образуется столь большое количество свободного (непрямого, неконъюгированного) билирубина, что гепатоциты печени оказываются не в состоянии полностью извлечь его из крови и связать. Кроме того, гемолитические яды часто являются гепатотоксическими веществами, а поражение гепатоцитов затрудняет метаболизм и транспорт билирубина в них. В крови увеличивается содержание неконъюгированного билирубина (непрямая гипербилирубинемия), который не выводится с мочой из-за своей связи с альбумином. Может возрасти уровень конъюгированного (прямого) билирубина, что обусловлено его обратной диффузией в кровь после того, как способность гепатоцита экскретировать связанный билирубин в желчь оказалась исчерпанной. Из лизированных эритроцитов попадает в кровь, а затем в остальные ткани билирубин. Печеночная: К ней относят печеночно-клеточную (паренхиматозную) и энзимопатическую разновидности желтух. Нарушается процесс коньюгации непрямого билирубина с глюкуроновой кислотой в связи со снижением активности глюкуронилтрансферазы. Вследствие этого уменьшается количество образующегося билирубина диглюкуронида (прямого билирубина). Параллельно с этим поврежденные гепатоциты начинают выделять синтезируемую ими желчь не только в желчные капилляры, но и в кровеносные. Это обусловливает появление в крови свободных желчных кислот, увеличение в ней уровня общего билирубина за счет прямого, а также - появление его в моче. Кроме того, сдавление желчных капилляров поврежденными отечными гепатоцитами затрудняет эвакуацию из них желчи и создает условия для увеличения ее резорбции в кровеносные капилляры печени. В связи с этим уменьшается поступление желчи в кишечник, наблюдаются проявления холемии. На третьей стадии, в случае тяжелого поражения печени (стадия прекомы), происходит полная утрата способности гепатоцитов захватывать и преобразовывать непрямой билирубин в прямой. В связи с этим уровень непрямого билирубина в крови начинает нарастать. На этом фоне начинает снижаться содержание в крови прямого билирубина и, как правило, исчезает уробилиноген. Последнее является следствием того, что в кишечник практически не поступает прямого билирубина. Нарушение барьерной и других функций печени, появление в крови токсических форм билирубина и других метаболитов приводят к существенному нарушению гомеостаза организма и угрозе развития печеночной комы. Подпеченочная: Патогенез. Механическое препятствие оттоку желчи приводит к застою (внепеченочный вторичный холестаз)и повышению давления желчи выше 2,7 кПа (270 мм вод. ст.), расширению и разрыву желчных капилляров и поступлению желчи прямо в кровь или через лимфатические пути. Появление желчи в крови обусловливает прямую гипербилирубинемию (увеличивается содержание конъюгированного билирубина), гиперхолестеринемию, развитие холемического синдрома в связи с циркуляцией в крови желчных кислот, билирубинурию (отсюда тёмная окраска мочи — "цвета пива") и наличие желчных кислот в моче. Непоступление желчи в кишечник из-за механического препятствия в желчевыводящих путях приводит к тому, что не образуется и, следовательно, не выделяется стеркобилин с калом (обесцвеченный, ахоличный кал) и мочой. Таков же механизм развития ахолического синдрома, наиболее выраженного при механической желтухе при полной обтурации желчевыводящих путей. При холемии наблюдается кожный зуд, вызываемый раздражением нервных окончаний желчными кислотами. Развиваются артериальная гипотензия и брадикардия. Артериальная гипотензия обусловлена снижением адренореактивности сосудов и сердца, а также - понижением базального тонуса гладких мышц сосудистой стенки. Под влиянием желчных кислот, проникающих через гематоэнцефалический барьер, повышается тонус бульбарных ядер блуждающего нерва, что потенцирует гипотонию и брадикардию. Желчные кислоты оказывают также прямое тормозящее действие на синусный узел сердца.
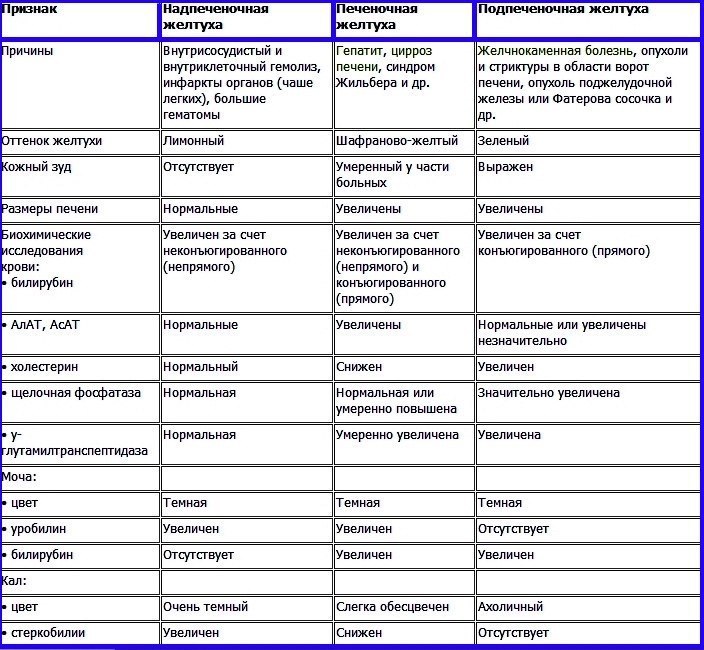
31.Виды отёков, механизмы возникновения и последствия для организма. Принципы и методы устранения отёков. Отек – типовой патологический процесс, заключающийся в избыточном накоплении внеклеточной тканевой жидкости в интерстициальном пространстве. По этиологии, патогенезу, распространенности отеки подразделяются на: 1) системные (общие); Системные отеки возникают вследствие нарушения ведущих механизмов регуляции водно-солевого обмена, что возможно при заболеваниях сердца, почек, печени, желудочно-кишечного тракта. 2) местные (локальные). Осмотический. Механизм образования осмотического отёка заключается в избыточном транспорте воды из крови в межклеточную жидкость по градиенту осмотического давления. Данный механизм имеет место при сердечном, почечном (нефритическом), печёночном и ряде других отёков. Проявляется накоплением в организме осмотически активных веществ (накопление ионов натрия вследствие его усиленной реабсорбции в почечных канальцах). Этот механизм является компенсаторным при гиповолемии и снижении артериального давления. Альдостерон усиливает реабсорбцию натрия в дистальных отделах почечных канальцев, что приводит к гиперосмии внутренней среды. Это приводит к выделению вазопрессина, который увеличивает реабсорбцию воды адекватно натрию. Избыточная изоосмотическая жидкость накапливается в межклеточных пространствах и формируются отеки.
· Онкотический.Проявляется снижением онкотического давления крови вследствие гипопротеинемии. Причинами могут быть: нефротический синдром (потеря белка с мочой), обширные ожоги (плазморея), тяжелые поносы (избыточное выведение белка), белковое голодание (недостаток поступления белка). При этом под действием гидростатического давления жидкость покидает сосуды в артериальном конце капилляра, но в венозном конце не может вернуться в сосуд из-за низкого онкотического давления. При этом развиваются системные отеки (анасарка), накопление жидкости в серозных полостях (брюшной, плевральной, перикардиальной).
· Блокада лимфооттока. Повышение давления в крупных венозных сосудах сопровождается рефлекторным спазмом соответствующих лимфатических сосудов – давление в них повышается и отток лимфы блокируется (рефлекс Русняка-Петровского). Этот механизм присутствует при наследственной недостаточности лимфатических капилляров – элефантиазис (слоновость). Динамическая лимфатическая недостаточность является результатом значительного возрастания лимфообразования. При этом лимфатические сосуды не способны транспортировать в общий кровоток существенно увеличенный объём лимфы.
· Гидростатический (застойный). Проявляется повышением гидростатического давления в капиллярах. Этот механизм играет ведущую роль при застое малого круга (стеноз левого атриовентрикулярного отверстия, левожелудочковая недостаточность), портальной гипертензии (цирроз печени), правожелудочковой недостаточности (повышение давления в капиллярах печени), переливании жидкостей через крупные вены (подключичная, яремная) под большим давлением. Повышение гидростатического давления способствует фильтрации и препятствует реабсорбции, что приводит к накоплению жидкости в межклеточном пространстве.
· Эндотелиальный. Проявляется накоплением БАВ, увеличивающих сосудистую проницаемость. Причины: воспаление, ишемия и гипоксия, аллергические реакции, механическая травма, экзотоксины (укусы змей, насекомых, действие боевых отравляющих веществ). Механизм: БАВ (гистамин, брадикинин, простогландины, тромбоксаны) воздействуют на эндотелиоциты и приводят к их сокращению. Это увеличивает межэндетелиальные щели и белки крови могут проникать в межклеточную жидкость, что приводит к увеличению онкотического давления межклеточной жидкости, которое удерживает воду и препятствует ее возвращению в сосуд. Принципы и методы устранения отёков. Мероприятия, направленные на ликвидацию или уменьшение степени отёков, базируются на этиотропном, патогенетическом и симптоматическом принципах лечения. • Этиотропный принцип. Имеет целью устранение причины и условий, способствующих возникновению отёка (например, заболеваний почек, печени; лечение сердечной недостаточности, проведение дезинтоксикационной терапии). • Патогенетический принцип. Направлен на блокирование инициального, а также вторичных звеньев механизма развития отёка. нормализации эффективного гидростатического давления (снижением повышенного венозного давления, например, с помощью диуретиков, кардиотропных препаратов, венозных дилататоров; уменьшением ОЦК, например, мочегонными, кровопусканием); устранения гиперосмии крови и гиперволемии (например, с помощью спиронолактонов, тормозящих эффекты минералокортикоидов; блокаторов АПФ, препятствующие избыточному образованию альдостерона). ликвидации лимфатической недостаточности(посредством нормализации объема образования лимфы, например, снижением ОЦК и устранения препятствий оттоку лимфы, например, тромбов, рубцов, опухолей, стенозирующих лимфатические сосуды. восстановления нормальной проницаемости стенок микрососудов,главным образом для белка и жидкости (устранением или снижением степени гипоксии; • Симптоматический принцип. Имеет целью устранение патологических процессов, симптомов и реакций, утяжеляющих состояние пациента: уменьшение степени гипоксии при отёке лёгких; ликвидация асцита при сердечной недостаточности или портальной гипертензии; удаление избытка отёчной жидкости из плевральной или суставных полостей. 32.Отёк при сердечной недостаточности: этиология, патогенез и проявления. Причина: сердечная недостаточность (состояние, при котором сердце не может адекватно обеспечить потребности органов и тканей в кровоснабжении). Она характеризуется: меньшей (по сравнению с потребной) величиной сердечного выброса; первично циркуляторной гипоксией. Артериальная гипертензия, пороки, ибс. Патогенез: Когда левая сторона сердца не работает должным образом, давление в легочной артерии может нарастать, вызывая одышку. Повышенное давление в легочной артерии перегружает малый круг кровообращения, который проходит через легкие. Поэтому сердечная недостаточность часто упоминается как застойная сердечная недостаточность (ЗСН). Когда высота давления становится значительной, жидкость может проходить сквозь стенки альвеол и скапливаться в легких. Причины включения гидродинамического фактора: системное повышение венозного давления в связи со снижением сократительной функции сердца и увеличение ОЦК. гипопротеинемические – сопровождаются снижением содержания белков в плазме крови, в том числе альбуминов. Отеки данного вида, прежде всего, образуются там, где сосредоточена большая часть рыхлой соединительной ткани, например, на лице. Припухлость появляется в этом случае после сна вокруг глаз; мембраногенные – образуются при повышении проницаемости стенок сосудов. Вследствие этого белок плазмы крови попадает в межклеточное пространство, что приводит к увеличению давления и выходу жидкости из кровеносных сосудов в соединительные структуры; гидростатические – возникают при увеличении давления в капиллярах. Причина: снижение величины минутного объёма кровотока. Механизм реализации: активация системы «ренин-ангиотензинальдостерон», вследствие чего усиливается реабсорбция Na+ в канальцах почек. гиперосмия крови (за счёт увеличения концентрации Na+) приводит к активации осморецепторов, усилению синтеза и высвобождения в кровь АДГ. Под влиянием этого гормона в почках увеличивается реабсорбция воды, что приводит к гиперволемии и включению гидродинамического фактора. Причины: венозный застой и лимфатическая недостаточность, изменение метаболизма в условиях гипоксии. Механизм реализации: увеличение образования метаболитов и снижение транспорта осмотически активных веществ от тканей приводит к повышению осмотического давления в интерстициальной жидкости и включению осмотического фактора. Причина: нарушение кровоснабжения печени. Механизмы реализации: расстройства энергетического, субстратного и кислородного обеспечения синтеза белка в гепатоцитах приводит к развитию гипоальбуминемии и включению онкотического фактора. Таким образом, развитие отёка при сердечной недостаточности является результатом сочетанного и взаимопотенцирующего действия всех патогенетических факторов: гидродинамического, осмотического, онкотического, мембраногенного и лимфогенного. В области легких они возникают, если заметны отклонения в работе левого желудочка. Ноги симметрично отекают при проблемах с правым желудочком. Отек нижних конечностей нередко связан с поражением вен в ногах, которые не дренируют кровь должным образом, или варикозным расширением вен / венозной недостаточностью. 33.Отёк лёгких: причины, патогенез, проявления, последствия. Причины: - Острая сердечная недостаточность (левожелудочковая или общая) в результате: инфаркта миокарда;порока сердца; экссудативного перикардита (сопровождающегося сдавлением сердца);гипертензивного криза; аритмий. - Токсичные вещества, повышающие проницаемость стенок микрососудов лёгких (например, фосген, фосфорорганические соединения, угарный газ, чистый кислород под высоким давлением). Механизм развития: Инициальный и основной патогенетический фактор - гемодинамический. При снижении сократительной функции миокарда левого желудочка кровь застаивается в сосудах малого круга кровообращения. При увеличении давления выше 25-30 мм рт.ст. вода начинает поступать в межклеточное пространство лёгких (развивается интерстициальный отёк). При накоплении в интерстиции большого количества отёчной жидкости она проникает между клетками эпителия альвеол, заполняя полости последних (развивается альвеолярный отёк). В связи с этим нарушается газообмен в лёгких, развиваются дыхательная гипоксия и ацидоз. Отёк лёгких при действии токсичных веществ. Инициальный и основной патогенетический фактор - мембраногенный. Под воздействием чистого кислорода или токсичных веществ увеличивается проницаемость стенок сосудов и изменяется форма эндотелия капилляров малого круга кровообращения. Прогноз: Даже после благополучного купирования отека легких возможны осложнения в виде ишемического поражения внутренних органов, застойной пневмонии, ателектазов легкого, пневмосклероза. В том случае, если первопричина отека легких не устранена, высока вероятность его повторения. Когда отек купирован – лечение заканчивать рано. После крайне тяжелого состояния отека легких нередко возникают серьезные осложнения: присоединение вторичной инфекции. Чаще всего развивается пневмония. На фоне сниженного иммунитета даже бронхит может повлечь за собой неблагоприятные осложнения. Пневмония на фоне отека легких сложно поддается лечению; гипоксия, характерная для отека легких, поражает жизненно важные органы. Самые серьезные последствия могут поражать мозг и сердечно-сосудистую систему – последствия отека могут оказаться необратимыми. Нарушение мозгового кровообращения, кардиосклероз, сердечная недостаточность без мощной фармакологической поддержки приводят к летальному исходу. Симптомы В начале развития приступа больной часто покашливает, у него нарастает хрипота, а лицо, ногтевые пластины и слизистые становятся синюшными. Удушье усиливается, сопровождаясь ощущением стеснения в груди и давящей болью. Для облегчения больной вынужден сесть а иногда и наклониться вперед. Очень быстро проявляются и основные признаки отека легких: учащенное дыхание, которое становится хриплым и клокочущим, появляются слабость и головокружение. Вены в области шеи набухают. При кашле выделяется розовая пенящаяся мокрота. А при ухудшении состояния она может выделяться и из носа. Пациент испуган, его сознание может быть спутанным. Конечности, а затем и все тело становятся влажными от холодного липкого пота. 34.Почечные отёки: этиология, патогенез, проявления, последствия. Почечные отеки- отеки, развивающиеся за счет нарушения проницаемости капилляров и повышенной продукции альдостерона корой надпочечников. Кроме того, важное значение в возникновении отеков имеет понижение онкотического давления белков плазмы крови (за счет их усиленного выведения с мочой) и повышение внутрикапиллярного давления, которое способствует усиленной фильтрации жидкости в ткани и понижает ее обратную реабсорбцию. При поражении почек могут возникать отеки:1) нефротические (при нефрозах т.е. поражении канальцев) и 2) нефритические (при нефритах - поражении клубочков почек). Патогенез отеков при нефрозах - поражение преимущественно канальцевого аппарата почек → увеличение проницаемости почечного фильтра для белков - альбуминурия → гипоальбуминемия → снижение онкотического давления крови → увеличение оттока воды в ткани - недостаточность обратного тока лимфы → уменьшение объема плазмы → гиповолемия → увеличение образования альдостерона и АДГ → задержка в организме натрия и воды → отеки по утрам на лице (особенно веки - где самая тонкая кожа). Патогенез нефритических отеков связан с поражением клубочков - ведет к нарушению в них кровообращения, увеличению выработки ренина, который увеличивает образование ангиотензина-I и II, который активирует секрецию альдостерона. Альдостерон вызывает задержку натрия и воды → гипернатриемия - через осморецепторы активирует секрецию АДГ. АДГ активирует гиалуронидазу эпителия почечных и собирательных канальцев, разрушающую гиалуроновую кислоту стенки капилляров, повышая их проницаемость. Возникает генерализованный капаллярит - резко повышается обратная реабсорбация, вода задерживается в организме, а повышение проницаемости капилляров ведет к поступлению воды в ткани и возникновению отека. При этом в ткани выходит не только вода, но и белки плазмы крови. Поэтому отличительной чертой нефритических отеков является высокое содержание белка в межтканевой жидкости и повышение гидрофильности тканей. Отекам способствует также задержка натрия в тканях и повышение в них осмотического давления. 35.Причины возникновения, патогенез кахектических, застойных, аллергических отеков. Кахектические отеки. Кахексия – патологическое состояние, характеризующееся тяжелыми трофическими расстройствами, потерей массы тела, перераспределением внутри- и внесосудистого пула жидкости. Этиологические факторы кахексии включают алиментарный фактор (голодание, вплоть до анорексии), а также расстройства функции эндокринной системы, алкоголизм, онкологические заболевания). Особенно важным условием развития кахектического отека является авитаминоз или гиповитаминоз витаминов группы В. Патогенетическим механизмом развития указанной патологии являются недостаточность синтеза белков, снижение внутрисосудистого онкотического давления. При этом значительно усиливаются процессы ультрафильтрации плазмы крови в микроциркуляторном русле различных органов и тканей. Гипопротеинемические отеки имеют мягкую, тестоватую консистенцию; кожа над ними сухая, истонченная, прозрачная. Отеки симметричны, в основном локализуются в области голени, стопы, лица. При кахектических отеках нарушается работа сердца и почек, происходят дегенеративные изменения в структуре гладкой мускулатуры. Застойный отек является следствием затрудненного оттока крови и лимфы, чаще всего при сердечно-сосудистой недостаточности, заболеваниях почек, во второй половине беременности, недостаточном моционе, нарушении белково-минерального обмена, сдавливании вен и лимфатических путей рубцовой тканью, тромбофлебитах яремной и других крупных вен. Застойные отеки тестоваты, холодные и безболезненные. Чаще они наблюдаются в дистальных частях конечностей, в области подгрудка, Живота и половых органов. Необходимо иметь в виду, что при хроническом течении застойных и других отеков развиваются пролифераты с последующей гиперплазией соединительнотканных элементов и превращением рыхлой соединительной ткани в рубцовую, что может привести к слоновости. Гипотензия, обусловленная сердечной недостаточностью, рефлекторно вовлекает в ответную реакцию ренин-ангиотензин-альдостероновый механизм задержки воды. Возникающая гиперволемия усугубляет тяжесть процесса, способствуя большому накоплению транссудата в тканях. Аллергический отек. Развивается у сенсибилизированных животных в ответ на повторное попадание аллергена. Проявляется гиперергическим воспалением в виде крапивницы, аллергической сыпи, резкой отечности на месте введения антигена при развитии гиперчувствительности немедленного или замедленного типа. Помимо медиаторов воспаления в развитии отека аллергического происхождения большое значение придают образованию иммунных комплексов, обладающих цитотоксичностью. Последствия отеков зависят от локализации, продолжительности и выраженности. Длительное накопление жидкости в тканях снижает возможность поступления питательных веществ к клеточным элементам, подвергает их сдавливанию. Нарушаются структура и функция пораженных тканей, органов. Отек легких приводит к асфиксии, водянка полости перикарда — к тампонаде сердца, асцит нарушает функцию органов брюшной полости. 36.Компенсированные и декомпенсированные ацидозы: виды, механизмы развития и проявлений. Механизмы компенсации ацидоза. Ацидоз - типовая форма нарушения КЩР, характеризующаяся относительным или абсолютным избытком в организме кислот. В крови при ацидозе происходит абсолютное или относительное повышение [H+] и уменьшение pH ниже нормы (условно - ниже нейтральной величины pH, принимаемой за 7,39). При pH 7,38-7,35 - компенсированный ацидоз. При pH 7,34 и ниже - некомпенсированный ацидоз. При газовом ацидозе концентрация угольной кислоты СО увеличивается, при газовом алкалозе - уменьшается. Газовые (респираторные) расстройства КЩР характеризуются первичным изменением содержания в организме CO2 и, как следствие, - концентрации угольной кислоты в соотношении: [HCO3-]/[H2CO3]. Угольная кислота диссоциирует с образованием H+. Респираторный ацидоз характеризуется снижением pH крови и гиперкапнией (повышением рСО2 крови более 40 мм рт.ст.). Причина: гиповентиляция лёгких (например, при спазме бронхиол или обтурации дыхательных путей). Негазовые (нереспираторные) нарушения КЩР характеризуются первичным изменением содержания гидрокарбоната в соотношении: [HCO3-]/[H2CO3]. При негазовых ацидозах концентрация гидрокарбонатов уменьшается.
1.Метаболический ацидоз - одна из наиболее частых форм нарушения КЩР. Причины метаболического ацидоза. ♦ Нарушения метаболизма, приводящие к накоплению избытка нелетучих кислот и других веществ с кислыми свойствами (например, при сердечной недостаточности, большинстве типов гипоксии). ♦ Недостаточность буферных систем и физиологических механизмов по нейтрализации и выведению избытка нелетучих кислот из организма (например, при печёночной или почечной недостаточности, гипопротеинемии). Механизмы развития: ♦ Избыточная секреция эпителием канальцев почек в первичную мочу H+ и К+, а также реабсорбция Na+ из первичной мочи в кровь (вследствие изменения активности Na+,К+-АТФазы под влиянием альдостерона). ♦ Накопление в клетках H+ с развитием внутриклеточного ацидоза. ♦ Задержка в клетках Na+ и гипергидратация клеток в связи с гиперосмией. 2.Выделительные ацидозы: • Почечный выделительный ацидоз (накопление в организме кислот, потеря оснований) возникает вследствие почечной недостаточности, интоксикации сульфаниламидами, гипоксии ткани почек. • Кишечный выделительный ацидоз (потеря организмом оснований) развивается вследствие диареи, фистулы или открытой раны тонкого кишечника. • Гиперсаливационный выделительный ацидоз (потеря организмом оснований) связан со стоматитами, токсикозом беременных, гельминтозами, отравлением никотином или препаратами ртути.
3.Экзогенный ацидоз является следствием поступления в организм соединений с кислыми свойствами. Причины: ♦ Приём растворов нелетучих кислот (например, соляной, серной, азотной) по ошибке, либо с целью отравления. ♦ Продолжительное употребление продуктов питания и питья, содержащих большое количество кислот (например, лимонной, яблочной, соляной, салициловой). ♦ Применение ЛС, содержащих кислоты или их соли (например, ацетилсалициловой кислоты). ♦ Трансфузия препаратов донорской крови, консервированной лимоннокислым натрием. • Механизмы развития: ♦ Диссоциация экзогенных кислот и их солей ведёт к увеличению концентрации H+ в организме и быстрому истощению буферных систем. ♦ Нарушения обмена веществ под влиянием экзогенных кислот сопровождаются накоплением эндогенных кислых метаболитов. ♦ Повреждение печени и почек потенцирует степень ацидоза.
В клинической практике нередко наблюдают комбинацию газовых и негазовых ацидозов или алкалозов одновременно. Примеры подобных состояний:• Сердечная недостаточность. У пациента может развиться смешанный ацидоз: газовый (в связи с нарушением перфузии альвеол и отёком лёгких) и негазовые: метаболический (в результате циркуляторной гипоксии) и выделительный почечный (обусловленный гипоперфузией почек). • Травма головного мозга или беременность. Наблюдается смешанный алкалоз: газовый (вызванный гипервентиляцией лёгких) и негазовый: выделительный желудочный (вследствие повторной рвоты желудочным содержимым). Проявления ацидозов: ♦ Компенсаторное увеличение альвеолярной вентиляции. При тяжёлом ацидозе может регистрироваться глубокое и шумное дыхание - периодическое дыхание Куссмауля.♦ Нарастающее угнетение нервной системы и ВНД, что проявляется сонливостью, заторможённостью, сопором или комой (например, при кетоацидозе у пациентов с СД).♦ Снижение кровотока в мозге, миокарде и почках. Это усугубляет нарушение функций нервной системы, сердца, а также обусловливает олигурию (уменьшение диуреза).♦ Дисбаланс ионов вследствие активации компенсаторных механизмов: увеличение содержания ионов К+ в межклеточной жидкости, гиперкалиемия, гиперфосфатемия, гипохлоремия.♦ Гиперосмолярный и отёчный синдромы. Механизмы компенсации ацидоза направлены на нейтрализацию избытка H+. Выделяют срочные и долговременные механизмы компенсации. • Срочные механизмы: активация клеточных и внеклеточных буферов, Cl-HCO3-антипорта эритроцитов, увеличение альвеолярной вентиляции. • Долговременные механизмы реализуются почками и печенью, буферами костной ткани, обкладочными клетками желудка.
37.Способы и патогенетические принципы коррекции ацидозов. Респираторный ацидоз:Главная цель: уменьшение степени или ликвидация дыхательной недостаточности. • Этиотропный принцип направлен на устранение причин ацидоза: гиповентиляции или гипоперфузии лёгких, а также сниженной диффузионной способности аэрогематического барьера. При острой дыхательной недостаточности эти мероприятия могут полностью ликвидировать ацидоз. • Патогенетическое лечение имеет целью устранение повышенного уровня CO2 в крови и других биологических жидкостях организма. Введение содержащих гидрокарбонат буферных растворов с целью устранения хронического респираторного ацидоза неэффективно. Это объясняется тем, что экзогенный HCO3- быстро удаляется из организма почками. • Симптоматическое лечение имеет целью устранение неприятных и тягостных ощущений, усугубляющих состояние пациента: головной боли, аритмий сердца, психомоторного перевозбуждения, избыточной потливости и других.
Негазовые ацидозы: Основная цель: уменьшение содержания в организме избытка кислот и восстановление нормального содержания HCO3-. • Этиотропный принцип подразумевает ликвидацию причины развития негазового ацидоза. • Патогенетическое лечение направлено на нормализацию содержания в жидких средах организма HCO3-. • Симптоматическое лечение направлено на ликвидацию головной боли, нарушений нервно-мышечной проводимости и мышечного тонуса, расстройств ритма сердца, функций ЖКТ и других симптомов. 38.Компенсированные и декомпенсированные ацидозы: виды, механизмы развития и проявлений. Механизмы компенсации алкалозов. Алкалоз - типовая форма нарушения КЩР, характеризующаяся относительным или абсолютным избытком в организме оснований. В крови при алкалозе отмечается абсолютное или относительное снижение [H+] и увеличение pH (условно - выше нейтральной величины pH, принимаемой за 7,39). При pH 7,40-7,45 - компенсированный алкалоз. При pH 7,46 и выше - некомпенсированный алкалоз. При газовом алкалозе концентрация угольной кислоты уменьшается. Респираторный алкалоз характеризуется увеличением pH крови и гипокапнией (уровень рСО2 крови 35 мм рт.ст. и менее). Причина: гипервентиляция лёгких (например, при проведении ИВЛ). Негазовые (нереспираторные) нарушения КЩР характеризуются первичным изменением содержания гидрокарбоната в соотношении: [HCO3-]/[H2CO3]. При негазовых алкалозах концентрация гидрокарбонатов увеличивается.
Метаболический алкалоз характеризуется повышением pH крови и увеличением концентрации бикарбоната в результате расстройств обмена ионов Na+, Ca2+ и К+. • Причины ♦ Гиперальдостеронизм приводит к гипернатриемии и гипокалиемии. ♦ Гипофункция паращитовидных желёз сопровождается гипокальциемией и гиперфосфатемией. Механизмы развития: ♦ Избыточная секреция эпителием канальцев почек в первичную мочу H+ и К+, а также реабсорбция Na+ из первичной мочи в кровь (вследствие изменения активности Na+,К+-АТФазы под влиянием альдостерона). ♦ Задержка в клетках Na+ и гипергидратация клеток в связи с гиперосмией.
Выделительные алкалозы: • Желудочный выделительный алкалоз развивается вследствие потери организмом HCl при рвоте желудочным содержимым (например, при токсикозе беременных, пилороспазме, пилоростенозе, кишечной непроходимости) или отсасывании его через зонд.• Почечные (ренальные) выделительные алкалозы обусловлены выведением из организма Na+ и задержкой гидрокарбоната почками.♦ Торможение реабсорбции Na+ и воды под влиянием диуретиков (например, фуросемида) приводит к выведению из организма Na+, а вместе с ним и Cl- в повышенном количестве, а содержание щелочных анионов гидрокарбоната в плазме крови возрастает.♦ Наличие в клубочковом фильтрате почек плохо реабсорбируемых ионов (анионов нитрата, сульфата, продуктов метаболизма пенициллина). Накопление плохо реабсорбируемых анионов в первичной моче сопровождается усилением экскреции почками К+ и H+ и реабсорбции HCO3-.• Кишечный (энтеральный) выделительный алкалоз развивается вследствие повышенного выделения из организма К+ кишечником (например, при злоупотреблении слабительными), что стимулирует транспорт в клетки H+ из межклеточной жидкости и плазмы крови, где развивается алкалоз. Экзогенный алкалоз - сравнительно редкое нарушение КЩР - является, как правило, следствием попадания в организм избытка гидрокарбоната либо щелочей.• Причины:♦ Введение в течение короткого времени избытка HCO3--содержащих растворов (например, при коррекции лактатацидоза или кетоацидоза у пациентов с СД).♦ Продолжительное использование продуктов питания и питья, содержащих большое количество щелочей. Наблюдается у пациентов с язвенной болезнью желудка, принимающих в больших количествах щелочные растворы и молоко.• Механизм развития. Основное звено патогенеза экзогенного алкалоза - увеличение концентрации HCO3- в плазме крови. В клинической практике нередко наблюдают комбинацию газовых и негазовых ацидозов или алкалозов одновременно. Примеры подобных состояний:• Сердечная недостаточность. У пациента может развиться смешанный ацидоз: газовый (в связи с нарушением перфузии альвеол и отёком лёгких) и негазовые: метаболический (в результате циркуляторной гипоксии) и выделительный почечный (обусловленный гипоперфузией почек). • Травма головного мозга или беременность. Наблюдается смешанный алкалоз: газовый (вызванный гипервентиляцией лёгких) и негазовый: выделительный желудочный (вследствие повторной рвоты желудочным содержимым).
Проявления алкалозов:♦ Недостаточность центрального и органно-тканевого кровотока.♦ Нарушение микрогемоциркуляции, вплоть до признаков капилляро-трофической недостаточности.♦ Гипоксия вследствие недостаточности кровообращения и увеличения сродства Hb к кислороду.♦ Гипокалиемия в связи с транспортом K+ из межклеточной жидкости в клетки в обмен на H+.♦ Ухудшение нервно-мышечной возбудимости, проявляющееся мышечной слабостью, нарушением перистальтики желудка и кишечника. Указанные расстройства, а также нарушения ритма сердца являются, в основном, результатом гипокалиемии.
Механизмы компенсации алкалоза обеспечивают: 1) снижение в плазме крови и в других биологических жидкостях концентрации HCO3- и 2) повышение pCO2 и, как следствие, - концентрации H2CO3. Однако, механизмы устранения алкалозов значительно менее эффективны, чем ацидозов.• Срочные механизмы устранения алкалоза.♦ Клеточные механизмы компенсации. Наибольшее значение среди них имеет активация реакций метаболизма с образованием нелетучих органических кислот.♦ Снижение объёма альвеолярной вентиляции. В связи с этим повышается pCO2, концентрация угольной кислоты и образующегося при её диссоциации H+.• Долговременные механизмы компенсации алкалоза. Они реализуются при участии почек: в них происходит выведение из организма избытка HCO3-.
