

3.1. Патогенассоциированные молекулярные паттерны (pathogen-associated molecular pattern, РАМР)
Это “маленькие” молекулярные мотивы, постоянно обнаруживаемые у патогенов и отсутствующие в организме-хозяина (человека). Эти молекулы для патогенов жизненно необходимы и не могут быть удалены или изменены при мутации (эволюционно консервативны, или постоянны). Распознавание PAMPs клетками нашего организма служит сигналом о внедрении не просто чужеродного, а биологически агрессивного агента.
Следует отметить, что РАМРs присутствуют не только у патогенных микроорганизмов, но и у представителей нормальной микрофлоры человека. Клетки иммунной системы не активируются РАМРs нормальной микрофлоры до тех пор, пока эти организмы находятся в своей экологической нише и физически недосягаемы для наших клеток. При транслокации за пределы ниши и контакте с клетками макроорганизма последние будут распознавать РАМРs комменсалов и активироваться.
Ч. Джэнуэй предположил, что рецепторы будут распознавать какие-то химические структуры, характерные для целого класса патогенов.
“Иначе просто не хватит генов!”
Чарльз Джэнуэй
1943—2003
Примеры некоторых РАМРs: мурамилдипептид, липополисахарид, флагеллин, липотейхоевая кислота, пептидогликан, нуклеиновая кислота (СрG), манноза, липопротеины, грибковые гликаны.
Свойства РАМР
1.отсутствуют у человека,
2.имеют сходное строение у группы организмов,
3.генетически стабильны (относительно редко мутируют),
4.жизненно важные структуры
7

Относительные размеры компонентов клеточной стенки золотистого стафилококка (электронная микроскопия). PM ‒ плазматическая мембрана, CW ‒ клеточная стенка.
Линейка 50 нм (Matias et al., 2006).
Схема строения клеточной стенки грамположительных бактерий на примере золотистого стафилококка. Снизу вверх: плазматическая мембрана бактерии (Membrane), пептидогликан (Peptidoglycan), поверхностные белки (Surface proteins, заякорены в слое пептидогликана), тейхоевые кислоты, заякоренные в клеточной стенке (WTA, wall teichoic acid), липотейхоевые кислоты, заякорены в плазматической мембране бактерии (LTA, lipoteichoic acid) (Xia et al., 2010).
Пептидогликан состоит из цепи чередующихся гликанов: N-ацетилглюкозамина (Glc) и N-ацетилмурамовой кислоты (Mur), соединённых β-1,4 связями и перекрёстно соединённых пептидными цепочками (Johnson et al., 2016). В растущей бактериальной клетке пептидогликан подвергается постоянному ремоделированию, поэтому продукты его распада образуются постоянно. Они могут попадать в клетки нашего организма через специальные транспортные системы или из эндосом (FI2013). Минимальной структурной единицей пептидогликана является мурамилдипептид (см. вставку в рамке). Мурамилдипептид вызвает синтез провоспалительных цитокинов в клетках нашего организма после её заимодействия с внутриклеточным PRR ‒ NOD2 (Uehori et al., 2005).
8

Жгутики бактерий построены из белка флагеллина, являющегося лигандом TLR5. Вставка в рамке: способы работы жгутиков и соответствующие им типы движения бактерии (указаны стрел-
ками). Из книги «Molecular Biology of the Cell» https://www.ncbi.nlm.nih.gov/books/NBK21054/.
белок матрикса
нуклеопротеин
SH (small hydrophobic)
протеин
На поверхности респираторносинцитиального вируса, который является основным возбудителем тяжёлых инфекций нижних дыхательных путей, находится F (от «fusion» ‒ слияние)-протеин. F- протеин необходим вирусу для проникновения в эпителиальные клетки хозяина и формирования синцития. Протеин может находится в двух конформационных состояниях: пре-F (функциональный; обозначен красным цветом) и пост-F (нефункциональный; обозначен синим цветом). Зелёные фигуры - G-гликопротеин
(Graham et al., 2015). F-протеин распозна-
ётся TLR4 на клетках макроорганизма, что вызывает их мощную реакцию в виде секреции провоспалительных цитокинов.
9

CpG-мотив ‒ это участок двуцепочечной ДНК с определённой последовательностью из 6 нуклеотидов. Все нуклеотиды в CpG-мотиве расположены на одной стороне двуцепочечной ДНК. CpG-мотив состоит из трёх компонентов: 1) центрально расположенного неметилированного динуклеотида CpG, в котором после цитидина (С) в направлении 5’-3’ следует гуанозин (G), а нуклеотиды разделены остатком фосфорной кислоты (р), 2) двух пуриновых остатков с 5′-конца и 3) двух пиримидиновых остатков с 3′-конца. Наиболее часто в геномах встречаются последовательности GACGTC, GACGTT, AACGTC, AACGTT. CpG-динуклеотиды не следует путать с комплементарно соединёнными C и G на противоположных цепях ДНК (Weaver et al., 2017).
CpG-мотивы с неметилированным цитидином содержатся в прокариотической ДНК и обуславливают её иммуностимулирующие свойства (Krieg et al., 1995). Следует отметить, что ДНК эукариот также содержит CpG-мотивы. Однако их количество у эукариот около 1 на 50 оснований, тогда как в прокариотической ДНК их намного больше ‒ примерно 1 на 16 оснований. Кроме того, практически все CpG-мотивы эукариот метилированы, что отменяет их иммуностимулирующие свойства (Kline et al., 2010).
10
Пептидогликан клеточной стенки грам-отрицательных бактерий заключён между внутренней и внешней мембранами. А на поверхности этих бактерий находится самый известный и хорошо изученный патогенассоциированный молекулярный паттерн ‒ липополисахарид (ЛПС; Lipopolysaccharide, LPS). Другое название этой молекулы, которое часто используется как его синоним, ‒ эндотоксин. Термин «эндотоксин» был введён Ричадом Пфайфером (коллега Р. Коха) при исследовании патогенности холерного вибриона. Оказалось, что, несмотря на иммунизацию подопытных животных возбудителем холеры, инокуляция микроба вызывала их смерть. Существенно, что в организме животных при этом не обнаруживалось живых вибрионов. Такой же исход экспериментов наблюдался при введении микробов, обезвреженных воздействием высокой температуры. Это означало, что какой-то термостабильный небелковый компонент, высвобождающийся из бактерии при её гибели, способен вызывать мощную воспалительную реакцию макроорганизма, приводящую к его смерти.
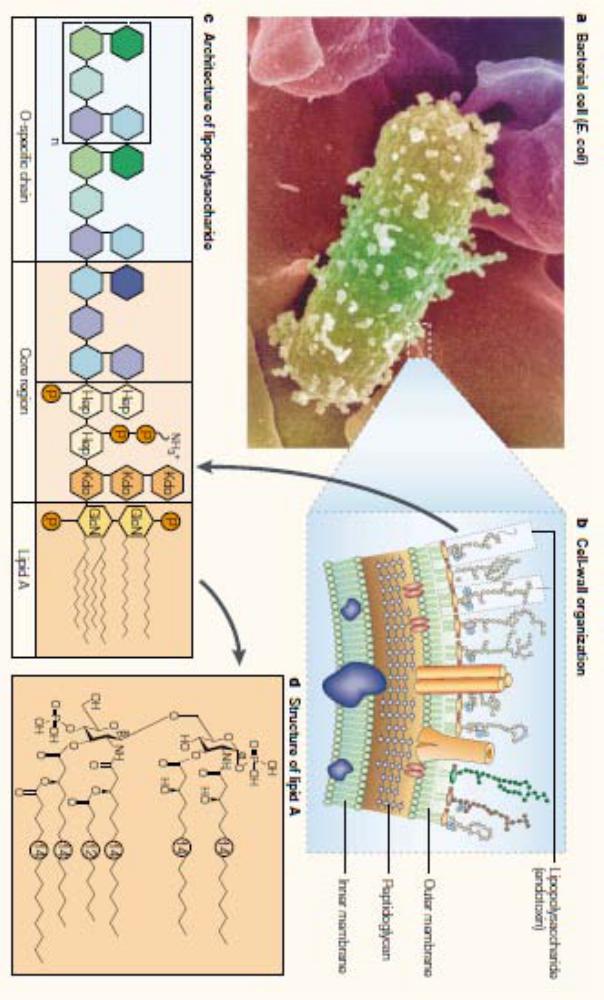
На рисунке (стр. 12 ) показана схема строения стенки грам-отрицательных бактерий на примере Escherichia coli. а ‒ внешний вид E. coli (электронная микрофотография). b ‒ поперечный срез клеточной стенки грам-отрицательной бактерии; указаны внутренняя мембрана (Inner membrane), слой пептидогликана (Peptidoglycan), расположенный в середине, и внешняя мембрана (Outer membrane), в которой заякорены молекулы липполисахарида (Lipopolysaccharide, сокр. LPS или ЛПС). с ‒ строение молекулы LPS. В молекуле выделяют О-специфическую цепь (O-specific chain), центральный регион (Core region) и липид А (Lipid A). Именно липид А обуславливает токсические и порогенные свойства LPS. d ‒ химическая структура липида А: GlcN ‒ D- глюкозамин, Hep ‒ L-глицеро-D-манно-гептоза, Kdo ‒ 2-кето-3-деокси-октулозоновая кислота, P ‒
фосфат. (Beutler et al., 2003).
Клетки и компоненты иммунной системы взаимодействуют с липополисахаридом по-разному. О-антиген распознаётся антителами (один из компонентов сыворотки крови) и В-клеточными рецепторами, то есть компонентами адаптивного иммунитета. На этом основано серологическое типирование видов и штаммов бактерий. Липид А взаимодействует с паттернраспознающими рецепторами врождённой иммунной системы (Park et al. 2009). Именно липид А обуславливает токсические и пирогенные свойства LPS.
Молекула LPS является примером того, что один и тот же объект может являться и антигеном и паттерном одновременно. Микроорганизмы как более сложно устроенные объекты микромира также одновременно являются и антигенами и паттернами.
11
12

3.2. Эндогенные сигналы стресса (damage associated molecular pattern, DAMP).
Потенциальные DAMPs являются компонентами нормально функционирующих клеток и тканей. Такие молекулы либо пассивно высвобождаются из клеток в случае повреждения последних, либо активно синтезируются и секретируются клетками в состоянии стресса и, в итоге, становятся доступными для рецепторов врожденного иммунитета.
Полли Матзингер впервые высказала идею о том, что работа иммунной системы заключается не столько в распознавании и удалении «чужого», сколько в обнаружении и ликвидации «опасности», возникающей при деструкции тканей и клеток организма (Matzinger P., 1994).
Полли Матзингер
1947
К молекулам собственного организма, которые приобретают свойства DAMP при стрессе или повреждении клеток и тканей, относятся:
1.Компоненты клеточного дебриса: белки теплового шока (БТШ), мембранные фосфолипиды, пуриновые метаболиты, семейство кальцийсвязывающих белков
S100, гистоны, HMGB1 и т.д.
2.Продукты синтеза активированных клеток: антимикробные белки (кателицидины, дефензины, нейротоксин эозинофилов), ИЛ-1, HMGB1 и т.д.
4.Мочевая кислота, кристаллы холестерина, β-амилоид, внеклеточная АТФ.
5.Молекулы, подобные МНС 1.
13

Белки теплового шока (heat shock proteins, HSP) это большая группа цитоплазматических белков, основная часть которых выполняет функции шаперонов (от англ. «chaperone» ‒ учитель, наставник, сопровождающий группу молодёжи), то есть белков, осуществляющих укладку или разборку полипептидов. Согласно современной классификации в группу HSP входят семейства белков HSPA (HSP70) и HSPH (HSP110), которые объединены в суперсемейство HSP70, семейства DNAJ (HSP40), HSP90/HSPC, HSPB (семейство маленьких белков теплового шока), а также шаперонины и связанные с ними белки. В каждом их этих семейств насчитывается до нескольких десятков членов. Номер в назывании белка указывает на его молекулярную массу в килодальтонах
(Kampinga et al., 2009).
На верхнем рисунке показаны функции белка HSP60 в нормально функционирующей клетке. Некорректно сложенный белок (обозначен сиреневой линией) загружается в HSP60, камера внутри HSP60 закрывается, сложение белка изменяется, и он выгружается в цитоплазму (по https://www.ncbi.nlm.nih.gov/books/NBK26829/figure/A1105/?report=objectonly). Экспрессия HSP
повышается в результате физиологического стресса или физического/химического воздействия на клетку (Wu, 1995), то есть в ситуациях, когда число некорректно сложенных белков может увеличиваться.
HSP приобретают свойства DAMP's, когда оказываются вне клетки на её поверхности, либо во внеклеточном пространстве (Graner, 2016). На нижнем рисунке показаны варианты высвобождения HSP из клетки: 1 ‒ в результате некроза клетки, 2 ‒ в результате секреции (например, HSP70) в пузырьках с последующим их разрушением, 3 ‒ в эндолизосомах, которые сливаются с мембраной клетки, высвобождая HSP70 (по Mambula et al., 2007).
14

HMGB-1 (High mobility group box 1, амфотерин) ‒ убиквитарный, высоко консервативный, негистоновый ядерный белок. На верхнем рисунке в рамке схематично изображены некоторые функции HMGB-1 в ядре нормально функционирующей клетки. Взаимодействие HMGB-1 с нуклеосомой приводит к ослаблению связи ДНК с гистонами и повышению доступности ДНК для хроматинремоделирующего комплекса. (Гистон Н1 связываясь с ДНК в том же участке, приводит к конденсации хроматина (Bianchi et al., 2005)). В цитоплазме HMGB-1 препятствует агрегации белков, вызванной физическим или химическим воздействием, и определяет баланс между аутофагией и апоптозом.
HMGB-1 приобретает функции DAMP (нижняя часть рисунка), когда он оказывается во внеклеточном пространстве и становится доступным для рецепторов врождённого иммунитета на других клетках. Высвобождение HMGB-1 может происходить при некрозе и апоптозе клетки, а также путём активной секреции из макрофага при его активации LPS или провоспалительными цитокина-
ми (Lee et al., 2014).
15

внеклеточное
пространство
цитоплазма
передача
сигнала в клетку
В здоровой клетке белки S100 функционируют как Ca2+-сенсоры и участвуют в передаче сигнала: при повышении концентрации Ca2+ в цитоплазме они связывают катион и взаимодействуют с другими белками (на рисунке они обозначены голубым цветом), изменяя их функциональное состояние.
Некоторые белки S100 становятся DAMPs, когда секретируются во внеклеточное пространство, связывают ионы Zn2+, димеризуются и взаимодействуют с соответствующим клеточным рецептором врождённого иммунитета, в данном случае с RAGE, от которого в клетку поступает активи-
рующий сигнал (по Marenholz et al., 2004).
Находясь в цитоплазме клетки, АТФ выполняет хорошо известную функцию носителя энергии. Однако АТФ может оказаться во внеклеточном пространстве в результате некроза клетки. Либо клетка может самостоятельно секретировать АТФ, находясь в интактном состоянии, в состоянии активации или при стрессе. Внеклеточно расположенная АТФ распознаётся различными пуринэргическими рецепторами и выполняет иные функции: 1) аутокринного и паракринного регулятора активности клеток и 2) функции DAMP. Так, при активации хемоаттрактантами нейтрофилы секретируют АТФ, которая аутокринно регулирует их хемотаксис. А АТФ, высвобождающаяся из умирающих клеток, усиливает фагоцитарную активность фагоцитов, расположенных рядом с погибающей клеткой (функции DAMP). На рисунке представлен один из механизмов секреции АТФ активированной клеткой. Высвобождение АТФ происходит через специальные каналы, состоящие из белка паннексина 1. P2X ‒ пуринергический рецептор, принадлежащий подсемейству P2X (Junger, 2011).
16
3.3. Антигены
Antigen=Antibody generation
Вещества, несущие признаки генетически чужеродной информации, могут нарушить генетическую индивидуальность (однородность) организма. Такие вещества присутствуют в микроорганизмах, чужеродных в генетическом отношении клетках и тканях (измененных в результате мутаций, зараженных вирусами, трансформированных опухолевых клетках и т.п.), а также в продуктах жизнедеятельности и макромолекулярных компонентах этих клеток (белках, полисахаридах, нуклеиновых кислотах и др.). То есть количество генетически чужеродных и потенциально опасных веществ бесконечно.
Для обеспечения распознавания и последующей (если необходимо) их элиминации в ходе эволюции возникает адаптивная иммунная система, способная формировать рецепторы к бесконечному количеству веществ в течение жизни одного организма.
Как уже говорилось в начале раздела 3, объекты, распознаваемые рецепторами клеток адаптивного иммунитета, мы называем антигенами. Сводя воедино это положение и рассуждения о ходе эволюционного процесса, можно сказать, что анти-
гены ‒ это вещества, несущие признаки генетически чужеродной информации, способные нарушить генетическую индивидуальность (однородность) организма и распознаваемые рецепторами клеток адаптивного иммунитета.
Антигены собственного организма называются аутоантигены. Реакция элиминации против аутоантигенов возможна при нарушении функций иммунной системы.
Иммуногены - субстанции, которые вызывают ответ адаптивной иммунной системы. Не все антигены являются иммуногенами, но все иммуногены - антигены.
Уникальность антигена определяется наличием у антигена антигенных детерминант ‒ эпитопов. Эпитоп ‒ часть макромолекулы, которая непосредственно распознается антителами, В- и Т-клеточными рецепторами. Большинство эпитопов имеют трехмерную структуру. Исключение ‒ линейные эпитопы, которые представляют собой первичную структуру протеина.
17
