
- •Различают три агрегатных состояния простых систем: твердое, жидкое и газовое.
- •Диаграмма фазовых состояний чистого вещества
- •Критические параметры являются важнейшими термодинамическими постоянными вещества.
- •Поэтому в принципе, для простых тел (однородных систем) должно существовать единое уравнение состояния
- •где R – характеристическая постоянная газа; Т – абсолютная температура газа; R R
- •Для обобщения данных по коэффициентам сжимаемости различных газов был использован прин- цип «соответственных»
- •Степень удаления от критической точки определяется с помощью приведенных параметров:
- •Зависимость коэффициента сжимаемости углеводородных газов
- •Смеси жидкостей, паров и газов
- •Молярной концентрацией или молярной долей i-го компонента ri называется отношение количества киломолей этого
- •Средняя (кажущаяся) молярная масса смеси равна отношению массы смеси к количеству киломолей смеси
- •Зависимость между массовой и молярной концентрациями устанавливается соотношением
- •Схемы смешения при постоянном объеме (а) и при постоянном давлении (б)
- •Смеси реальных газов

Различают три агрегатных состояния простых систем: твердое, жидкое и газовое.
Линии фазовых превращений (испарение - I, плавление - II, сублимации - III) отображают термодинамическое равновесие двухфазных систем и делят диаграмму на области различных агрегатных состояний.
Энергетической границей между жидкостью и паром является теплота испарения, а между твердым телом и жидкостью – теплота плавления. Так как процессы испарения и плавления протекают при постоянной температуре, то теплоты испарения, плавления и сублимации есть теплоты изотермических превращений. Теплота фазового перехода
обозначается символом r.

Диаграмма фазовых состояний чистого вещества

Критические параметры являются важнейшими термодинамическими постоянными вещества.
Критическая температура – это температура, при которой и выше которой газ никаким сжатием не может быть переведен в жидкое состояние. Критическое давление – это такое давление, при котором и выше которого жидкость невозможно перевести в газообразное состояние никаким изменением температуры.
В закритической области ( p pк ; T Tк ) вещество
может находиться только в однофазном состоянии. Переход из состояния 1 в состояние 2 возможен кратчайшим путем по линии 1-2. Можно этот переход
осуществить через закритическую область, то есть без изменения агрегатного состояния, например по линии
1 1 2 2

Поэтому в принципе, для простых тел (однородных систем) должно существовать единое уравнение состояния F( p, v, T ) 0 , описывающее любое одно-
фазное состояние вещества.
Уравнение состояния идеальных газов - уравнение
Клапейрона: |
|
pv RT |
||||||||||||
для 1 |
кг газа |
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||
для G кг газа |
pV GRT |
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
pv |
|
|
|
T |
|||||
для 1 |
кмоля газа |
R |
||||||||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
pV |
|
|
|
|
|
|
|||
|
|
|
|
|
G |
R |
T |
|
||||||
для G |
кмолей газа |
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||

где R – характеристическая постоянная газа; Т – абсолютная температура газа; R R 8314
( Дж/кмоль К ) – универсальная газовая постоянная, не зависящей от природы газов.
В инженерных расчетах часто пользуются уравнением состояния идеального газа с введением в
него поправочного коэффициента (z), называемого
коэффициентом сжимаемости
pv zRT
Коэффициент сжимаемости (z) учитывает различие между идеальным и реальными газами (для идеаль- ного газа z = 1).

Для обобщения данных по коэффициентам сжимаемости различных газов был использован прин- цип «соответственных» состояний, сформулирован- ный Ван-дер-Ваальсом. Принцип «соответственных» состояний утверждает, что критическое состояние действительно является одинаковым для всех веществ.
В критической точке для всех веществ r = 0,
|
2 p |
|
, p |
|
, |
2 p |
0 |
. |
|||||
|
|
2 |
|
0 |
|
|
0 |
|
|
2 |
|
|
|
|
T |
|
|
v |
|
|
|
||||||
|
|
v |
|
|
v v |
|
|
|
T |
|
|
||
Вещества находятся в соответственных состояниях при одинаковом удалении от критической точки.

Степень удаления от критической точки определяется с помощью приведенных параметров:
приведенного давления |
|
p |
|||
pк |
|||||
|
|
|
|||
приведенной температуры |
|
T |
|
||
Tк |
|||||
|
|
||||
приведенного объема |
w |
v |
|
vк |
|||
|
|
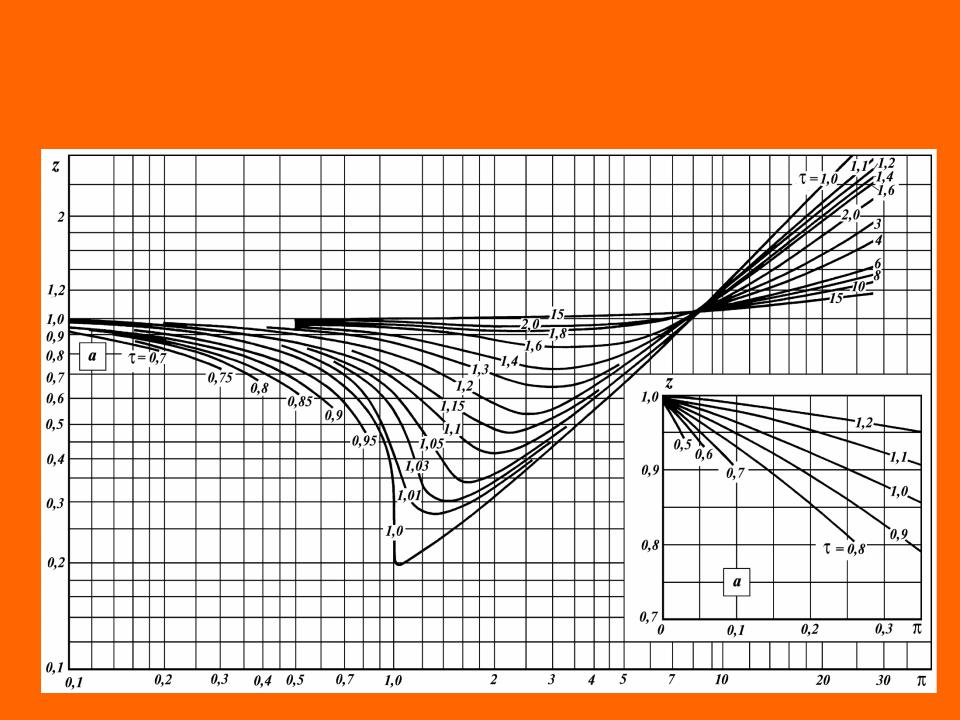
Зависимость коэффициента сжимаемости углеводородных газов

Смеси жидкостей, паров и газов
Смесью называется термодинамическая система состоящая из n-компонентов химический не взаимодействующих между собой веществ.
Массовой концентрацией или массовой долей mi
называется отношение массы компонента к массе всей смеси
G G m Gi n i
Gi
i 1

Молярной концентрацией или молярной долей i-го компонента ri называется отношение количества киломолей этого компонента Gi к общему числу
киломолей смеси
r |
|
|
|
i |
|
|
|
|
|
i |
||
G |
G |
|||||||||||
|
|
|
|
|
|
n |
|
|
||||
|
|
|
||||||||||
i |
G |
|||||||||||
|
|
G i |
||||||||||
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
i 1 |
||||
