
1 курс 1 семестр / Химия / medchem_SAM_med_rus
.pdf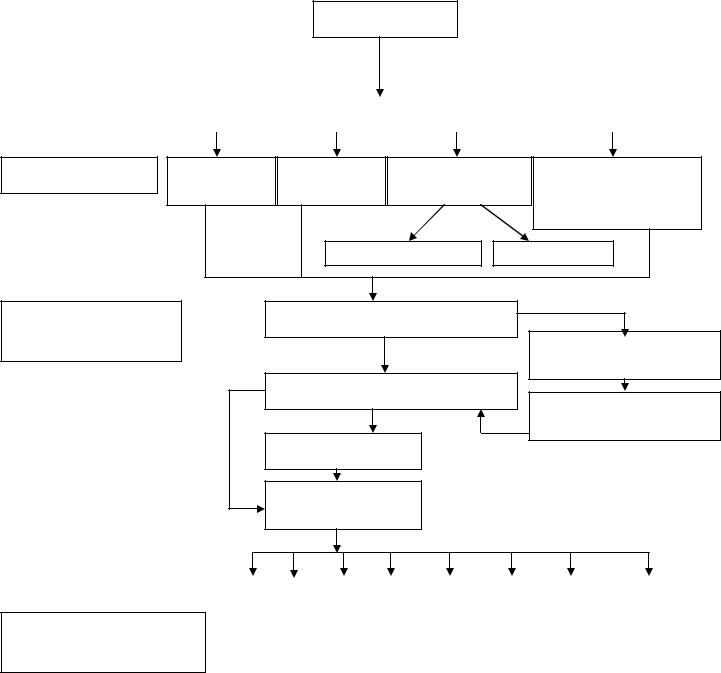
3. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ:
Электроды
Структура |
|
|
|
|
|
|
|
|
|
Проводник |
|
|
Раствор |
|
|
|
|
|
(металл) |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Классификация
Физико-химические свойства
Электроды |
Электроды II |
Ионообменные |
Окислительно- |
|
I рода |
рода |
электроды |
|
восстановительные |
|
|
|
|
электроды |
|
Ионоселективные |
Стеклянные |
||
Электродные потенциалы
Уравнение НЕРНСТА
Направление ОВР
Условия протекания ОВР
Гальванический элемент
ЭДС гальванического элемента
Медико-биологическое значение
Редокс-потенциал в биохимии |
|
Фарм.препараты:ок-ли и вос-ли |
|
Анализ и синтез фарм.препаратов |
|
Клин. диагн-ка (опр-е сахара и др.) |
|
Электрофорез в физиотерапии |
|
ЭКГ в кардиологии |
|
ЭЭГ в неврологии |
|
Подбор материала при протезировании в стоматологии |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29

4. ИСТОЧНИКИ ИНФОРМАЦИИ: Основная литература:
1.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця:
Нова книга, 2006. – С.488-561.
2.Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. Медицинская химия. – К.: Медицина, 2008. – С.195-209.
Дополнительная литература:
3.Ахметов Н.С. Общая и неорганическая химия. Учебник для ВУЗов. М.: Высшая школа, изд. центр «Академия», 2001. – С. 240-247.
4.Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія. Підручник. – Вінниця: Нова книга, 2003. – С.228-251.
5.Садовничая Л.П., Хухрянский В.Г., Цыганенко А.Я. Биофизическая химия. – К.: Вища школа, 1986. – С.93-97, 103-137.
6.Равич - Щербо М.И., Новиков В.В. Физическая и коллоидная химия. –М.:
Высшая школа, 1975. - С.52-75.
7.Селезнёв К.А. Аналитическая химия. М.: «Высшая школа», 1973. – С.41-
46.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
НАБОР ОБУЧАЮЩИХ ЗАДАЧ
Задача 1.
Удельная электропроводность сыворотки крови в норме равна 0,006 Ом-1 ×м-1. Рассчитайте эквивалентную электропроводность сыворотки крови при концентрации электролитов С = 0,005 моль/л.
Эталон решения.
1. Для расчета эквивалентной электропроводности используют соотношение между удельной и эквивалентной электропроводностью:
λ = κ/С×1000,
где λ- эквивалентная электропроводность (См×м2 ×кмоль-1), κ - удельная электропроводность (См/м), С – концентрация электролита (моль/л), 1000 – коэффициент, необходимый для перерасчета концентрации в моль/л.
2. Подставляя в указанное соотношение числовые значения соответствующих величин, получаем:
λ =0,006/0,005×1000 = 0,0012 См×м2 × моль-1.
Эталон ответа: эквивалентная электропроводность сыворотки крови равна
0,0012 См×м2 × моль-1.
Задача 2.
Рассчитать эквивалентную электропроводность желудочного сока, если его удельная электропроводность составляет 0,01 См/м, а разбавление равно 20.
Эталон решения.
1. Связь между удельной электропроводностью, эквивалентной электропроводностью и разбавлением выражается соотношением
λ = κ×V/1000,
30
где λ- эквивалентная электропроводность (См×м2 ×кмоль-1), κ - удельная электропроводность (См/м), V – разбавление электролита (V=1/С).
2. Подставляя в указанное соотношение числовые значения соответствующих величин, получаем:
λ =0,01×20/1000 = 0,0002 См×м2× моль-1.
Эталон ответа: эквивалентная электропроводность желудочного сока равна 0,0002 См×м2 × моль-1.
Задача 3.
Определите электродный потенциал цинка, опущенного в раствор его соли с концентрацией ионов Zn2+, равной 0,001 моль/л.
Эталон решения.
1. Для расчета электродных потенциалов элементов используют уравнение Нернста:
Е = Е0 + 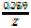 • lgC,
• lgC,
где Е0 - стандартный электродный потенциал элемента (В); Z - число электронов, участвующих в окислительно-восстановительном процессе; С - молярная концентрация катионов металла в разбавленном растворе (моль/л).
|
2. В таблице стандартных электродных потенциалов металлов необходимо |
найти величину E0 – стандартного электродного потенциала цинка. Она равна |
|
E0 |
Zn2+/ Zn = – 0,76 В. |
3.Необходимо найти величину Z. Для цинка она равна 2, так как заряд катиона +2.
4.Подставляя в уравнение Нернста все имеющиеся данные, рассчитываем значение электродного потенциала цинка:
E Zn2+/ Zn = – 0,76 + 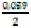 · lg
· lg 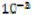 = – 0,76 – 0,0295 · 3= 0,85 (B).
= – 0,76 – 0,0295 · 3= 0,85 (B).
Эталон ответа: электродный потенциал цинка равен 0,85 В.
Задача 4.
Используя значения стандартных электродных потенциалов соответствующих полуреакций, определите возможность протекания в гальваническом элементе следующей реакции Fe0 + Cd2+ = Zn2+ + Cd0.
Эталон решения.
1.В гальваническом элементе происходит окисление атомов железа и восстановление ионов кадмия. Следовательно, схема гальванического элемента:
(–)Fe|Fe2+|Cd2+|Cd(+).
2.Используя таблицу стандартных электродных потенциалов, определяют ЭДС гальванического элемента:
ЭДС= E0 Cd2+| Cd 0 – E0 Fe2+| Fe0 = 0,40 – (– 0,44) = 0,04 В.
Эталон ответа: поскольку ЭДС > 0, данную реакцию можно осуществить в гальваническом элементе.
31
Задача 5.
Хром находится в контакте с медью. Определите, какой из металлов будет окисляться при коррозии, если эта пара попадет в раствор соляной кислоты (кислая среда). Составьте схему образовавшегося гальванического элемента.
Эталон решения.
1. По положению металлов в электрохимическом ряду напряжений
определяем, что хром более активный металл (Е0Cr3+|Cr = -0,744 B) и в гальванической паре будет анодом, а медь – катодом: (E0 Cu2+ |Cu = 0,337 B).
2.Определяем, что происходит с данными металлами в кислой среде. При попадании в раствор НCl хромовый анод растворяется, а на медном катоде выделяется водород.
3.Составляем схему работающего гальванического элемента:
(–)Cr|Cr3+||2H+|H2 (Си)(+)
Эталон ответа: при коррозии будет окисляться хром.
Задача 6.
Электрод имеет схему Ag|Ag+. Определить тип данного электрода и составить для него выражение электродного потенциала.
Эталон решения.
1. Схема Ag|Ag+ указывает на то, что данный электрод состоит из серебряной пластины, погруженной в раствор соли серебра, что соответствует
электродам первого рода. |
|
2. В гальванической цепи серебряный электрод |
положителен, |
следовательно, ему соответствует реакция восстановления: |
Ag+ + e → Ag, а |
электродный потенциал определяется выражением:
ЕAg+|Ag = E0Ag+|Ag + 0059· lg a Ag+
Эталон ответа: серебряный электрод Ag|Ag+ относится к электродам первого рода.
Задача 7.
Полуэлемент состоит из ртути, покрытой каломелью Hg2 Cl2. Система находится в контакте с раствором хлорида калия. Определить тип данного электрода и указать фактор, от которого зависит его потенциал.
Эталон решения.
1. Согласно условию, данный полуэлемент является каломельным электродом, который имеет схему Нg,Hg2Cl2|KCl и относится к электродам второго рода.
2.В результате диссоциации каломели Hg2Cl2 происходит образование иона Hg+ согласно уравнению: Hg2Cl2 + 2е ↔ 2Hg+ + 2Сl-. При работе электрода происходит восстановление металла Hg+ + е → Hg.
3.Активности металлической ртути и каломели можно считать величинами
постоянными. Следовательно, потенциал каломельного электрода зависит только от активности ионов Сl- в растворе и определяется уравнением: е = е0 –
RT/nF ·ln aCl-.
32
Эталон ответа: каломельный электрод относится к электродам второго рода, потенциал которого зависит от активности ионов Сl- .
Задача 8.
Применив потенциометрический метод, определили рН желудочного сока. При этом использовали следующую гальваническую цепь:
Pt (H2)|H+||KClнас|AgCl, Ag.
Определить формулу расчета рН для данной гальванической цепи.
Эталон решения.
1.Цепь состоит из водородного электрода и хлорсеребряного электрода, погруженного в насыщенный раствор КСl.
2.ЭДС данной гальванической цепи равна:
Е= е Ag, AgCl – е Н+|1/2Н2 = еAg, AgCl + 0,059 рН
3.Используя выражение ЭДС гальванической цепи , определяем рН
желудочного сока:
рН= Е- еAg, AgCl /0,059.
Эталон ответа: рН желудочного сока можно рассчитать по формуле:
рН= Е- еAg, AgCl /0,059.
Задача 9.
Электрохимическая цепь состоит из стеклянного электрода и каломельного электрода – электрода сравнения, погруженного в насыщенный раствор КСl. Составить схему определения рН биологических жидкостей с помощью данной гальванической цепи.
Эталон решения.
1. Согласно условию, электрохимическая цепь имеет следующий вид:
стекл.эл.|Н+|| КСlнас.| Hg2Cl2, Hg.
2.Указанную цепь калибруют по буферным растворам.
3.Строят калибровочный график, по которому определяют рН исследуемого раствора.
Эталон ответа: применяя данную потенциометрическую схему, определяют рН различных жидких сред организма.
Задача 10.
На границе растворов с разной концентрацией НCl [с2(НCl)> с1(НCl)] возникает скачок потенциала. Определите тип данного потенциала и обоснуйте причину его возникновения.
Эталон решения.
При контакте растворов с разной концентрацией НCl [с2(НCl)> с1(НCl)] происходит диффузия ионов. При этом скорости перемещения ионов Н+(Н3О+) и Cl- различны. У ионов Н+ скорость диффузии выше, поэтому через границу контакта их проходит больше, чем ионов Cl-. Образуется фронт ионов Н+, за которым движется фронт ионов Cl- , т.е. возникает двойной электрический слой ионов.
33
Эталон ответа:образование двойного электрического слоя при контакте растворов с разной концентрацией является причиной возникновения диффузионного потенциала.
Задача 10.
При раздражении клетки потенциал покоя (ПП) сменяет потенциал действия (ПД). Обоснуйте причину появления данного потенциала и возможность определения его значения.
Эталон решения.
Возбужденный участок клетки становится электроотрицательным по отношению к другим ее частям. Возрастает проницаемость мембраны для ионов Na+, и они направляются внутрь клетки. Затем возникает поток ионов К+ в межклеточную жидкость. Данный процесс является кратковременным (0,001- 0,002 с) и обусловливает перезарядку мембранного потенциала. Значение потенциала действия определяется по уравнению Нернста:
ЕПД = RT/F· [Na+]в / [Na+] нар
Эталон ответа: увеличение проницаемости мембраны возбужденного участка клетки для ионов Na+ является причиной возникновения потенциала действия, значение которого можно определить по уравнению Нернста.
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
Удельная электропроводность раствора альбумина составляет 0,004Ом-1×м-1 , а его молярная концентрация равна 0,003 моль/л. Определите эквивалентную электропроводность (См×м2 × моль-1) данного раствора.
A.0,0005;
B.0,0013;
C.0,05;
D.0,13;
E.0,5.
Задание 2.
Эквивалентная электропроводность спинномозговой жидкости составляет 0,001 См×м2 × моль-1, его разбавление равно 10. Определите удельную электропроводность данной биологической жидкости.
A.0,0005;
B.0,0013;
C.0,05;
D.0,1;
E.0,5.
34
Задание 3.
Окислительно-восстановительные свойства вещества определяются способностью элементов, входящих в состав вещества, отдавать или принимать электроны. Укажите величину, которая количественно характеризует эти свойства вещества в водных растворах?
A.Энергия ионизации;
B.Энергия гидратации;
C.Электроотрицательность;
D.Сродство к электрону;
E.Окислительно-восстановительный потенциал.
Задание 4.
Цинковая пластинка опущена в раствор соли ZnCl2. Определите процесс, происходящий при контакте данной пластинки с раствором?
A.Ионы цинка переходят в раствор;
B.Ионы цинка переходят из раствора на пластинку;
C.Заряд поверхности цинковой пластинки не меняется;
D.Масса пластинки увеличивается;
E.Масса пластинки уменьшается.
Задание 5.
Стандартные потенциалы металлов приведены в шкале электродных потенциалов. Укажите потенциал, который принимается за условный нуль в этой шкале.
A.Стандартный потенциал кислородного электрода;
B.Потенциал земной поверхности;
C.Потенциал данного электрода при активности потенциалопределяющих ионов 1 г-ион\л;
D.Потенциал стандартного водородного электрода;
E.Потенциал данного электрода при нормальных условиях ( н.у.).
Задание 6.
Пять пластин различных металлов опущены в сосуды с водой. Определите пластину, на поверхности которой концентрация свободных электронов будет наибольшей.
A.Железная;
B.Серебряная;
C.Медная;
D.Магниевая;
E.Никелевая.
Задание 7.
Металлы расположили в порядке возрастания стандартных электродных потенциалов. Укажите, какой из приведенных рядов соответствует этому условию.
35

A.Fe, Co, Ni, Mg, Al;
B.Na, Mg, Al, Fe, Cu;
C.Cu, Ag, Hg, Zn, K;
D.Zn, K, Sn, Hg, Au;
E.Pb, Al, Sn, Cu, Pt.
Задание 8.
В кислой среде протекает реакция окисления сульфита калия перманганатом калия .. Определите молярную массу эквивалента перманганата калия KMnO4 в этой реакции.
A.0,6322;
B.31,61;
C.52,68;
D.158,03;
E.316,06.
Задание 9.
В эксперименте применяется водородный электрод при 25°С в нейтральной среде. Укажите, какое значение отвечает величине потенциала этого электрода.
A.-0,059 В;
B.-0,041 В;
C.-0,41 В;
D.0,059 В;
E.0,41 В.
Задание 10.
В гальваническом элементе протекает реакция (условия стандартные):
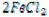 +
+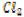 →
→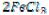
Определите величину ЭДС этого гальванического элемента.
A.-0,59 В;
B.0,29 В;
C.0,59 В;
D.1,06 В;
E.2,13 В.
Задание 11.
В лаборатории имеется пять гальванических элементов. Определите, при работе какого из них не изменяется масса цинковой пластинки.
A.Zn|ZnSO4|MnSO4|Mg;
B.Cu|CuSO4|ZnSO4|Zn;
C.Ag|Ag2SO4|ZnSO4|Zn;
D.Zn|H2SO4|CuSO4|Cu;
E.Zn|H2SO4|MgSO4|Mg.
36
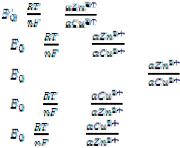
Задание 12.
ЭДС гальванического элемента зависит от стандартной электродвижущей силы и соотношения активностей потенциалопределяющих ионов. Укажите, какое из приведенных уравнений правильно отражает эту зависимость?
A. |
E= |
- |
|
·ln |
; |
|
B. |
E = |
|
+ |
· ln |
; |
|
C. |
E = |
|
– R· T· n· F· ln |
; |
||
D. |
E = |
|
– |
· ln |
; |
|
E. |
E = |
· |
|
· ln |
. |
|
Эталоны ответов: |
|
|
|
|
1 – B; |
6 – D; |
11 |
– E; |
|
2 |
– D; |
7 – B; |
12 |
– A. |
3 |
– E; |
8 – B; |
|
|
4 |
– A; |
9 – C; |
|
|
5 |
– E; |
10 – C; |
|
|
37
РОЛЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ В ПРОЦЕССАХ ЖИЗНЕДЕЯТЕЛЬНОСТИ.
АКТУАЛЬНОСТЬ ТЕМЫ:
Окислительно-восстановительные реакции относят к самым распространённым химическим процессам в природе. Они лежат в основе круговорота химических элементов в природе. ОВР-основа жизнедеятельности, так как с ними связаны обмен веществ и дыхание, гниение и брожение органических соединений, усвоение углекислого газа зелёными листьями растений. (Фотосинтез). Процессы окисления-восстановления – это источник энергии для дыхания, за счёт чего организм получает почти 99 % всей энергии. Они лежат в основе синтеза жизненно необходимых органических соединений
– незаменимых аминокислот, углеводов, жирных кислот, гормонов. Современная теория окислительно – восстановительной реакции базируется
на электронных представлениях, то есть это процессы, связанные с переносом электронов от одних атомов к другим ОВР – многочисленны и многообразны. Задачи производственной деятельности человека решаются на основе сознательного использования реакций окисления-восстановления. Это получение металлов из руд, производство минеральных кислот, лекарственных препаратов. В основе методик проведения анализов в медико-биологических лабораториях, таких как определение содержание сахара в крови, аскорбиновой кислоты, окисляемости воды, проверка качества дезинфицирующих средств и др. – лежат ОВР.
Окислительно-восстановительные реакции используют в аналитической химии для качественного и количественного определения химических элементов и их соединений. На использовании ОВР базируются такие методы оксидиметрия, как перманганатометрия, иодометрия и др.
ЦЕЛИ ОБУЧЕНИЯ:
ОБЩАЯ ЦЕЛЬ.
Уметь трактовать суть основных понятий окислительно-восстановительных процессов, их типов и методов решения.
КОНКРЕТНЫЕ ЦЕЛИ:
УМЕТЬ:
1.Трактовать понятия: степень окисления элементов, окислители восстановители, основные положения электронной теории ОВР.
2.Трактовать изменение окислительно-восстановительных свойств по периодам и группам периодической системы Д.И.Менделеева.
3.Трактовать правила составления ОВР методом электронного баланса.
4.Прогнозировать влияние среды на протекание ОВР и образование продуктов.
38
