
1 курс 1 семестр / Химия / medchem_SAM_med_rus
.pdf
Задача 6.
Серебра сульфат – малорастворимое соединение. Запишите уравнение диссоциации данной соли, выражение произведения растворимости и формулу для расчета концентрации насыщенного раствора.
Задача 7.
При проведении лабораторной работы, смешали 10мл раствора натрия хлорида с концентрацией 2,7·10-4 моль/л и 10мл раствора серебра нитрата с концентрацией 2,7·10-5 моль/л. Определите возможность образования осадка, ответ обоснуйте расчетом.
Эталон решения.
При смешивании растворов натрия хлорида и серебра нитрата возможно протекание реакции с образования труднорастворимой соли:
NaCl + AgNO3 ↔ AgCl + NaNO3
Полученный в результате реакции серебра нитрат диссоциирует по уравнению:
AgCl ↔ Ag+ + Cl-
Гетерогенное равновесие, которое устанавливается в растворе, описывается константой равновесия – величиной произведения растворимости, которое имеет вид:
Условием образования осадка является соотношение: ПК > ПР.
Для определения возможности образования осадка серебра хлорида, вопервых, необходимо рассчитать концентрации ионов в растворе при смешивании, во-вторых, рассчитать произведение концентраций, в-третьих, сравнить полученную величину ПК со справочной величиной ПР.
1.Концентрации ионов Ag+ и Clпосле смешивания равны:
2.Произведение концентраций равно:
3.Произведение растворимости хлорида серебра имеет значение:
Исходя из проведенных расчетов:
Таким образом, при смешивании заданных количеств растворов NaCl и AgNO3 с заданными концентрациями, в исследуемой системе наблюдается образование осадка AgCl.
19

Задача 8.
К раствору, содержащему катионы Ca2+ и Mg2+, медленно добавляли разбавленный раствор фосфорной кислоты. Укажите осадок, который будет
образовываться в первую очередь ( ;
; ), ответ подтвердите расчетами.
), ответ подтвердите расчетами.
Задача 9.
Гидроксиаппатит является структурным компонентом костной ткани,
образование которого можно записать:
5Ca2+ + 3HPO42- + H2O ↔ Ca5(OH)(PO4)3 + 4H+
Определите возможность образования гидроксиаппатита
( |
) при условии, что в результате патологического |
состояния концентрация кальция изменилась и составляет 1,5·10-3 моль/л, а концентрация гидрофосфата остается постоянной и составляет 2,9·10-4 моль/л. Ответ обоснуйте.
Задача 10.
Образование гидроксиаппатиту протекает в плазме крови по приведенной реакции:
5CaHPO4 + 6OH- ↔ Ca5(OH)(PO4)3 + 2PO43- + 5H2O
Укажите, как изменится состояние гетерогенного равновесия: раствор ↔ гидроксиаппатит, если кислотность плазмы крови уменьшится (рН < 7,35).
НАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
С целью определения биохимических условий образования камней в почках, приготовили смесь, которая содержит 1г кальция карбоната в 100мл воды. При этом наблюдается лишь частичное растворение соли. Укажите тип раствора, в полученной гетерогенной системе:
A.Насыщенный;
B.Ненасыщенный;
C.Пересыщенный;
D.Разбавленный;
E.Концентрированный.
Задание 2.
Для качественного определения содержания катионов магния в плазме крови, необходимо провести реакцию осаждения. Укажите реагент, который может быть для этого использован:
A.NaCl;
B.NaNO3;
C.Na2SO4;
20

D.Na2CO3;
E.CH3COONa.
Задание 3.
Для профилактики заболеваний кариеса, врачи рекомендуют использование зубных паст, содержащих примерно 0,3 мас.% натрия фторида, способствующего образованию фтороаппатита: Ca5F(PO4)3. Укажите выражение произведения растворимости для данного соединения:
A.ПР = [Ca2+]·[F-]·[PO43-];
B.ПР = [Ca2+]5·[F-]·[PO43-]3;
C.ПР = 5[Ca2+]·[F-]·3[PO43-];
D.ПР = [Ca2+]5·[F(PO4)4-]3;
E.ПР = [CaF+]5·[PO43-]3.
Задание 4.
При проведении биохимических исследований использовали раствор магния карбоната ( ). Рассчитайте массу MgCO3 (г), которая содержится в 750мл насыщенного раствора. Укажите правильный ответ:
). Рассчитайте массу MgCO3 (г), которая содержится в 750мл насыщенного раствора. Укажите правильный ответ:
A.0,09;
B.0,19;
C.0,29;
D.0,39;
E.0,49.
Задание 5.
Для определения влияния концентрации ионов кальция на биохимические процессы, необходимо приготовить насыщенный раствор труднорастворимой кальциевой соли. Используя величины произведения растворимости, укажите соединение с наибольшей растворимостью:
A. 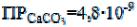 ;
;
B.  ;
;
C.  ;
;
D.  ;
;
E.  .
.
Задание 6.
При использовании препаратов йода, слезными железами выделяются йодид-ионы. Для лечения коньюктивита используют 2% растворы серебра нитрата (ρ≈1 г/мл). Рассчитайте концентрацию йодид-ионов (моль/л), при
21

которой возникает возможность образования кристаллов серебра йодида ( ), который имеет прижигающее действие и укажите правильный ответ:
), который имеет прижигающее действие и укажите правильный ответ:
A.1,1·10-20;
B.9,3·10-18;
C.1,1·10-18;
D.9,3·10-16;
E.1,1·10-16.
Задание 7.
Ненасыщенный раствор гипсовой воды (CaSO4), приготовленный для аналитических исследований, имеет концентрацию 5·10-3 моль/л. Определите возможность образования осадка при добавлении 0,02 моль/л раствора (CaCl2) к раствору гипсовой воды. Укажите правильный ответ:
A.Ca2+]·[SO42-]> , образуется осадок;
, образуется осадок;
B.[Ca2+]·[SO42-]<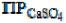 , образуется осадок;
, образуется осадок;
C.[Ca2+]·[SO42-]>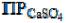 , осадок не образуется;
, осадок не образуется;
D.[Ca2+]·[SO42-]< , осадок не образуется;
, осадок не образуется;
E.[Ca2+]·[SO42-]= , осадок не образуется.
, осадок не образуется.
Задание 8.
При отравлении солями ртути (II), в организме образуются нерастворимые соли HgS (ПРHgS=3·10-54). Рассмотрите возможность выведения токсичных ионов из организма при использовании раствора KSCN, который образует комплексный ион [Hg(SCN)4]2- (Кн=1·10-22). Обоснуйте и укажите правильный ответ:
A.ПРHgS>Кн, осадок растворяется;
B.ПРHgS<Кн, осадок растворяется;
C.ПРHgS<Кн, осадок не растворяется;
D.ПРHgS>Кн осадок не растворяется;
E.ПРHgS=Кн, осадок не растворяется.
Задание 9.
Образование фтороаппатита зубной эмали происходит из гидроксиаппатита по схеме:
Ca5(OH)(PO4)3 + F- ↔ Ca5F(PO4)3 + OH-
Укажите, в каком направлении смещается равновесие, при использовании зубной пасты с солями фторид-ионов:
A.Образование Ca5F(PO4)3;
B.Растворение Ca5F(PO4)3;
C.Образование Ca5(OH)(PO4)3;
22
D.Увеличение концентрации F-;
E.Равновесие не смещается.
Задание 10.
При избытке солей кальция в организме (патологические состояния), в результате образования малорастворимых солей, наблюдается формирование камней в почках. Укажите возможную химическую природу данных соединений:
A.Хлориды;
B.Нитраты;
C.Гидросульфиды;
D.Ацетаты;
E.Карбонаты.
Эталоны ответов: |
|
|
1 |
– A; |
6 – D; |
2 |
– D; |
7 – A; |
3 – B; |
8 – B; |
|
4 – C; |
9 – A; |
|
5 |
– E; |
10 – E. |
23
РОЛЬ ЭЛЕКТРОХИМИЧЕСКИХ ЯВЛЕНИЙ В БИОЛОГИЧЕСКИХ ПРОЦЕССАХ. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ И МЕХАНИЗМ ИХ ВОЗНИКНОВЕНИЯ.
АКТУАЛЬНОСТЬ ТЕМЫ:
Все реакции, происходящие в живом организме, сопровождаются электрохимическими явлениями. К ним относится три типа биоэлектрических потенциалов (диффузионные, мембранные и фазовые), а также окислительновосстановительные потенциалы, которые обусловлены межмолекулярным переносом электронов и образованием энергии, необходимой для жизнедеятельности организма. К числу окислительно-восстановительных систем относятся такие системы в крови и тканях, как гемм/гематин и цитохромы, аскорбиновая кислота (витамин С), система глутатиона, цистинцистеина, янтарной и фумаровой кислот и др. Каждое звено цепи данных окислительно-восстановительных процессов характеризуется определенным числовым значением окислительно-восстановительного потенциала, величина которого указывает на возможность протекания реакции на конкретном участке цепи. Зная возможность протекания и направления окислительновосстановительного процесса, можно правильно подобрать среду и условия для благоприятного протекания реакции. Данный факт широко применяется в медикобиологических исследованиях, физиотерапии (электрофорез), кардиологии (ЭКГ), неврологии (ЭЭГ), стоматологии (подбор материалов при протезировании), клинико-диагностических лабораториях (определение ионного состава и рН биологических жидкостей), фармакологии и фармацевтической химии (качественный и количественный анализ
фармацевтических |
препаратов, изучение механизма лечебного действия |
фармацевтических |
препаратов). |
ЦЕЛИ ОБУЧЕНИЯ:
ОБЩАЯ ЦЕЛЬ:
Уметь интерпретировать роль электрохимических явлений в биологических процессах, а также понятия электродных потенциалов и механизм их возникновения.
КОНКРЕТНЫЕ ЦЕЛИ
УМЕТЬ:
1.Трактовать понятия электропроводимости растворов электролитов, удельной и эквивалентной проводимости.
2.Интерпретировать понятие электродных потенциалов металлов, факторов, влияющих на их величину, уравнение Нернста для электродного потенциала, а также гальванического элемента, его электродвижущей силе (ЭДС) применительно к определению направления окислительновосстановительных реакций (ОВР).
24
3.Трактовать классификацию электродов, свойства стандартного (нормального) водородного электрода, применительно к их использованию в биологических и медицинских исследованиях.
4.Интерпретировать сущность потенциометрического метода определения рН применительно к медико-биологическим исследованиям.
5.Интерпретировать понятия о биопотенциалах, диффузионных и мембранных потенциалах, исходя из их биохимической роли и медикобиологического значения.
СОДЕРЖАНИЕ ОБУЧЕНИЯ:
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ:
1.Электропроводимость растворов электролитов, удельная и эквивалентная проводимости.
2.Электродные потенциалы металлов:
–механизм возникновения;
–факторы, влияющие на их величину;
–нормальный (стандартный) потенциал водородного электрода, уравнение Нернста для вычисления электродного потенциала;
–гальванический элемент, его электродвижущая сила (ЭДС);
–определение направления ОВР по разности стандартных электродных потенциалов.
3.Классификация электродов и их применение в биологии и медицине:
–электроды І рода; стандартный водородный электрод;
–электроды ІІ рода;
–ионообменные электроды;
–окислительно-восстановительные электроды.
4.Потенциометрический метод определения рН среды, его характеристика, преимущества, применение в медицинских и биологических исследованиях.
5.Понятие о биоэлектрических потенциалах. Диффузионные и мембранные потенциалы, их биохимическая роль и медицинское значение.
2. ОСНОВНЫЕ ТЕРМИНЫ И ИХ ОПРЕДЕЛЕНИЕ Электрохимия – раздел физической химии, изучающий превращение
химической энергии в электрическую и наоборот.
Электропроводимость – способность веществ проводить электрический ток.
В металлах (проводниках первого рода) электропроводимость обеспечивают электроны, в растворах электролитов (проводниках второго рода) – ионы.
Электропроводимость растворов электролитов L выражается как величина,
обратная электрическому сопротивлению:
L = 1/R (Ом-1).
Для растворов электролитов различают 2 понятия электропроводимости:
25
1. Удельная электропроводимость (κ) - это проводимость такого количества электролита, которое помещают между электродами с площадью 1 м2 и находящимися на расстоянии 1 м. Это величина, обратная удельному сопротивлению:
κ= 1/ρ (См/м) или (Ом-1·м-1).
2.Эквивалентная (молярная) электропроводимость (λ) – это проводимость слоя раствора электролита, содержащего один грамм-эквивалент растворенного вещества и помещенного между электродами, отстоящими один от другого на расстоянии 1 м.
Между удельной и эквивалентной электропроводимостью существуют следующее соотношение:
λ = κ/С или λ= κV
где V=1/С – величина, называемая разбавлением.
Биологические системы обладают различной степенью электропроводимости. Поэтому метод определения электропроводимости биологических систем широко применяется для решения диагностических и исследовательских задач.
Электрод – проводник (металл), погруженный в раствор электролита. Электродный потенциал – разность потенциалов (скачок потенциала),
возникающая на границе раздела електрод – раствор. Электродный потенциал возникает в результате образования двойного электрического слоя (ДЭС) на границе металл-раствор между точками, лежащими на поверхности метала, и точками, находящимися в растворе возле поверхности металла.
Электродвижущая сила (ЭДС) возникает в системе двух электродов, находящихся соответственно в растворах своих солей. ЭДС равна разности двух электродных потенциалов:
Е = е+ - е-.
Нормальный (стандартный) водородный электрод – полуэлемент,
состоящий из черненной платиновой пластинки, насыщенной газообразным водородом при давлении 1атм, погруженной в раствор кислоты, активность ионов Н+ в котором равна 1 моль/л при температуре 298К. Нормальный водородный электрод имеет формулу:
Pt(H2)|H+ (PH2 =101,3 кПа; аН+=1).
Стандартные электродные потенциалы – потенциалы электродов,
определяемые по условной водородной шкале, точкой отсчета в которой является стандартный водородный электрод. Потенциал стандартного водородного электрода условно принят равным нулю.
Гальванический элемент – система, в которой химическая энергия окислительно-восстановительного процесса превращается в электрическую энергию.
Примером гальванического элемента является элемент Якоби-Даниэля, состоящий из цинкового и медного электродов, опущенных в растворы солей этих металлов. Электроны накапливаются на цинковом электроде, и он
26
заряжается отрицательно. По внешней цепи электроны переходят на медный (положительный) электрод. Возникающий в цепи поток электронов – электрический ток – может быть использован для совершения работы.
Электродвижущая сила (ЭДС) гальванического элемента –
максимальная разница значений электродных потенциалов положительного и отрицательного электродов.
Уравнение Нернста для ЭДС гальванического элемента:
Е=Е0 - RT/nF·ln(a Zn2+/ аСu2+),
где Е0 – стандартная ЭДС элемента; R - газовая постоянная, 8,314 Дж/(моль•К); Т- температура,К; F - число Фарадея (9,65•104 Кл/моль; n- число электронов, которое отдает атом металла; a Zn2+ - активность ионов цинка в растворе; а Сu2+- активность ионов меди в растворе.
Уравнение Нернста позволяет, зная величину стандартной ЭДС и активность катионов в растворе, определить величину ЭДС гальванического элемента.
Электрод определения – электрод, потенциал которого зависит от концентрации водородных ионов в растворе , т.е. связан с рН раствора. К электродам определения относятся стеклянный и хингидронный электроды.
Электрод сравнения – электрод с известным значением электродного потенциала. Состоит из определенного металла и раствора его соли известной концентрации. Служит стандартом для сравнения с ним других электродов с неизвестными потенциалами. К электродам сравнения относятся нормальный водородный электрод, каломельные электроды, хлорсеребряный электрод.
Электроды первого рода - металлические электроды, находящиеся в растворе своих ионов: Ме|Меn+ (водородный. серебряный, медный и др.). Электроды первого рода используют как электроды определения.
Электроды второго рода – полуэлементы, состоящие из металла, покрытого слоем своей малорастворимой соли и погруженного в раствор хорошо растворимого соединения с тем же анионом: Ме, МеА|An-. К электродам второго рода относятся каломельный, хлорсеребряный электроды.
Ионообменные электроды – состоят из ионита и раствора, на границе раздела которых возникает скачок потенциала. Важным представителем ионообменных электродов является стеклянный электрод - наиболее распространённый электрод при измерении рН растворов. К ионообменным электродам относятся также ионоселективные электроды, с помощью которых определяют содержание в растворе таких ионов, как Na+, K+, Ca2+, NO3-,Cl- и др. Модифицированные ионоселективные электроды (ферментные, бактериальные
27
и иммуноэлектроды) – биологические сенсоры, с помощью которых определяют концентрации органических веществ.
Окислительно-восстановительные электроды – электроды из инертного металла (платины, иридия), погруженные в раствор, содержащий окисленную и восстановленную формы вещества. При этом реакции окисления или восстановления протекают в растворе без участия вещества электрода. Возникающий скачок потенциала характеризует окислительную способность раствора.
Биоэлектропотенциалы – показатели биологической активности , которые определяются разностью электрических потенциалов между двумя точками живой ткани (клетки). В зависимости от характера электрохимических процессов биоэлектропотенциалы делятся на диффузионные,мембранные,фазовые.
Диффузионный потенциал – скачок потенциала на границе между неодинаковыми по составу или по концентрации растворами вследствие разной скорости диффузии аниона и катиона. Диффузионные потенциалы могут возникать ,например, при повреждении оболочек клеток.
Мембранный потенциал – диффузионный потенциал, возникающий на границе растворов разных концентраций, разделенных специальной мембраной, проницаемой только для ионов какого-либо одного знака. В тканях растительных и животных организмов мембранные потенциалы обусловлены химической и морфологической неоднородностью внутриклеточного
содержимого.
28
