
1 курс 1 семестр / Химия / medchem_SAM_med_rus
.pdfНАБОР ЗАДАНИЙ ДЛЯ ПРОВЕРКИ ДОСТИЖЕНИЯ КОНКРЕТНЫХ ЦЕЛЕЙ ОБУЧЕНИЯ
Задание 1.
В водных растворах солей протекают их обменные реакции с водой, при этом возможно образование слабого электролита. Укажите тип данных химических реакций:
A.Нейтрализации;
B.Гидролиза;
C.ОРВ;
D.Термического разложения;
E.Осаждения.
Задание 2.
Возможны три случая гидролиза в зависимости от типа соли. Укажите реакцию среды водного раствора соли КСN:
A.рН > 7;
B.рН < 7;
C.рН = 7;
D.рН > 14;
E.рН = 1.
Задание 3.
В зависимости от типа соли реакция среды может различной. Укажите это для соли NH4Cl:
A.pH = 7;
B.pH = 0;
C.pH = 14;
D.pH < 7;
E.pH > 7.
Задание 4.
При гидролизе некоторой соли реакция среды оказалась кислой. Укажите эту соль:
A.КСN;
B.CH3COONa;
C.CH3COOK;
D.NaNO3;
E.FeCl3.
Задание 5.
Лаборант проводил опыт по гидролизу некоторой соли, и реакция среды оказалась щелочной. Укажите эту соль:
A.CH3COONa;
B.FeCl3;
9
C.NH4Cl;
D.NaNO3;
E.Al(CH3COO)3.
Задание 6.
Некоторые соли гидролизу не подвергаются. Укажите эту соль:
A.NH4Cl;
B.Al(CH3COO)3;
C.NaCl;
D.КСN;
E.Fe(NO3)3.
Задание 7.
В зависимости от того, какая соль подвергается гидролизу, константа гидролиза имеет соответствующее выражение. Укажите это выражение для соли NH4Cl.
A.Kг = Kw/ Kb
B.Kг = Kw/ Ka
C.Kw = [H+]∙[OH–]
D.Kг = K∙[H2O]
E.К = Ka ∙ Kb
Задание 8.
Константа гидролиза соли зависит от ряда факторов. Укажите один из них.
A.Природа соли;
B.Энергия активации;
C.Давление;
D.Объем раствора;
E.Катализатор.
Задание 9.
Для количественной характеристики процесса гидролиза используют значение степени гидролиза. Укажите, от какого фактора она зависит:
A.Температура;
B.Давления;
C.Катализатора;
D.Энергии активации;
E.Объем раствора.
Задание 10.
Гидролиз соли имеет количественные характеристики. Укажите одну из них:
A.Энергия активации;
B.Степень гидролиза;
C.Константа равновесия;
10
D.Коэффициент активности;
E.Ступень гидролиза.
Задание 11.
Гидролиз солей сурьмы и висмута относится к особам случаям гидролиза солей. Какая соль образуется при гидролизе хлорида висмута (ІІІ)?
A.ВіOCl;
B.ВіОСl2;
C.Ві2ОСl;
D.SbOCl;
E.SbOCl2.
Задание 12.
Для роста и нормального функционирования всем живым организмам необходима энергия. Укажите соединение, которое дает эту энергию.
A.Фосфорная кислота;
B.Фенол;
C.Аденозинтрифосфорная кислота;
D.Холевая кислота;
E.Аденин.
Эталоны ответов. |
|
|
|
|
1 – B; |
6 – C; |
11 |
– A |
|
2 |
– A; |
7 – A; |
12 |
– C. |
3 |
– D; |
8 – A; |
|
|
4 |
– E; |
9 – A; |
|
|
5 |
– A; |
10 – B; |
|
|
11
РАВНОВЕСИЕ В ГЕТЕРОГЕННЫХ СИСТЕМАХ. ОБРАЗОВАНИЕ И РАСТВОРЕНИЕ ОСАДКОВ. ПР.
АКТУАЛЬНОСТЬ ТЕМЫ:
Большое количество химических реакций, протекающих в организме человека, происходят в гетерогенных системах, в которых компоненты химической реакции находятся в разных фазах. Данные системы характеризуются наличием динамического равновесия между твердой фазой и ионами, находящимися в растворе.
К таким процессам в первую очередь следует отнести процесс образования костной ткани, основным компонентом которой является гидроксиаппатит Ca5(OH)(PO4)3. Образование данного неорганического соединения происходит в плазме крови за счет установления равновесия между концентрациями катионов кальция, фосфат-ионов и кислотности среды, обеспечивающейся буферными растворами. Нарушение химического равновесия между компонентами данной гетерогенной системы приводит к развитию разнообразных патологических состояний. Так, при уменьшении содержания Са2+, происходит постепенное растворение гидроксиаппатита, которое приводит к размягчению костной и зубной ткани, что наблюдается, например, у беременных женщин или космонавтов. Обратные процессы – образование труднорастворимых соединений – наблюдаются при увеличении концентрации ионов кальция, к ним относятся, например, образование камней в почках (ураты, фосфаты, оксалаты кальция), кальциноз кровеносных сосудов (карбонаты кальция) и др.
Образование малорастворимых солей катионов тяжелых и d-элементов является основой медикаментозного лечения токсических отравлениях солями ртути, кадмия, свинца, олова и др. При этом в качестве противоядия используют органические соединения, содержащие тиольные группы (-SH), которые способны прочно связывать катионы металлов с образованием нерастворимых соединений, тем самым предотвращая их всасывание в кишечном тракте и попадание в кровеносную систему.
Таким образом, понимание процессов гетерогенного равновесия в организме и его взаимосвязь с другими видами процессов в растворах, играет важную роль в формировании целостного подхода к рассмотрению как общего гомеостаза организма, так и отдельных органов и тканей.
ЦЕЛИ ОБУЧЕНИЯ:
ОБЩАЯ ЦЕЛЬ:
Уметь интерпретировать процессы осаждения, растворения и условия их протекания, а также роль гетерогенного равновесия в биологических системах.
12
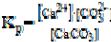
КОНКРЕТНЫЕ ЦЕЛИ
УМЕТЬ:
1.Интерпретировать процессы осаждения и растворения.
2.Трактовать понятие произведения растворимости.
3.Трактовать условия образования и растворения осадков.
4.Интерпретировать роль гетерогенного равновесия в физиологических процессах.
СОДЕРЖАНИЕ ОБУЧЕНИЯ:
1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ:
1.Реакции осаждения и растворения.
2.Произведение растворимости.
3.Условия выпадения и растворения осадков.
4.Роль гетерогенного равновесия в общем гомеостазе организма.
2. ОСНОВНЫЕ ТЕРМИНЫ И ИХ ОПРЕДЕЛЕНИЯ:
Процесс растворения твердого вещества в водном растворе начинается с ориентации молекул воды относительно ионов поверхностного слоя кристаллической решетки. При этом молекулы воды располагаются таким образом, что возникающее диполь-ионное взаимодействие приводит к отталкиванию разноименных ионов в решетке и влечет за собой переход их в водный раствор в сольватном состоянии.
Одновременно с процессом растворения происходит обратный процесс – осаждение, за счет электростатического взаимодействия ионов в растворе и на поверхности кристаллической решетки либо за счет разрушения сольватной оболочки ионов.
Таким образом, в водном растворе устанавливается равновесие между твердой фазой и раствором, то есть образуется равновесная гетерогенная система – неоднородная система, компоненты которой находятся в разных фазах (имеют различные физические и химические свойства) и разделены между собой границей раздела фаз, при переходе через которую свойства резко изменяются.
Полученная система представляет собой насыщенный раствор, в котором ионы в растворе и в составе твердой фазы находятся в динамическом равновесии.
Равновесие, которое устанавливается между раствором и твердой фазой описывается законом действия масс. Например, в насыщенном растворе карбоната кальция устанавливается равновесие:
СаСО3 (твердая фаза) ↔ Ca2+ (раствор)
Константа равновесия имеет вид: |
при условии, что |
концентрация вещества в осадке практически не меняется, то есть является постоянной, тогда произведение Kp·[CaCO3] также является константой, которая для гетерогенных систем называется произведение растворимости и обозначается ПР:
13
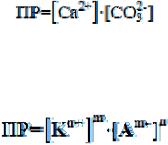
В общем виде диссоциацию малорастворимого электролита KmAn можно
записать:
KmAn (тв.) ↔ mKn+ (р.) + nAm- (р.)
произведение растворимости равно:
Таким образом, в насыщенном растворе малорастворимого соединения произведение равновесных концентраций его ионов в степенях, равных стехиометрическим коэффициентам при данной температуре является величиной постоянной (ПР).
Произведение растворимости определяет растворимость вещества (S) – концентрация в насыщенном растворе (моль/л) и позволяет рассчитать коэффициент растворимости – максимальную массу вещества, которая может быть растворена в 100г. растворителя.
Растворимость вещества определяется рядом факторов:
−природой растворителя;
−природой растворенного вещества (типом кристаллической решетки твердого вещества);
−температурой;
−наличием ионов электролита.
Так как насыщенный раствор является равновесным, то смещение равновесия в гетерогенной системе, которое приводит к образованию или растворению осадка, осуществляется по принципу Ле Шателье.
При увеличении концентрации ионов в насыщенном растворе происходит образование пересыщенного раствора, являющегося нестабильной системой, в которой со временем происходит образование осадка. Если обозначить произведение молярных концентраций как ПК, то для образования осадка необходимым является условие:
ПК > ПР
Например, в равновесной системе:
СаСО3 (твердая фаза) ↔ Ca2+ (раствор) + CO32- (раствор)
образование осадка наблюдается при увеличении концентрации ионов кальция или карбонат-анионов, при этом происходит смещение равновесия в направлении образования твердой фазы.
Условием растворения осадка является уменьшение концентрации ионов в насыщенной системе, которое приводит к образованию ненасыщенного раствора, т.е. выполняется условие:
ПК < ПР
Таким образом, в рассматриваемой равновесной системе, растворение осадка возможно при условии если один из ионов Са2+ или СО32- образует малорастворимое соединение, слабый электролит, комплексный ион или участвует в окисно-восстановительной реакции, то есть наблюдается смещение равновесия в сторону растворения твердой фазы.
14
Одним из факторов, определяющим растворения осадка является температура, например, при нагревании раствора – растворимость увеличивается. Таким образом, изменение температуры приводит к образованию или растворения осадка, а также определяет величину ПР как константу равновесия процесса перехода твердой фазы в раствор.
15
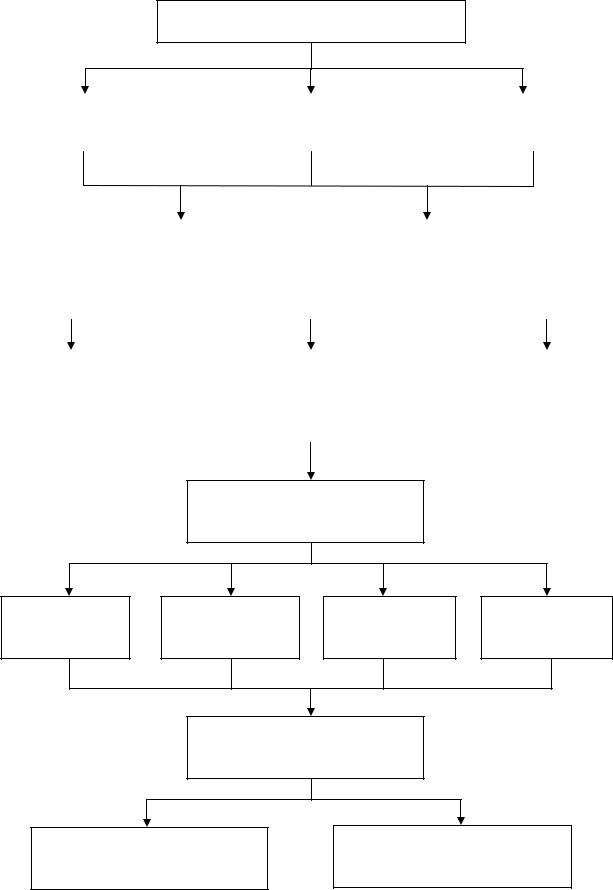
3. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ:
ГЕТЕРОГЕННОЕ РАВНОВЕСИЕ
Насыщенный |
|
Ненасыщенный |
|
Пересыщенный |
раствор |
|
раствор |
|
раствор |
|
|
|
|
|
|
Процесс |
|
Процесс |
|
||
|
растворения |
|
осаждения |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Коэффициент |
|
Константа |
|
Произведение |
|
||||
равновесия |
|
растворимости |
|
растворимости |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Условия образования и растворения осадка
Образование |
|
|
|
комплексов |
Концентрация |
Кислотность |
Температура |
|
Роль гетерогенного равновесия в гомеостазе
Образование гидрокси- и фтороаппатита
Образование камней в почках, кальциноз
16
4. ИСТОЧНИКИ ИНФОРМАЦИИ: Основная литература:
1.Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця:
Нова книга, 2006. – С. 176-184.
2.Медицинская химия: учебник. Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. – К.: Медицина, 2008. – С. 179-189.
Дополнительная литература:
3.Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія.
Підручник. – Вінниця: Нова книга, 2003. – С. 161-169, 192-194.
4.Ахметов Н.С. Общая и неорганическая химия. Учебник для ВУЗов. – М.: Высшая школа, изд. центр «Академия», 2001. – С. 210-212.
ОРИЕНТИРОВАННАЯ ОСНОВА ДЕЯТЕЛЬНОСТИ
НАБОР ОБУЧАЮЩИХ ЗАДАЧ
Задача 1.
При приготовлении раствора натрия хлорида, с целью ускорить растворение кристаллического вещества осуществили нагрева до температуры приблизительно 40оС. Исходя из основных термодинамических понятий, укажите необходимость нагревания в данном случае:
Эталон решения.
Процесс растворения связан с разрушением межионных связей в кристалле NaCl и переходом ионов в раствор. При этом ионы в растворе существуют в виде гидратированных форм – заряженных частиц, окруженных строго ориентированными диполями молекул воды.
Таким образом, при растворении происходят процессы, которые связаны с затратами энергии, поэтому введение в систему дополнительной энергии, путем нагревания раствора смещает равновесие процесса растворения:
NaCl (тв.) ↔ Na+ |
(р.) + Cl- |
(р.) |
в сторону образования ионов. |
|
|
Тем не менее, нагревание необходимо осуществлять до незначительной температуры, так как при увеличении температуры растворимость вещества повышается, что в дальнейшем, при охлаждении до комнатной температуры, может привести к образованию пересыщенного раствора, и, как следствие, образованию осадка.
Задача 2.
С целью получения насыщенного раствора кальция гидросульфата, растворили 0,7г кристаллического вещества в 100г воды. Укажите частицы, которые присутствуют в данном растворе.
Эталон решения.
В насыщенном растворе устанавливаются гетерогенные равновесия между
твердой фазой и ионами в растворе:
СаНРО4 (тв.) ↔ Са2+(р.) + НРО42-(р.)
17
Таким образом, данная равновесная система характеризуется наличием частиц: СаНРО4 (тв.); Са2+(р.); НРО42-(р.).
Задача 3.
Коэффициент растворимости CaCl2 при 25оС равен 82,6г. Укажите тип раствора и частицы, которые присутствуют в системе при растворении 41,3г кальция хлорида в 50 мл воды.
Задача 4.
Кальция фторид представляет собой малорастворимое вещество. Напишите уравнение реакции диссоциации данной соединения и выражение произведения растворимости.
Эталон решения.
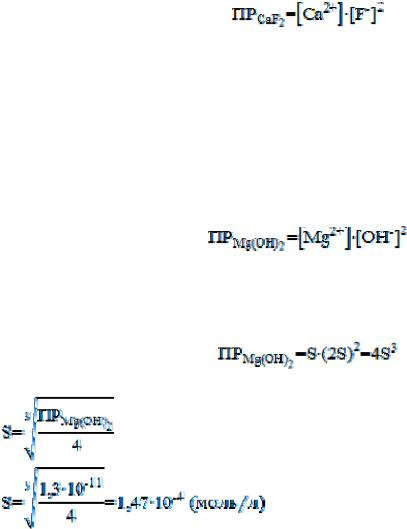
Диссоциация соли может быть записана в виде: CaF2 ↔ Ca2+ + 2F-
Выражение произведения растворимости данного малорастворимого соединения имеет вид:
Задача 5.
Магния гидроксид – труднорастворимое вещество, произведение растворимости которого равно 1,3·10-11. Определите и укажите концентрацию насыщенного раствора Mg(OH)2.
Эталон решения.
Магния гидроксид в растворе диссоциирует по уравнению: Mg(OH)2 ↔ Mg2+ + 2OH-
Произведение растворимости равно:
Обозначим растворимость магния гидроксида как S (моль/л), тогда по уравнению диссоциации, концентрации ионов в растворе соответственно равны: [Mg2+] = S моль/л; [OH-] = 2S моль/л. Таким образом, произведение растворимости равно:
Растворимость или концентрация насыщенного раствора равна:
18
