
Полимеразная цепная реакция
.pdfамплифицировать РНК. Данная проблема решается путем проведения обратной транскрипции: синтеза на матрице РНК комплементарной ей ДНК (кДНК). Для проведения данной реакции используют фермент ретровирусного происхождения: обратную транскриптазу, катализирующий синтез ДНК на матрице РНК.
При проведении обратной транскрипции реакционная смесь должна включать следующие компоненты:
1)Исследуемый материал, содержащий РНК выявляемого вируса
2)Фермент обратная транскриптаза ретровирусного происхождения (обычно вируса лейкоза мышей или миелобластоза птиц).
3)Смесь нуклеотидов
4)Праймеры («рэндом»-праймеры).
Достройка комплементарной цепи ДНК с участием обратной транскриптазы (как и в случае с «обычной» ДНК-полимеразой) требует наличия затравочного праймера. В качестве праймеров, являющихся затравкой для обратной транскриптазы, обычно используются т.н. «рэндом» (случайные)-праймеры. Рэндом-праймеры представляют собой смесь из коротких праймеров длиной 6 нуклеотидных остатков. Нуклеотидная последовательность в рэндом-праймерах является случайной, и в смеси присутствуют все возможные варианты последовательности из 6 нуклеотидов. Такая длина праймера является минимально достаточной для того, чтобы он мог использоваться обратной транскриптазой в качестве затравки для синтеза комплементарной цепи.
Обратная транскрипция обычно проводится при стабильной температуре 37ºС (температурный оптимум для обратной транскриптазы). Рэндом-праймеры связываются с молекулами РНК в реакционной смеси, после чего обратная транскриптаза достраивает комплементарные цепочки ДНК. Рэндом-праймеры могут связываться с любыми содержащимися в реакционной смеси молекулами РНК в любой точке, поэтому обратной транскрипции подвергаются все содержащиеся в реакционной смеси молекулы РНК, причем продуктом реакции могут являться как полноразмерные, так и, гораздо чаще, «укороченные» комплементарные им ДНК.
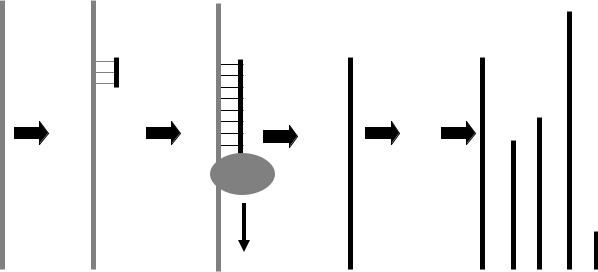
Таким образом, обратная транскрипция с использованием рэндомпраймеров не является специфической, так как обратной транскрипции подвергается вся РНК в реакционной смеси (а не только РНК выявляемого вируса) и, следовательно, подавляющее большинство полученной таким образом кДНК будет балластной (рис.9).
3’ |
3’ |
3’ |
|
|
|
|
|
-рэндом праймер |
|
|
|
|
|
|
ОТ |
|
… |
|
|
|
|
|
|
5’ |
5’ |
5’ |
|
|
|
РНК |
РНК |
РНК |
кДНК |
кДНК |
смесь кДНК |
Рис. 9. Схема реакции обратной транскрипции: присоединение к цепи РНК рэндом-праймера в случайной позиции; достройка комплементарной цепи ДНК с участием обратной транскриптазы (ОТ). Так как точка присоединения рэндом праймера является случайной, в реакции образуются нити ДНК разной длины: от полноразмерных копий до очень коротких фрагментов.
Нередко вместо рэндом-праймеров используют олиготимидиновый праймер из 15-18 нуклеотидов, содержащих тимин. Информационные РНК в клетке на 3’- конце имеют т.н. полиаденильный хвост – последовательность из 15-200 аденинсодержащих нуклеотидов. Аналогичная структура есть в составе РНК большинства вирусов. Олиготимидиновый праймер связывается с полиаденильным хвостом и выполняет роль затравки для обратной транскрипции.
Использование олиготимидинового праймера вместо рэндом-праймера имеет следующие преимущества:
1)Обратной транскрипции не подвергаются клеточные рибосомные и транспортные РНК (которые не имеют полиаденильного хвоста и которые составляют около 99% клеточной РНК). Это позволяет избавиться от значительной части балластной РНК.
2)Образующая кДНК является полноразмерной, так как олиготимидиновый праймер связывается с 3'-концом матричной РНК. При использовании рэндом-праймеров подавляющее большинство полученной кДНК является укороченной со стороны 5'-конца.
Вто же время, не все РНК-содержащие вирусы содержат полиаденильный хвост. Для выявления РНК этих вирусов олиготимидиновый праймер непригоден.
Необходимо отметить, что полученная в результате обратной транскрипции кДНК не идентична матричной РНК, а комплементарна ей. Если исходная РНК была представлена «плюс»-цепью, то продуктом обратной транскрипции будет «минус»-цепь кДНК.
Вбольшинстве случаев выделенную РНК сначала подвергают обратной
транскрипции, после чего полученную смесь, содержащую кДНК, используют для
постановки ПЦР. Нередко в коммерческих тест-системах для ПЦР-диагностики инфекционных заболеваний обратную транскрипцию и ПЦР проводят «в одном флаконе», добавляя в реакционную смесь одновременно компоненты для обеих реакций. В этом случае сначала проводится обратная транскрипция при стабильной температуре (37°С) в течение приблизительно 30 мин., после чего запускаются стандартные температурные циклы ПЦР. Такой вариант более удобен, но отличается меньшей чувствительностью, чем раздельная постановка реакций.
ПЦР «В РЕАЛЬНОМ ВРЕМЕНИ» («real-time»-PCR)
При проведении ПЦР с электрофоретической детекцией выявление накопленных в ходе реакции ампликонов осуществляется уже после завершения реакции. Однако в начале 1990-х исследователи предложили методику регистрации накопления ДНК непосредственно в ходе ПЦР. Первоначально данная методика предназначалось для оценки количества молекул ДНК в реакционной смеси. Технология ПЦР «в реальном времени» получила быстрое развитие, к середине 1990-х появились первые специализированные амплификаторы для данного типа реакции. В настоящее время ПЦР «в реальном времени» практически вытеснила ПЦР с электрофоретической детекцией из лабораторной практики. Связано это с тем, что ПЦР «в реальном времени» имеет ряд преимуществ перед ПЦР с электрофоретической детекцией:
1)ПЦР «в реальном времени» позволяет отслеживать накопление ампликонов непрерывно в течение реакции, что позволяет оценивать эффективность ее протекания. При использовании ПЦР с электрофоретической детекцией результат реакции можно зарегистрировать лишь после ее завершения.
2)Отсутствие этапа электрофоретической детекции. После завершения ПЦР в реакционной смеси содержатся десятки миллионов ампликонов. Электрофорез продуктов ПЦР приводит к распылению ампликонов и создает опасность загрязнения ими исследуемого материала, что приводит к ложноположительным результатам. По этой причине для электрофореза выделяют отдельное помещение, которое стараются отделить от прочих помещений для ПЦР. При использовании ПЦР «в реальном времени» риск загрязнения исследуемого материала ампликонами минимален.
3)Возможность оценки количества молекул НК выявляемого микроорганизма, содержащихся в исследуемом материале (количественная ПЦР).
4)Возможность проведения мультиплексной ПЦР, т.е. выявления нуклеиновой кислоты сразу нескольких возбудителей в одной реакции.
Особенностью ПЦР «в реальном времени» является использование флуоресцирующих красителей (флуорофоров).
Флуорофоры – это вещества, которые способны поглощать свет одной длины волны (обычно это УФ) и испускать свет с другой, большей длиной волны. Излишек энергии при этом рассеивается в виде тепла.
Для проведения ПЦР «в реальном времени» используют специальные детектирующие амплификаторы, которые представляют собой обычные амплификаторы, на которые установлена детектирующая камера, регистрирующая излучение флуорофоров.
Рис. 10. Амплификатор для ПЦР «в реальном времени» (сверху установлена детектирующая камера).
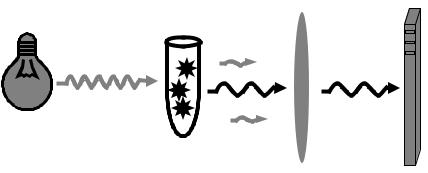
Общий принцип работы детектирующего амплификатора выглядит следующим образом. В детектирующей камере есть галогеновая лампа, которая является источником ультрафиолета. Свет этой лампы падает на пробирку, и флуорофор в реакционной смеси начинает излучать свет другой длины волны, который падает на светочувствительную матрицу, фиксирующую интенсивность излучения. Между матрицей и пробиркой находится светофильтр, который пропускает лишь излучение от флуоресцирующего красителя и «отсекает» излучение с другой длиной волны (рис. 11).
При проведении ПЦР «в реальном времени» в амплификатор вставляются пробирки с реакционной смесью, и далее запускается обычный цикл амплификации. Периодически, обычно на стадии отжига, включается детектирующая камера и оценивает уровень флуоресценции. Таким образом, учет результата ПЦР производится непосредственно в ходе реакции, на каждом цикле амплификации.
Управление детектирующим амплификатором, сбор, анализ и обработка поступающей с прибора информации осуществляется в автоматическом режиме с помощью компьютера.
hv
hv |
hv |
галогеновая |
реакционная |
|
|
|
лампа |
смесь для ПЦР с |
светофильтр |
свето- |
|
(УФ излучатель) |
флуорфорами |
|||
|
чувствительная |
|||
|
|
|
||
|
|
|
матрица |
Рис. 11. Общая схема работы амплификатора с детектирующей камерой (пояснение в тексте).
Выделяют две основные разновидности ПЦР «в реальном времени»:
1)Реакция с использованием интеркалирующих флуоресцирующих красителей
2)Реакция с использованием меченных флуорофорами проб.
ПЦР «в реальном времени» с использованием интеркалирующих флуоресцирующих красителей
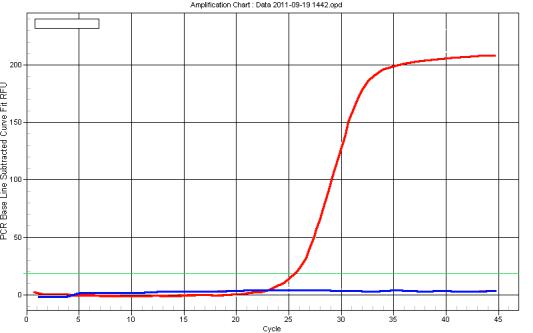
Интеркалирующими называют флуорофоры, которые способны к флуоресценции, будучи включенными в состав двухцепочечной молекулы ДНК. Таким красителем является бромид этидия, используемый для окрашивания ампликонов после электрофореза, однако он подавляет амплификацию. Поэтому в ПЦР «в реальном времени» вместо него используются другие красители, самыми распространенными из которых являются SYBR Gold и SYBR Green. При добавлении этих красителей в смесь для ПЦР по мере накопления ампликонов возрастает интенсивность флуоресценции. В ходе реакции детектирующая камера амплификатора постоянно отслеживает уровень флуоресценции в реакционной смеси. Полученная информация передается на компьютер, который постепенно выстраивает кривую изменения флуоресценции (рисунок). На оси абсцисс графика отложены номера циклов амплификации, на оси ординат – интенсивность флуоресценции. В первых циклах реакции (нижнее плато кривой) количество образующихся ампликонов растет, но оно не достаточно для того, чтобы прибор мог детектировать флуоресценцию. После накопления достаточного числа ампликонов прибор начинает регистрировать флуоресценцию, и ее интенсивность растет в геометрической прогрессии, пропорционально росту числа ампликонов (фаза логарифмического роста). По мере израсходования содержащихся в реакционной смеси праймеров и нуклеотидов, синтез новых ампликонов прекращается, и кривая флуоресценции выходит на верхнее плато. О положительном результате ПЦР свидетельствует превышение порогового уровня
флуоресценции, а также логарифмический характер кривой флуоресценции (рис.
12).
интенсивность флуоресценции
верхнее плато
|
логарифмического |
роста |
фаза |
|
|
|
|
нижнее плато
циклы амплификации
Рис. 12. Кривая флуоресценции, полученная в ходе ПЦР «в реальном времени». Логарифмическая кривая отражает увеличения уровня флуоресценции вследствие накопление ампликонов (положительный результат реакции), горизонтальная кривая – отсутствие увеличения уровня флуоресценции (отрицательный результат).
ПЦР «в реальном времени» с интеркалирующими красителями имеет существенный недостаток: кривая флуоресценции позволяет отслеживать накопление двухцепочечной ДНК, но не дает возможности проконтролировать специфичность реакции, т.е. действительно ли полученные ампликоны являются копиями фрагмента ДНК выявляемого микроорганизма. При использовании ПЦР с электрофоретической детекцией контроль специфичности осуществляется путем оценки размера ампликонов (см. выше). В ПЦР «в реальном времени» с интеркалирующими красителями специфичность реакции определяется по температуре плавления.
Температура плавления
В двухцепочечной ДНК цепи связаны между собой с помощью водородных связей. При низкой температуре практически все молекулы ДНК двухцепочечные, однако при повышении температуры водородные связи теряют прочность, и определенный процент двухцепочечных ДНК распадается на одноцепочечные молекулы. При достижении температуры свыше 90°С остаются только одноцепочечные молекулы ДНК (именно это происходит в ПЦР на этапе денатурации, при температуре 95ºС).
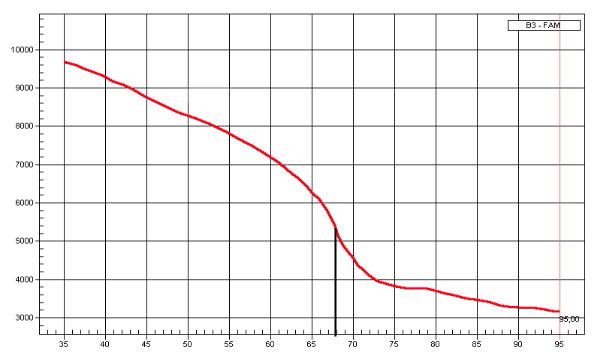
После завершения ПЦР амплификатор постепенно нагревает пробирку с продуктами реакции от 45ºС до 95ºС, одновременно регистрируя уровень флуоресценции. В результате прибор выстраивает кривую плавления, отражающую зависимость уровня флуоресценции от температуры (рис. 13). Так как уровень флуоресценции зависит от количества двухцепочечных ДНК в реакционной смеси, то при повышении температуры этот показатель будет снижаться. Температура, при которой распадаются 50% молекул ДНК (а остальные 50% остаются 2-цепочечными) получила название температуры плавления (если быть более точным, температуре плавления соответствует точка перегиба функции кривой плавления). Для разных молекул ДНК кривая плавления, и, следовательно, температура плавления, различаются. Температура плавления зависит от:
1)Размера молекулы ДНК. В длинных молекулах больше водородных связей и, следовательно, они более «тугоплавкие».
2)От соотношения между G+C/A+T. Гуанин и цитозин образуют 3 водородные связи, а аденин и тимин – 2, поэтому ДНК, обогащенная гуанином и цитозином, имеет более высокую температуру плавления.
интенсивность флуоресценции
Tm
температура
Рис. 13. Кривая флуоресценции. Тm – температура плавления.
Таким образом, оценка температуры плавления позволяет проконтролировать специфичность реакции и дифференцировать ампликоны, полученные из ДНК выявляемого микроорганизма, от побочных продуктов ПЦР. Однако точность такого контроля невысока: по температуре плавления можно дифференцировать лишь значительно различающиеся по размеру и нуклеотидной последовательности молекулы ДНК. По этой причине ПЦР «в реальном времени»
с интеркалирующими красителями используется все реже и постепенно замещается ПЦР с мечеными пробами.
ПЦР «в реальном времени» с меченными флуорофорами пробами
Проба – контрольный праймер, который не является затравочным. Нуклеотидная последовательность пробы подбирается так, чтобы она была комплементарна определенному участку амплифицируемого фрагмента ДНК. К пробе присоединены флуорофор и гаситель флуоресценции.
Флуорофор, входящий в состав пробы, не должен быть интеркалирующим. В настоящее время для изготовления проб используются несколько десятко различных флуорофоров, самые распространенные из которых FAM, HEX, JOE, ROX и другие.
Вобычных условиях флуорофор поглощает ультрафиолет и излучает свет с большей длиной волны. Гаситель флуоресценции – вещество, поглощающее излучение флуорофора и рассеивающее его в виде тепла. Сближение флуорофора
игасителя приводит к подавлению флуоресценции.
Внастоящее время используются несколько типов проб, самыми распространенными из которых являются разрушаемые пробы и пробы- «скорпионы».
Разрушаемая проба представляет собой праймер длиной около 15 оснований, к которому присоединены флуорофор и гаситель. Флуорофор и гаситель сближены друг с другом, поэтому при освещении УФ излучение флуорофора поглощается гасителем (рис. 14).
флуорофор |
гаситель |
контрольный праймер
Рис. 14. Структура праймера-разрушаемой пробы.
На рисунке 15 представлена схема ПЦР с использованием разрушаемой пробы. Ампликон подвергается денатурации, после чего на стадии отжига к образовавшимся одноцепочечным молекулам присоединяются затравочные праймеры; к одной из цепей присоединяется также проба. На стадии элонгации ДНК-полимеразы достраивают комплементарные цепочки ДНК. За счет наличия у ДНК-полимеразы экзонуклеазной активности, она разрушает пробу, что приводит к разобщению флуорофора и гасителя. Высвободившийся флуорофор восстанавливает способность давать излучение.
Таким образом, каждое удвоение ампликона сопровождается высвобождением молекулы флуорофора, и интенсивность флуоресценции нарастает пропорционально росту числа образовавшихся ампликонов. Итоговая
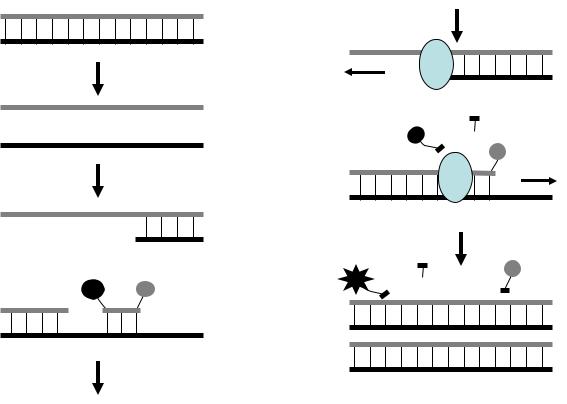
кривая роста флуоресценции выглядит так же, как при ПЦР «в реальном времени» с использованием интеркалирующих красителей.
амплифицируемый фрагмент ДНК
ДНКполимераза
денатурация
Ф
ДНКполимераза |
Г |
|
элонгация и разрушение проб
|
Ф |
Г |
Ф |
|
|
Г разрушаемая |
|
проба
отжиг праймеров и проб
удвоение ДНК и флуоресценция красителя
Рис. 15. Схема ПЦР «в реальном времени» с разрушаемыми пробами. Ф – флуорофор, Г – гаситель флуоресценции.
Проба, помимо того, что выполняет функцию индикатора амплификации, одновременно является контролем специфичности реакции. Нуклеотидная последовательность пробы подбирается так, чтобы она присоединялась в пределах амплифицируемого фрагмента. В случае, если амплификации подвергнется балластная ДНК, разрушения проб происходить не будет, и флуоресценция реакционной смеси не проявится.
Проба-«скорпион» представляет собой сложную структуру, в которой объединены затравочный праймер и контрольный праймер (проба).
Проба-«скорпион» состоит из 2 частей:
1)На 3’-конце пробы находится затравочный праймер.
2)На 5’-конце пробы находится «шпилька» с контрольным праймером.
«Шпилька» – элемент вторичной структуры молекулы одноцепочечной ДНК, который образуется в том случае, если один из участков молекулы оказывается комплементарен другому участку. В этом случае между комплементарными участками ДНК формируются водородные связи, как в двухцепочечной молекуле. «Шпильки» могут образовываться в праймерах, а также в ампликонах, что приводит к снижению эффективности ПЦР, поэтому их формирования обычно стараются избегать. Однако в пробах-«скорпионах» шпилька является функционально значимым элементом, и нуклеотидная последовательность пробы подбирается так, чтобы два ее участка были
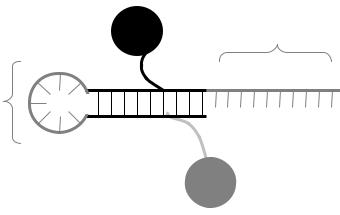
комплементарны друг другу. К одному из этих участков присоединен флуорофор, к другому – гаситель. При образовании между комплементарными участками шпильки флуорофор и гаситель оказываются сближены друг с другом, что проводит к подавлению флуоресценции. Головку «шпильки», расположенную между комплементарными учстками, образует контрольный праймер (рис. 16).
флуорофор
праймер
контрольный праймер
«шпилька»
гаситель
Рис. 16. Структура пробы-«скорпиона».
При проведении ПЦР с использованием пробы-«скропиона» на стадии денатурации происходит разъединение амплифицируемого фрагмента. На стадии отжига к одной из цепей присоединяется затравочный праймер пробы- «скропиона» (для упрощения схемы вторая цепь удалена), после чего на стадии элонгации происходит досторойка комплементарной цепи.
Во время следующего цикла ПЦР на стадии денатурации происходит разъединение цепей получившегося ампликона, при этом проба-«скорпион» оказывается частью вновь синтезированной цепи. Одновременно происходит разъединение шпильки.
Контрольный праймер, образующий головку шпильки, комплементарен определенному участку вновь синтезированной цепи. На стадии отжига происходит связывание контрольного праймера с цепью. Флуорофор и гаситель оказываются разобщены, что устраняет подавление гасителем флуоресценции
(рис. 17).
Таким образом, используемые в ПЦР «в реальном времени» пробы, меченные флуорофорами и гасителями, позволяют отслеживать накопление ампликонов по уровню флуоресценции и одновременно являются контролем специфичности реакции. Флуоресценция пробы возможна лишь после ее связывания с комплементарной нуклеотидной последовательностью в составе ампликона. Контроль с использованием проб обладает значительно более высокой специфичностью, чем приблизительная оценка размера ампликонов с помощью электрофореза или оценка температуры плавления с помощью интеркалирующих красителей.
