
Полимеразная цепная реакция
.pdfТранскрипция
Транскрипция в клетке происходит с участием РНК-полимераз – ферментов, синтезирующих РНК на матрице ДНК. Синтез РНК происходит с кодирующей минус-цепи ДНК. Соответственно, продуктом транскрипции в клетке является плюс-РНК, т.е. информационная РНК, играющая роль матрицы для синтеза белка.
Транскрипция проходит в 3 стадии:
1)Связывание РНК-полимеразы с ДНК, инициация транскрипции.
2)Синтез РНК
3)Прерывание транскрипции.
Связывание РНК-полимеразы с ДНК происходит на специфических
участках (промоторах), имеющих определенную нуклеотидную последовательность. Далее РНК-полимераза расплетает и разъединяет цепи ДНК в точке присоединения и начинает синтез цепи РНК, который происходит по принципу комплементарности. РНК-полимераза, в отличие от ДНК-полимеразы, не нуждается в затравке и может начать синтез РНК «с нуля». На начальной стадии синтеза РНК фермент РНК-полимераза может отсоединиться от ДНК, в этом случае происходит прерывание транскрипции. Вероятность успешного начала транскрипции зависит от нуклеотидной последовательности промотора. На одних промоторах синтезируются лишь 1-2 молекулы РНК за клеточный цикл, на других молекулы РНК синтезируются с интервалом в 1-2 секунды. Таким образом, структура промотора является одним из способов регуляции транскрипции.
В случае, если инициация транскрипции прошла успешно, происходит синтез цепи РНК. РНК-полимераза движется по матричной ДНК в направлении 3’→5’. Синтез цепи РНК завершается в строго определенных точках, т.н. терминаторах, где происходит отделение вновь синтезированной РНК от ДНК и высвобождение РНК-полимеразы.
Репликация РНК
В норме в клетке репликация РНК не происходит. Однако репликация РНК является обязательным элементом цикла репродукции РНК-геномных вирусов. У части РНК-вирусов геном представлен плюс-цепью РНК, т.е. их геномная РНК одновременно является информационной; другие геном других РНК-вирусов представлен минус-цепью, комплементарной информационной РНК. Репликация РНК обеспечивается ферментом РНК-зависимой РНК-полимеразой. Ген, кодирующий данный фермент, находится в вирусном геноме. Особенности функционирования этого фермента различаются у разных групп РНК-вирусов. У некоторых вирусов РНК-полимераза распознает специфическую промоторную последовательность на вирусной РНК и с нее начинает синтез комплементарной цепи, у других вирусов РНК-полимераза использует специальный затравочный белок, который присоединяется к 3’-концу цепи матричной РНК и от которого РНК-полимераза синтезирует дочернюю цепь. После завершения репликации получаются 2 комплементарные цепи РНК. В соответствии с принципом
комплементарности, на матрице плюс-цепи РНК синтезируется минус-цепь и, наоборот, на матрице минус-цепи синтезируется плюс-цепь.
Обратная транскрипция
Цикл репродукции некоторых групп вирусов, самыми известными из которых являются ретровирусы, включает стадию обратной транскрипции, т.е. синтеза ДНК на матрице РНК. Обратная транскрипция осуществляется с участием специализированного фермента РНК-зависимой ДНК-полимеразы (синонимы: обратная транскриптаза и ревертаза), которая должна присутствовать в составе вирусной частицы. Сначала фермент на матрице исходной цепи РНК синтезирует комплементарную цепь ДНК, одновременно разрушая матричную цепь РНК, после чего к полученной цепи ДНК достраивает вторую, комплементарную ей. Движение обратной транскриптазы происходит от 3’- к 5’-концу матричной цепи. Обратная транскриптаза (как и «обычная» ДНК-полимераза) для синтеза комплементарной цепи нуждается в затравке. Ретровирусы решают эту проблему необычно: затравкой для ретровирусной РНК является транспортная РНК инфицированной клетки. Один из участков вирусной РНК комплементарен 5’- концу клеточной тРНК, благодаря чему тРНК связывается с вирусной РНК и выполняет роль затравки. После завершения обратной транскрипции тРНК отделяется от синтезированной цепи ДНК.
МЕХАНИЗМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ
Полимеразная цепная реакция, по сути, представляет собой процесс репликации ДНК, воспроизводимый in vitro в несколько видоизмененной форме. В процессе реакции происходит многократное копирование (синтез ампликонов) определенного участка ДНК возбудителя.
Процесс диагностики с использованием ПЦР включает 3 стадии:
1)Выделение ДНК из исследуемого материала
2)Проведение амплификации, получение ампликонов (собственно ПЦР)
3)Детекция (выявление) полученных ампликонов.
При диагностике инфекционных заболеваний исследуемым материалом обычно является взятый от больного материал (кровь, гной, мокрота, ликвор и т.д.), который может содержать возбудителя или его ДНК.
Выделение ДНК чаще всего осуществляют методом сорбции. Метод включает в себя следующие этапы:
1)Получение суспензии исследуемого материала (при выделении ДНК из плотного материала).
2)Обработка суспензии лизирующим раствором, который вызывает денатурацию содержащихся в материале белков и высвобождение НК. Чаще всего лизирующий раствор содержит гуанидин.
3)Адсорбция нуклеиновой кислоты из суспензии на сорбирующем материале.
4)Отмывка сорбента от остатков лизирующего раствора. Необходимость отмывки обусловлена тем, что гуанидин может вызывать денатурацию ферментов, используемых при амплфикации.
5)Смыв буферным раствором нуклеиновой кислоты с сорбента и удаление сорбента.
Полученный после завершения выделения раствор содержит очищенную от примесей нуклеиновую кислоту. Основная масса выделенной нуклеиновой кислоты будет представлять собой содержавшуюся в исследуемом материале ДНК и РНК пациента, а также сопутствующих микроорганизмов. Однако в массе балластной нуклеиновой кислоты будет содержаться некоторое количество ДНК возбудителя.
После выделения нуклеиновой кислоты из исследуемого материала проводится ПЦР, в ходе которой происходит амплификация определенного участка ДНК возбудителя. ПЦР производится в жидкой фазе в пластиковых пробирках объемом 0,1; 0,2 или 0,5 мл. Реакционная смесь для проведения реакции включает следующие компоненты:
1)Раствор, содержащий выделенную из исследуемого материала нуклеиновую кислоту (в том числе ДНК возбудителя).
2)Смесь нуклеотидов, содержащих аденин, гуанин, цитозин и тимин, являющихся материалом для синтеза новых цепей ДНК.
3)ДНК-полимеразу. Для проведения ПЦР используют термостабильную ДНКполимеразу, способную выдержать нагревание свыше 90°С. Чаще всего используется Taq-полимераза, выделенная от бактерии Thermophilus aquaticus, обитающей в горячих источниках.
4)Праймеры.
Праймер – искусственно синтезированный олигонуклеотид (т.е.
последовательность из небольшого числа нуклеотидов), представляющий собой одноцепочечную ДНК длиной 18-30 оснований. Праймер является затравкой, с которой ДНК-полимераза начинает синтез комплементарной цепи (при репликации ДНК in vivo затравкой является короткая цепочка РНК, синтезируемая праймазой). При проведении ПЦР праймеры являются обязательным компонентом реакционной смеси: присоединяясь к выявляемой ДНК возбудителя, они инициируют ее амплификацию ДНК-полимеразой.
Праймер может присоединиться только к комплементарному ему участку ДНК. Соответственно, нуклеотидная последовательность праймера подбирается так, чтобы он связывался только с ДНК выявляемого микроорганизма и ни с какой иной. Например, если необходимо выявить ДНК вируса гепатита В, то для присоединения праймера подбирается такая нуклеотидная последовательность в составе вирусного генома, которая есть только у вируса гепатита и которой нет больше ни у кого.
ПЦР является циклической реакцией и состоит из 3 чередующихся этапов. Каждый из этапов реакции проводится при определенной температуре,
соответственно, переход к следующему этапу осуществляется за счет изменения температуры реакционной смеси.
Этапы цикла ПЦР (рис. 4):
1)Денатурация. На этом этапе происходит расплетание и разъединение цепей ДНК с образованием одноцепочечных молекул. Осуществляется путем нагревания реакционной смеси до 95°С, т.е. до температуры, достаточной для разрушения водородных связей между гетероциклическими основаниями, удерживающих цепи ДНК вместе. Нагрев реакционной смеси до 95°С объясняет необходимость использования термостабильной ДНКполимеразы: в противном случае при нагревании происходило бы разрушение фермента, и после каждой стадии денатурации приходилось бы добавлять свежую порцию ДНК-полимеразы. Продолжительность этапа –
10-15 сек.
2)Отжиг. На этом этапе происходит присоединение праймеров к комплементарным им участкам матричной ДНК (в данном случае – ДНК выявляемого микроорганизма). Проводится при 50°-65°С в течение 30-50 сек. Участок матричной ДНК выявляемого возбудителя, с которым связывается праймер, должен быть уникальным и не встречаться у других видов живых существ, в противном случае возможна амплификация посторонней ДНК и ложноположительный результат. Напротив, если выбранная для связывания праймера нуклеотидная последовательность, встречается не у всех представителей диагностируемого вида возбудителя, то возможен ложноотрицательный результат реакции.
Помимо корректного подбора нуклеотидной последовательности праймера, для успешного проведения ПЦР необходим подбор оптимальной температуры отжига. Повышение температуры реакционной связи приводит к разрыву водородных связей между комплементарными основаниями и, соответственно, препятствует связыванию праймера с матричной ДНК, что приводит к снижению чувствительности реакции. Снижение температуры, напротив, облегчает отжиг, однако при этом появляется риск неспецифического связывания праймера с не полностью комплементарными участками ДНК. Вследствие этого возможна амплификация участков балластной ДНК (не принадлежащей выявляемому микроорганизму) и, соответственно, потеря специфичности реакции. Температура отжига праймеров зависит от количества водородных связей, которые они образуют с комплементарной ДНК и, соответственно, определяется:
-размером праймера;
-соотношением G+C/A+T в составе праймера.
Праймер, состоящий из большого числа нуклеотидов, обычно имеет более высокую температуру отжига, так как он образует большее количество водородных связей с комплементарным участком ДНК. Большое количество гуаниновых и цитозиновых оснований в составе праймера также повышает температуру отжига, так как эти основания образуют 3 водородные связи, тогда как аденин и тимин – лишь две.
Для определения оптимальной температуры отжига праймера разработаны специальные формулы, однако все они являются неточными. Поэтому

окончательное определение оптимальной температуры отжига праймера осуществляется экспериментально.
Таким образом, именно этап отжига определяет специфичность и чувствительность ПЦР. Соответственно, корректный подбор нуклеотидной последовательности праймера и оптимальной температуры отжига подбор праймера является ключевым условием успешного проведения реакции.
3)Элонгация. На этом этапе ДНК-полимераза к матричной цепи достраивает комплементарную цепь, используя в качестве затравки праймер. Элонгация обычно проводится при 72ºС в течение 20-40 сек. Скорость элонгации при использовании Taq-полимеразы составляет около 60 нуклеотидов в секунду.
После завершения последнего этапа цикл начинается сначала и повторяется |
||||||
многократно (обычно 40-60 раз). |
|
|
|
|||
|
95ºC |
|
|
|
|
|
|
|
|
|
95ºC |
|
|
|
|
65ºC |
72ºC |
|
º |
72ºC |
|
|
|
|
|
65 C |
|
температура, С |
денатурация |
отжиг |
элонгация |
денатурация |
отжиг |
элонгация |
|
|
|
I цикл |
|
|
II цикл |
|
|
|
|
время |
|
|
Рис. 4. Температурная схема ПЦР. Представлены 2 цикла амплификации. |
||||||
Схема амплификации ДНК в ПЦР
Общая схема первых трех циклов амплификации представлена на рис. 5.
I цикл ПЦР.
В начале I цикла происходит денатурация ДНК выявляемого возбудителя с образованием двух одноцепочечных молекул (плюс- и минус-цепи). Далее реакционная смесь охлаждается, и наступает стадия отжига, т.е. связывания праймеров. В ПЦР используются 2 праймера, один из которых присоединяется к плюс-цепи, другой – к минус-цепи ДНК, ограничивая амплифицируемый участок с двух сторон. Один из праймеров условно обозначается как прямой (forward), другой – как обратный (reverse).

На этапе элонгации происходит достройка комплементарных цепей ДНК с участием ДНК-полимеразы, использующей праймеры в качестве затравок. Движение ДНК-полимеразы происходит от 3'-конца к 5'-концу матричной цепи и, соответственно, достройка комплементарных цепей происходит в этом же направлении.
По завершении цикла на матрице одной молекулы ДНК синтезируются 2 дочерние молекулы ДНК. У каждой из дочерних молекул ДНК вновь синтезированная цепь ограничена со стороны 5’-конца праймером (в одной из дочерних молекул ДНК – прямым праймером, в другой – обратным).
3’
F
3’
F
3’
5’
3’
5’
5’
5’
3’
5’
3’
5’
5’
3’
-ДНК полиме раза
R
ДНКполиме раза |
R |
|
5’_
5’_
3’ +
5’
5’
5’
3’
5’
3’
3’
3’
3’
_
_
_
+
_
+
+
+
+
3’ |
+ |
исходная ДНК |
|
|
_ |
|
|
5’ |
|
|
|
5’ |
|
3’ + |
денатурация |
|
|
R |
|
5’ |
|
3’ + |
отжиг |
|
ДНКполиме раза |
R |
|
|
|
элонгация |
|
5’ |
|
|
|
|
3’ + |
|
|
3’ |
|
5’_ |
|
|
|
|
конец цикла |
5’ |
|
3’ + |
|
3’ |
|
5’_ |
денатурация |
|
|
||
F |
|
|
|
3’ |
|
5’_ |
отжиг |
|
|
||
F |
|
-ДНК полиме раза |
|
|
|
|
|
3’ |
|
5’ _ |
элонгация |
5’ |
|
3’ + |
|
|
|
5’ _ |
конец цикла |
3’ |
|
|
|
5’ |
|
3’ + |
|
3’ |
|
5’ _ |
|
I ц и к л
II ц и к л
III ц и к л
Рис. 5. Схема амплификации ДНК в ПЦР (пояснение в тексте). Черным цветом выделен амплифицируемый фрагмент ДНК. «+» и «–» – соответственно, «плюс»- и «минус»-цепи ДНК. Стрелками указано направление движения ДНКполимеразы. На II цикле ПЦР (этап денатурации) для упрощения схемы
оставлены лишь укороченные с 5'-конца цепочки ДНК. III цикл реакции подробно не описан, представлены лишь конечные продукты цикла: двухцепочечные ампликоны.
II цикл ПЦР.
В следующем цикле ПЦР происходит денатурация обеих дочерних молекул ДНК с образованием 4-х одноцепочечных молекул. Для удобства в схеме рассматриваются лишь две достроенные в ходе предыдущего цикла цепи ДНК, ограниченные со стороны 5'-конца. На этапе отжига к этим цепям присоединяются праймеры. К цепи, затравкой которой служил прямой праймер, присоединяется обратный праймер, и, наоборот, к цепи, инициированной обратным праймером, присоединяется прямой праймер. Далее на этапе элонгации синтезируются две новые комплементарные цепи, ограниченные с обеих сторон. В результате к концу II цикла ПЦР в реакционной смеси появляются молекулы ДНК, у которых одна из цепей ограничена с обеих сторон праймерами.
III цикл ПЦР.
В ходе III цикла ПЦР происходит денатурация продуктов II цикла, и к образовавшимся одноцепочечным молекулам ДНК (ограниченным с обеих сторон праймерами) достраиваются комплементарные цепи. В результате по завершении III цикла в реакционной смеси появляются 2-цепочечные ампликоны, у которых обе цепи ограничены с двух сторон праймерами.
Последующие циклы ПЦР.
В последующих циклах ПЦР происходит репликация ампликонов. Каждая из цепей ампликона является матрицей для синтеза комплементарной цепи и, соответственно, каждый цикл ПЦР из одного ампликона синтезируются два. Таким образом, каждый цикл ПЦР приводит к удвоению числа содержащихся в реакционной смеси ампликонов (рис. 6). В результате в ПЦР рост числа ампликонов происходит в геометрической прогрессии и описывается формулой N = 2n, где N – число ампликонов в реакционной смеси, n – число циклов амплификации. К концу 30-го цикла количество ампликонов, полученных из одной молекулы ДНК микроорганизма, может достичь 1 млрд.
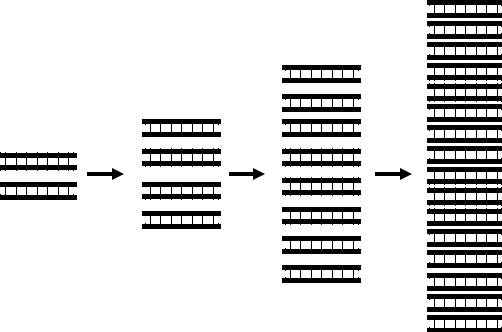
 …
…
III цикл
IV цикл
V цикл
VI цикл
Рис. 6. Динамика накопления ампликонов в циклах ПЦР.
Таким образом, метод ПЦР-диагностики возбудителей инфекционных заболеваний основан на многократной амплификации определенного участка ДНК микроорганизма. При этом даже из одной молекулы ДНК может быть получено практически неограниченное число ампликонов, что придает методу высокую чувствительность. Специфичность ПЦР-диагностики обеспечивается подбором праймеров, специфически присоединяющимся именно к ДНК выявляемого микроорганизма и ни к какой иной.
Амплификацию проводят в автоматическом режиме с помощью специальных приборов, амплификаторов (термоциклеров), которые, по сути, представляют собой программируемые термостаты. В амплификатор вставляют пробирки с реакционной смесью, и прибор осуществляет периодическое нагревание и охлаждение пробирок в соответствии с программой (рис. 7).

Рис. 7. Амплификатор (термоциклер).
Нагревание или охлаждение может осуществляться двумя способами. Чаще всего в амплификаторе есть специальный планшет из металла с высокой теплопроводностью, в который вставляют о пробирки с реакционной смесью. Под планшетом находятся элементы Пельтье, которые осуществляют нагрев или охлаждение планшета. В некоторых амплификаторах нагрев или охлаждение осуществляют с помощью потоков горячего или холодного воздуха. В этом случае пробирки вставлены в ротор и как бы висят в воздухе.
На 3-й стадии ПЦР-диагностики (после завершения амплификации) производится детекция образовавшихся в ходе ПЦР ампликонов. Эта задача решается методом электрофореза продуктов ПЦР в агарозном геле.
Электрофорез – разделение смеси молекул на отдельные фракции под действием электрического поля. Электрофорез продуктов ПЦР проводится в пластине из агарозного геля, помещенной между электродами. Возле края пластины, расположенного ближе к катоду, находятся лунки, куда вносят реакционную смесь с ампликонами. Под действием электрического поля молекулы ДНК движутся через гелевую пластину от катода к аноду, при этом длинные молекулы задерживаются в геле и потому мигрируют медленнее, чем более короткие. В результате происходит разделение смеси молекул ДНК по их размеру: фракции более коротких молекул ДНК мигрируют ближе к аноду, тогда как более длинные остаются ближе к катоду. Для приблизительной оценки размера молекул ДНК во фракциях используют готовую смесь из различных молекул ДНК известной длины: в ходе электрофореза эти молекулы разделяются по размеру и образуют своеобразную измерительную шкалу, по которой можно оценить размер получившихся в ПЦР ампликонов (рис. 8).

Рис. 8. Электрофорез ДНК в агарозном геле (окраска бромидом этидия, фото в ультрафиолете). Слева контрольная шкала из готовых фрагментов ДНК известной длины; справа полоски, образованные ампликонами, полученными в ПЦР.
После электрофореза гелевую пластину окрашивают раствором бромида этидия, флуоресцирующего красителя, имеющего свойство включаться в двухцепочечные ДНК. После окраски гелевую пластину просматривают в ультрафиолете, окрашенные бромидом этидия фракции ДНК выглядят как полоски розового цвета.
Оценка размера образовавшихся в ходе ПЦР ампликонов позволяет проконтролировать специфичность реакции, так как в реакционной смеси может содержаться балластная ДНК, не принадлежащая выявляемому микроорганизму. В балластной ДНК могут присутствовать нуклеотидные последовательности, комплементарные праймерам. В этом случае есть риск получения неспецифических ампликонов балластной ДНК. Размер полученных в ходе ПЦР ампликонов является доказательством того, что амплификации подвергся именно фрагмент ДНК выявляемого микроорганизма. Вероятность совпадения размеров ампликонов, полученных из ДНК выявляемого микроорганизма, и побочных продуктов ПЦР, крайне мала.
Положительным результатом реакции считается выявление четкой полосы, образованной фрагментами ДНК подходящей длины.
ПЦР С ОБРАТНОЙ ТРАНСКРИПЦИЕЙ (ОТ-ПЦР)
Большинство вирусов являются РНК-геномными (вирус гепатита С, вирусы гриппа, ВИЧ, вирусы группы клещевого энцефалита и т.д.), и их выявление методом ПЦР сопряжено с проблемой: ДНК-полимераза не может
