
Задачи Крюкова / Растворы электролитов 5
.docxМолярная электрическая проводимость водного раствора гидроксида аммония при разведении 128 л/моль и температуре 298К равна 13,5 Ом-1см2/моль. Пользуясь справочными данными о предельных молярных электрических проводимостях ионов в воде, рассчитайте степень и константу диссоциации электролита, рН раствора.
Дано:
Раствор NH4OH
Λ = 13,5 Ом-1см2/моль = 13,5 Ом-1м2/моль
V = 128 л/моль
Найти:
a-?
Кд-?
pH-?
Решение:
Так как дан слабый электролит, найдем Степень Диссоциации по формуле Аррениуса
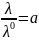
13,5·10-4
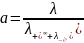 =
------------------------------------ = 0,05 = 5%
=
------------------------------------ = 0,05 = 5%
13,5·10-4 + 198,3·10-4
Найдем константу диссоциации электролита
NH4OH=NH4+ + OH-
a2 · C a2 0,052
Кд = ---------- = ------ = ----------------- = 2,028·10-5
(1-a) (1-a) (1-0,05)·128
Найдем pH раствора по формуле:
pH = 14 – pOH
pOH = -lg(a·C) = -lg(a/V) = -lg 0,05/128 = 3,4
pH = 14 – 3,4 = 10,6
Ответ: a = 5%
Кд = 2,028·10-5
pH = 10,6
Эквивалентная электропроводность водного раствора слабой одноосновной кислоты при 25 °С равна 16.0 См·см2/моль при концентрации 0,01 моль/л и 48.4 См·см2/моль при концентрации 0,001 моль/л. Рассчитайте эквивалентную электропроводность раствора при бесконечном разбавлении и константу диссоциации кислоты.
Дано:
T = 25°C = 298K
Λ1 = 16 См·см2/моль
С1 = 0,01 моль/л = 0,01·10-3моль/см3
Λ2 = 48,4 См·см2/моль
С2 = 0,001 моль/л = 0,001·10-3моль/см3
Найти:
λ∞-?
Кg-?
Решение:
-
Λ
16,0
48,4
C
0,01
0,001
1/Λ
0,0625
0,020661
Λc
0,00016
4,84·10-5
Построим график зависимости:
1/Λ = f(Λc)
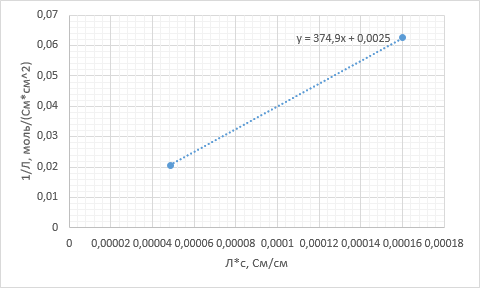
По методу Крауса-Брея:
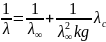
Получаем

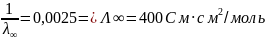
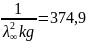
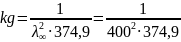
Kg = 1,67·10-8моль/см3 = 1,67·10-5 моль/л
Ответ:
λ∞ = 400 Cм·см2/моль
Кg = 1,67·10-5 моль/л
Средний ионный коэффициент активности в 0.500 моль/кг водном растворе LaCl3 при 25°С равен 0.303. Какова ошибка в определении этой величины по первому приближению теории Дебая-Хюккеля?
Дано:
Раствор LaCl3
γ+- = 0,303
c = 0,500 моль/кг
t = 25°C = 298K
Найти: Какова ошибка в определении по первому приближению?
Решение:
Воспользуемся формулой 1 приближения теории Дебая-Хюккеля:
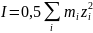
I = 0,5(0,5·32+1,5·12) = 3
Рассчитаем коэффициент активности по формуле:
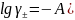
lgγ+- = -0,509·|1·3|·√3 = -2,645
γ+ = 0,002
Найдем ошибку:
0,303-0,002
----------------- · 100% = 99% = 0,99
0,303
Ответ: Ошибка составляет 99% или 0,99
