
- •1. Антикоагулянты непрямого действия, образование 4-гидроксикумарина и дикумарола в природе, синтез варфарина.
- •2. Механизм антикоагулянтной активности структурных аналогов витамина к. Предполагаемый механизм выработки резистентности к варфарину,пути ее преодоления.
- •3. Антикоагулянтная активность индан-1,3-дионов. Получение дифенацина. Преимущества и недостатки ратицидов с острой и хронической токсичностью.
- •4. Эмпирический подход к оптимизации структуры ратицида на основе дифениламина. Получение брометалина – n-метил-2,4-динитро-2´,4´,6´-трибром-6-трифторметил-дифениламина.
- •5. Контактные и системные фунгициды, примеры, преимущества и недостатки. Получение дитиокарбаматов из аминов и сероуглерода. Соли дитиокарбаминовых кислот с катионами цинка и марганца.
- •6. Механизм действия азольных антимикотических средств, триазольные и имидазольные фунгициды. Синтез тебуконазола – третбутил-2-(4-хлорфенил)этил-триазол-1-илметил-карбинола.
- •7. Механизм токсичности циановодорода. Получение циановодорода в промышленности, использование в синтезе мономеров.
- •9. Химические реагенты, вызывающие отёк лёгких. Химические свойства дихлорангидрида угольной кислоты: реакции со спиртами, фенолами, первичными, вторичными и третичными аминами.
- •10. Инсектицидная активность фенвалерата. Получение эфира α-(4-хлорфенил)- изовалериановой кислоты и циангидрина 3-феноксибензальдегида.
- •11. Механизм токсичности монооксида углерода. Способы получения и токсичность карбонилов металлов, их участие в реакции оксосинтеза.
- •13.Фунгицидная активность бензимидазолил-метилкарбамата и бенлата. Способы их получения.
- •14.Химические свойства 2,2´-дихлордиэтилсульфида, реакции окисления (токсичность соответствующих сульфоксидов и сульфонов), хлорирование, реакции по атомам хлора 2-хлорэтильных групп.
- •15. Вещества раздражающего действия, общие представления о зависимости структура-активность для галогенидов и непредельных соединений. Индекс безопасности. Получение хлорацетофенона.
- •16.Агонисты ацетилхолина в м- и n-холинорецепторах, токсичность никотина. Неоникотиноиды, получение имидаклоприда: синтез 6-хлор-3-хлорметилпиридина и 2‑нитроиминоимидазолидина.
- •17. Роль ювенильных гормонов в жизненном цикле насекомых с полным метаморфозом. Способ получения метопрена – изопропилового эфира 11-метокси-3,7,11-триметилдодека-2,4-диеновой кислоты.
16.Агонисты ацетилхолина в м- и n-холинорецепторах, токсичность никотина. Неоникотиноиды, получение имидаклоприда: синтез 6-хлор-3-хлорметилпиридина и 2‑нитроиминоимидазолидина.
Агонистами ацетилхолина являются никотин и его структурные аналоги. Они раздражают те же рецепторы, что и ацетилхолин, но переданный ими сигнал возбуждения не прекращается довольно продолжительно, так как они достаточно стабильны и не гидролизуются холинэстеразой, в отличие от ацетилхолина. Из-за этого энергетические возможности клетки истощаются.
Никотин действует как нейротоксин – в небольшой дозе стимулирует работу мышц и желез, но в летальной дозе (для человека от 0,5 до 1 мг/кг) он вызывает смерть из-за остановки дыхания и работы сердца.
На основе никотина были разработаны более стабильные и менее токсичные (для теплокровных ЛД от 500 до 1000 мг/кг) инсектициды – неоникотиноиды, например:
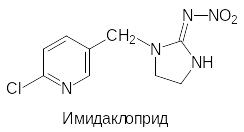
Имидаклоприд получают реакцией алкилирования 6‑хлор-3-хлорметилпиридином 2-нитроиминоимидазолидина:
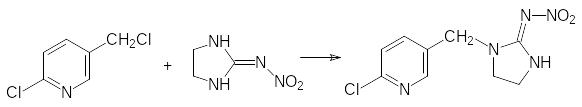
2-нитроиминоимидазолидин образуется из этилендиамина и нитрогуанидина:

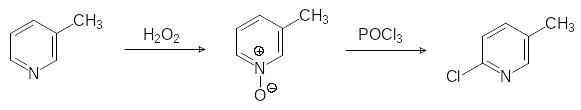
6‑хлор-3-хлорметилпиридин образуется при хлорировании метильной группы 6-хлорпиколина. Для того, чтобы его получить, сначала по реакции Чичибабина при конденсации аммиака с акриловой кислотой и пропионовым альдегидом получают смесь замещенных пиридинов с высоким содержанием 3-метил-пиридина. Затем 3-метил-пиридин в мягких условиях окисляют пероксидом водорода, продукт р-ии нагревают с POCL3:
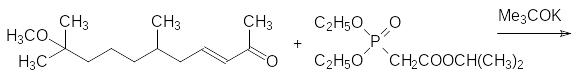
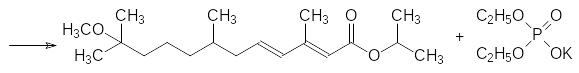
17. Роль ювенильных гормонов в жизненном цикле насекомых с полным метаморфозом. Способ получения метопрена – изопропилового эфира 11-метокси-3,7,11-триметилдодека-2,4-диеновой кислоты.
Ювениальный гормон при линьке не дает насекомому превратиться в следующую фазу развития, стимулирую рост насекомого на личиночной стадии. После некоторого числа линек ювениального гормона становится недостаточно или он вообще перестает выделяться для блокировки метаморфоза личиночной стадии, после этого существование насекомого на личиночной стадии прекращается.
При получении метопрена в качестве исходного соединения используют цитронеллаль – 3,7-диметилокта-6-еналь, который входит в состав эфирных масел цитрусовых. По двойной связи этого вещества в присутствии кислот присоединяют метанол:
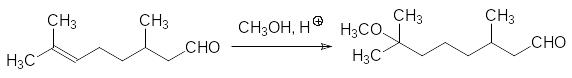
Диметилметоксиоктаналь вводят в реакцию кротоновой конденсации с ацетоном в присутствии гидроксида бария:
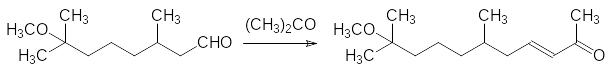
1 2 3 5 17 13 11 9 6 7 8
4 10 12 14 15 16
