
Sb95327
.pdfМИНОБРНАУКИ РОССИИ
–––––––––––––––––––––––––––––––––––––––
Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В. И. Ульянова (Ленина)
–––––––––––––––––––––––––––––––––––––––
В. А. БАЯНОВ О. В. РАХИМОВА
КИНЕТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Учебное пособие
Санкт-Петербург Издательство СПбГЭТУ «ЛЭТИ»
2017
УДК 533.72(07)
ББК Г51я7
Б34
Баянов В. А., Рахимова О. В.
Б34 Кинетические методы анализа: учеб. пособие. СПб.: Изд-во СПбГЭТУ
«ЛЭТИ», 2017. 32 с.
ISBN 978-5-7629-2025-4
Посвящено теоретическим основам кинетических методов анализа, применяемым в аналитической и токсикологической химии объектов различного прикладного назначения.
Предназначено для подготовки бакалавров по направлению 20.03.01 «Техносферная безопасность» по профилю «Инженерная защита окружающей среды» и студентов химических специальностей.
УДК 533.72(07)
ББК Г51я7
Рецензенты: кафедра общей и физической химии Национального мине- рально-сырьевого университета «Горный»; доц., канд. хим. наук В. А. Кескинов (СПбГТИ (ТУ)).
Утверждено редакционно-издательским советом университета
в качестве учебного пособия
ISBN 978-5-7629-2025-4 |
© СПбГЭТУ «ЛЭТИ», 2017 |
2
ВВЕДЕНИЕ
Кинетические методы анализа – это методы качественного и количественного химического анализа, основанные на зависимости скорости реакций от концентраций реагирующих веществ. Они отличаются высокой чувствительностью, использованием достаточно простой и доступной аппаратуры, экспрессностью выполнения, что успешно используется для решения фи- зико-химических, аналитических и экологических задач.
Воснове кинетических методов анализа лежат теоретические положения феноменологической (формальной) кинетики, которая изучает зависимость скорости реакции от времени, температуры, количества участвующих веществ, а также других внешних воздействий на основе предполагаемой кинетической схемы, и базируется на разделах физической химии «Теория химического строения» и «Химическая термодинамика». При этом в процессе кинетического анализа могут решаться как прямая задача: расчет кинетического поведения участников превращения при заданной схеме реакции и известным константам скорости, так и обратная: нахождение схемы реакции и кинетических параметров по экспериментальным данным.
Для получения аналитического сигнала в ходе индикаторной реакции используются различные методы регистрации: полярографический, проточ- но-инжекционный, кондуктометрический, спектрофотометрический и т. д. Аналитическим сигналом может быть любое физически измеримое свойство, прямо пропорциональное концентрации реагирующих веществ.
Внастоящем учебном пособии кратко изложены теоретические основы кинетических методов анализа, приведены виды кинетических кривых и способы определения порядка и скорости химической реакции.
3

1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИЧЕСКОЙ КИНЕТИКИ
Скоростью химической реакции называется изменение количества вещества, вступающего в реакцию или образующегося в ходе реакции, в единицу времени в единице объема:
v V1 dndt ,
где n – число молей (или молекул).
Если объем системы постоянен (т. е. система является замкнутой), то
v |
d |
n |
|
dC |
, |
||
|
|
|
|
dt |
|||
|
|
||||||
|
dt V |
|
|
||||
где С – объемно-молярная или объемно-молекулярная концентрация вещества. Скорость химической реакции зависит:
1) от температуры согласно правилу Вант-Гоффа: при увеличении температуры на 10 градусов скорость химической реакции возрастает в 2–4 раза:
T2 T1 |
|
|
v v γ 10 |
, |
(1.1) |
0 |
|
|
где v – скорость химической реакции после увеличения температуры; |
v0 – |
|
начальная скорость химической реакции; γ = 2…4 – температурный коэффициент Вант-Гоффа; T1 и T2 – начальная и конечная температуры;
2)природы реагирующих веществ: более химически активные вещества реагируют с большей скоростью;
3)концентрации реагирующих веществ;
4)давления газообразных реагентов;
5)площади соприкосновения для гетерофазных реакций: чем больше площадь соприкосновения, тем больше скорость гетерофазной реакции;
6)наличия катализаторов – веществ, изменяющих скорость и механизм химических реакций и не расходующихся в ней.
В основе кинетических методов анализа лежит наиболее простая кинетическая классификация химических реакций – разделение их на простые и сложные.
Простая реакция – это одностадийный, односторонний химический процесс. При этом под стадией реакции подразумевается не только химическое превращение, но и переход частицы в особое состояние, например в возбужденное.
4
Реакция называется сложной, если ее механизм состоит из двух или более стадий, которые могут быть последовательными, параллельными, сопряженными, цепными, или представлять собой сложную комбинацию из перечисленных механизмов.
Кинетические признаки, лежащие в основе различий простой и сложной реакций, представлены в табл. 1.1.
|
Таблица 1.1 |
|
|
Реакция |
|
простая |
сложная |
|
|
Числореагирующихвеществнезначительно. |
Число реагирующих веществ значительно. |
Количественный состав продуктов реак- |
Состав продуктов реакции определяется |
ции достаточно прост. |
временем, температурой, исходным соста- |
|
вом реагентов и давлением реакционной |
Количественные соотношения продуктов |
смеси |
|
|
не зависят от условий протекания реакции |
|
(времени, температуры, состава реагиру- |
|
ющей исходной смеси, давления) |
|
Скорость реакции монотонно увеличива- |
Скорость реакции с ростом температуры |
ется с ростом температуры. |
может увеличиваться, уменьшаться или |
|
проходить через экстремум и зависит от |
|
материала и размеров реакционного сосуда. |
Энергия активации всегда положительна и |
Энергия активации, определенная в широ- |
иногда может зависеть от температуры |
ком интервале температур, может быть |
эксперимента |
положительной, отрицательной или близ- |
|
кой к нулю |
Скорость реакции меняется монотонно при |
При варьировании условий проведения |
изменении условий проведения реакции и |
реакции возможно скачкообразное изме- |
не зависит от материала и размеров реак- |
нение скорости реакции на несколько по- |
ционного сосуда |
рядков, обусловленное критическими яв- |
|
лениями катализа или ингибирования хи- |
|
мической реакции |
Уравнение, описывающее зависимость скорости химического процесса от концентрации компонентов реагирующей смеси, называется кинетиче-
ским уравнением процесса:
ν1C1 ν2C2 ... νmCm P; v f C1, C2, ..., Cm .
Сложность математического выражения функции f зависит от меха-
низма химического процесса. Обычно скорость химической реакции пропорциональна произведению текущих концентраций реагирующих веществ, возведенных в некоторые степени:
5
v |
1 |
dCi k C |
n1 C |
2 |
n2 |
C |
ni |
i 1, 2, ..., m . |
||
|
||||||||||
V |
dt |
1 |
|
|
|
i |
|
|
||
|
|
|
|
|
|
|
|
|||
Показатель степени при концентрации |
ni |
называют порядком реакции |
||||||||
по веществу Ci . Различают порядки стехиометрические ( vi ) и кинетические ( ni ). Для простых реакций порядки совпадают vi ni , в случае сложных –
порядки могут быть и не равны друг другу (это является одним из признаков сложной реакции). Сумма всех порядков называется общим, или суммарным,
m
порядком n ni. Порядок реакции может быть любым числом: целым ( vi ), i 1
дробным ( ni ), положительным (как стехиометрический, так и кинетический) и даже отрицательным ( ni ), например для сложных реакций, когда лимити-
рующей стадией является превращение быстро образующегося промежуточного соединения в конечный продукт. Для каталитических реакций с промежуточным соединением, ингибирующим реакцию, обычно наблюдается уменьшение скорости вследствие конкурирующей адсорбции реагентов на поверхности катализатора. Также уменьшение скорости химических процессов происходит в случаях автокаталитических реакций и реакций с необратимым ингибированием (отравлением) катализатора. В качестве примеров могут быть приведены следующие:
–гидрогенолиз циклопропана и его гомологов на металлических катализаторах: кинетический порядок реакции по водороду часто бывает отрицательным;
–скорость реакции гидрирования ацетилена на никелевом катализаторе обратно пропорциональна парциальному давлению ацетилена.
Дробный порядок возможен для реакций, протекающих в растворах: например, если реагирует молекула с ионом, образующимся при диссоциации, то вероятный порядок реакции будет равен 3/2.
Наибольшее значение имеют реакции нулевого, первого, второго и третьего порядков. Если сложная реакция описывается уравнением скорости ви-
да v0 k A0 n1 B0 n2 , то ее можно назвать квазипростой.
Постоянный множитель k в кинетическом уравнении называется константой скорости реакции, его физический смысл – скорость реакции при концентрации каждого реагента 1 моль/л.
Зависимость константы скорости химической реакции от природы реагирующих веществ и температуры выражается уравнением Аррениуса:
6

Ea
k Ae RT ,
где А – предэкспоненциальный множитель, зависящий от числа соударений реагирующих частиц между собой; Ea – энергия активации, Дж/моль; R =
= 8.31 Дж/(К · моль) – универсальная газовая постоянная; Т – абсолютная температура, К.
Значения константы скорости химических реакций изменяются в широких пределах: от 10–7 до 1011 единиц. Деление реакций на быстрые и медленные достаточно условно, поскольку для ускорения медленных реакций в соответствии с уравнением Аррениуса используют повышение температуры (нагревание) и катализаторы (уменьшение энергии активации). Именно быстрые реакции имеют практическое значение в аналитической и токсикологической химии.
Молекулярность реакции – это число молекул, принимающих участие в элементарном акте химического превращения. В отличие от порядка реакции молекулярность не может быть ни нулевой, ни дробной. По молекулярности различают:
1. Мономолекулярные – в элементарном акте химического превращения участвует одна молекула, например:
н-С4H10 t изо-С4H10
– изомерный переход молекулы н-бутана в изобутан;
цикло-С3H6 t CH2 CH CH3
– превращение циклопропена в пропен;
Ca HCO3 2 t CaCO3 H2O + CO2
–разложение гидрокарбоната кальция.
2.Бимолекулярные – реакции, в которых химическое превращение осуществляется путем взаимодействия двух молекул (одинаковых или различных), например:
2NO газ N2O2 газ
– димеризация монооксида азота;
2CH3CH2 CH3CH3 CH2 CH2
– разложение этилена;
CO Cl2 COCl2
– образование фосгена;
7
H2 I2 2HI
– синтез иодоводорода;
PH3 B2H6 PH3 BH3 BH3
– взаимодействие фосфина с дибораном;
NOI NOI 2NO I2
–разложение нитрозилиодида.
3.Тримолекулярные реакции протекают при взаимодействии в элементарном акте трех частиц, их известно очень немного. Очевидно, что вероятность одновременного соударения трех молекул в реакционном пространстве очень мала и поэтому тримолекулярные реакции идут крайне медленно.
Примеры тримолекулярных реакций:
2NO O2 2NO2
– образование диоксида азота;
2NO Cl2 2NOCl
– синтез нитрозилхлорида.
Реакций более высокой молекулярности не существует. Поэтому большинство реакций протекают в несколько элементарных, простых стадий, в которых участвует небольшое число молекул. Определить такие стадии – значит определить механизм или путь реакции. Скорость всей реакции определяется скоростью ее наиболее медленной (лимитирующей) стадии, которая и определяет механизм.
Молекулярность реакции – понятие теоретическое, для ее определения нужно представлять, как именно протекает данная реакция, через взаимодействия каких молекул, через какие стадии. В отличие от молекулярности порядок реакции – величина экспериментальная. Он связан с опытной зависимостью скорости данной реакции от концентрации исходных продуктов.
Как правило, молекулярность простой реакции совпадает с порядком реакции, но они могут и различаться. Например, рекомбинации атомов в газо-
вой фазе протекают через тройные столкновения, например: Cl Cl MCl2 M, где М – третья частица. Суммарный порядок такой реакции –
третий (скорость v k M Cl 2 ), но молекулярность равна 2, так как в химическом взаимодействии участвуют два атома хлора, а частица М лишь принимает на себя энергию, выделившуюся при рекомбинации атомов, не претерпевая при этом химических превращений.
8
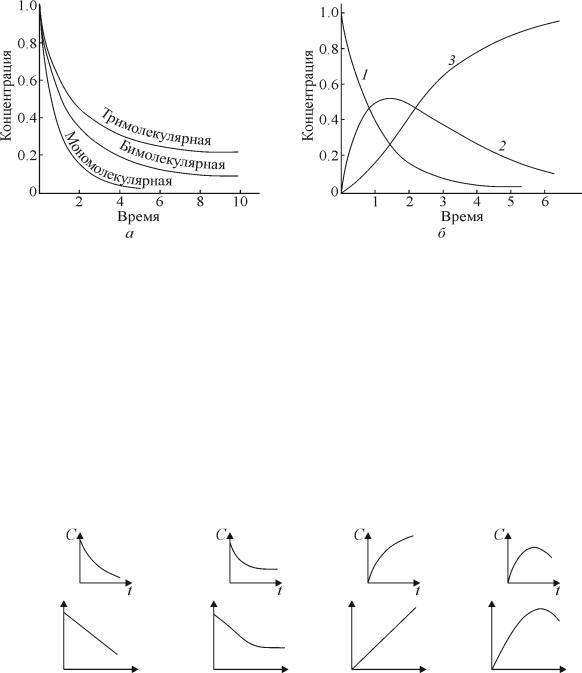
2. ВИДЫ КИНЕТИЧЕСКИХ КРИВЫХ. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Кинетическая кривая – экспериментально получаемая зависимость, характеризующая изменение концентрации реагента или продукта, или связанного с ними свойства системы во времени в результате протекания химического процесса, которая может быть выражена в графической, табличной или алгебраической форме.
На рис. 2.1 показаны различные графические зависимости концентраций от времени протекания реакции.
Рис. 2.1. Виды кинетических кривых для реакций: а – с различной молекулярностью; б – последовательных (1 – концентрация исходного вещества;
2 – промежуточного вещества; 3 – продукта)
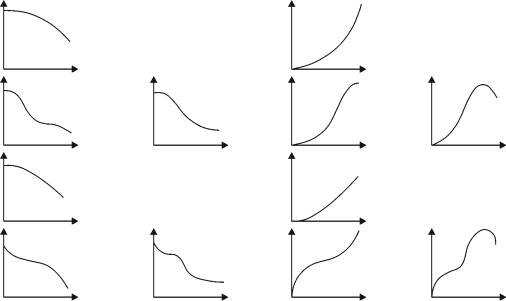
На практике могут встречаться и более сложные виды кинетических зависимостей (табл. 2.1, в которой показана зависимость концентрации вещества от времени протекания реакции). Форма и тип полученных кинетических кривых позволяют выявить особенности в кинетике исследуемой реакции и осуществить кинетическую классификацию химических реакций.
|
|
|
|
Таблица 2.1 |
|
|
|
|
|
|
|
|
Исходное вещество |
Конечный |
Промежуточный |
||
|
Необратимая |
Обратимая |
|||
№ |
продукт |
продукт |
|||
реакция |
реакция |
||||
|
III |
IV |
|||
|
I |
II |
|||
|
|
|
|||
1 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
9
|
|
|
|
Окончание табл. 2.1 |
|
|
|
|
|
|
|
|
Исходное вещество |
Конечный |
Промежуточный |
||
|
Необратимая |
Обратимая |
|||
№ |
продукт |
продукт |
|||
реакция |
реакция |
||||
|
III |
IV |
|||
|
I |
II |
|||
|
|
|
|||
3 |
|
– |
|
– |
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
5 |
|
– |
|
– |
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
Представленные кинетические кривые характеризуют четыре основных типа расходования и накопления соединений в реакционной смеси:
I. Реагент расходуется практически нацело. Его концентрация уменьшается во времени: С t1 С t2 при t1 t2 ; если реакция идет до конца, то
Сt 0 при t .
II. Реагент расходуется до конечной степени превращения, меньшей 100 %, что характерно для таких химических процессов, как обратимые реакции; каталитические реакции, в ходе которых происходит «отравление» катализатора; сложные реакции, протекающие с образованием ингибитора. Кроме того,
вэтом случае в многокомпонентной реакции реагенты не расходуются до конца, если они взяты в нестехиометрическом соотношении. Таким образом,
при t C 0.
III. Концентрация продукта возрастает монотонно: С t1 С t2 при
t1 t2.
IV. Концентрация продукта проходит через максимум. Подобный тип зависимости характерен для промежуточного продукта, его концентрация увеличивается, проходит через максимум и уменьшается.
Для каждого из указанных типов возможны кинетические кривые различных видов:
10
