
Sb95327
.pdf
Таблица 5.1
Каталитические методы
|
|
|
|
|
Типы реакций |
Редокс- и хемилюминисцентные |
|
Неферментативные |
Комплексообразование |
||
|
|||
|
Активирование |
||
(гомогенные) |
|
||
Модификации |
Ингибирование |
||
|
|||
|
|
Каталитическое титрование |
|
|
|
Гомогенные |
|
Ферментативные |
Гетерогенные (иммобилизованные ферменты) |
||
Модификации |
Активирование |
||
|
|||
|
Ингибирование |
||
|
|
||
Электрохимические (гетерогенные)
Некаталитические методы
Определение индивидуальных веществ Анализ смесей (дифференциальные кинетические методы)
назначению – для определения отдельных компонентов или нескольких сразу (дифференциальные кинетические методы). Другие варианты классификаций могутосновыватьсянаразличиивметодологииилиприменяемомоборудовании.
Кинетические методы, несмотря на определенные сложности проведения анализа в динамических условиях, имеют определенные преимущества перед равновесными.
Например, они дают возможность использовать разнообразные химические реакции, непригодные для проведения определения в статическом режиме (например, медленные). Также в системах с медленно протекающими реакциями, по мере их приближения к завершению, может наблюдаться увеличение роли побочных процессов, но на результаты кинетических методов анализа это, как правило, не влияет. В кинетических методах можно использовать реакции, протекающие не количественно и непригодные для равновесных вариантов. Более того, эти методы характеризуются большей чувствительностью и могут применяться для определения следовых количеств веществ (особенно каталитические реакции). Дифференциально-кинетические методы позволяют одновременно определять близкородственные соединения без предварительного разделения за счет различия в скорости их взаимодействия с реагентом.
В то же время серьезным недостатком кинетических методов является необходимость тщательно воспроизводить условия эксперимента при анализе (так как скорость химических реакций зависит от множества параметров).
Каталитические кинетические методы основаны на измерении скоро-
сти химической реакции, протекающей в растворе при действии катализатора; нередко сам катализатор является определяемым веществом.
Для подобных методов определения обычно строится кинетическая кривая зависимости измеряемого свойства от времени, а концентрацию катали-
21
затора затем определяют по градуировочному графику, конкретный вид которого зависит от особенностей используемого метода.
Некаталитические кинетические методы относительно редко приме-
няются, поскольку равновесные методы более экспрессны и достаточно чувствительны. Их применение целесообразно, если индикаторная реакция протекает очень медленно или достижению равновесия препятствуют побочные процессы. Также реакции такого рода важны при анализе смесей родственных соединений (см. дифференциальный кинетический анализ).
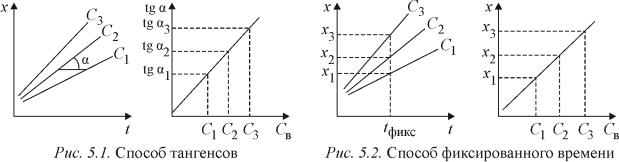
5.3. Три основных способа определения неизвестной концентрации вещества по данным кинетических измерений
Основными способами определения неизвестной концентрации вещества по данным кинетических измерений являются методы тангенсов, фиксированного времени и фиксированной концентрации, которые рассмотрены применительно к дифференциальному варианту кинетического метода анализа.
Способ тангенсов. Угол наклона характеризует скорость индикаторной реакции и зависит от концентрации определяемого вещества. Градуировочный график строят в координатах «концентрация определяемого соединения – tg » при известных концентрациях определяемого вещества (рис. 5.1, где t – время; C3 C2 C1 – концентрации определяемого соединения).
Способ тангенсов основан на определении тангенса угла наклона кинетических кривых.
Способ фиксированного времени. При определенном, строго фиксированном интервале времени протекания реакции измеряют концентрацию индикаторного вещества в пробах с известными концентрациями определяемого компонента. Градуировочный график строят в координатах «концентрация определяемого вещества – концентрация индикаторного вещества» при фиксированном времени tфикс протекания реакции (рис. 5.2, где x – концентра-
ции индикаторного вещества).
22
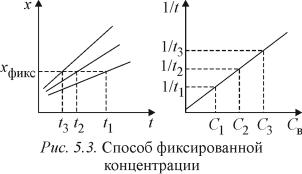
Часто при работе этим методом индикаторную реакцию останавливают при tфикс с помощью резкого охлаждения, изменения кислотности раствора, добавленияингибиторов.
Способ фиксированной концен-
трации. В отдельных пробах с известными концентрациями определяемого вещества проводят индикаторную реак-
цию до строго определенной (фиксированной) концентрации индикаторного вещества xфикс и измеряют время достижения этой концентрации. Градуиро-
вочный график строят в координатах «концентрация определяемого компонента – величина, обратная времени достижения xфикс» (рис. 5.3).
23
6.ДИФФЕРЕНЦИАЛЬНЫЕ КИНЕТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Впоследнее время все больше завоевывают популярность дифференциальные кинетические методы анализа. Как правило, они предназначены для решения сложной задачи – анализа смесей соединений близкой природы.
Воснове дифференциальных методов лежит различие в скоростях взаимодействия двух (или более) компонентов смеси с каким-либо реагентом. Чувствительность этих методов несколько ниже методов прямого определения, но их большим преимуществом является то, что они позволяют проводить анализ без предварительного разделения. Общая классификация методов для реакций разных порядков приведена в табл. 6.1. Выбор того или иного метода обусловлен знанием механизма реакций, а также возможностью или невозможностью определения кинетических параметров индикаторных реакций для компонентов.
|
|
Таблица 6.1 |
|
|
|
Порядок реакции |
Концентрации реагентов |
Метод |
Псевдопервый |
R0 A0 B0 |
Логарифмической экстраполяции, |
(по A0 B0 ) |
|
линейный графический, |
|
|
Уотингтона и Пардью, |
|
|
Коннорса, |
|
|
одной точки (Ли и Кольтгофа), |
|
|
начальных скоростей, |
|
|
пропорциональных уравнений |
Псевдопервый |
R0 A0 B0 |
Одной точки (Робертса и Ригана), |
(по R0 ) |
|
пропорциональных уравнений |
Второй |
R0 A0 B0 |
Логарифмической экстраполяции |
|
или R0 A0 B0 |
второго порядка, |
|
линейной экстраполяции, |
|
|
(50-кратный изб. А и В) |
одной точки второго порядка |
|
R0 A0 B0 |
|
Псевдонулевой |
R0 A0 B0 |
Одной точки, |
|
или R0 A0 B0 , |
пропорциональных уравнений |
|
|
|
|
или R0 A0 B0 |
|
Примечание. A0 и B0 – начальные концентрации атомов комплексообразовате- |
||
лей; R0 – начальная концентрация реагента, содержащего лиганд.
Основные требования, предъявляемые к индикаторным реакциям в диф- ференциально-кинетическом анализе:
1. Отсутствие в системе синергетического эффекта либо возможность его количественного вычисления.
24
2. Различие констант скоростей реакций компонентов с реагентом минимум на порядок, чтобы можно было вычислить вклад каждого компонента в суммарный аналитический сигнал.
Реакции параллельного комплексообразования в системе можно рассматривать как реакции типа R0 A0 B0 .
Например, определение двух веществ А и В, присутствующих в смеси, по реакции с реагентом R. Образующиеся продукты Р и P различны по природе, но дают сходный аналитический сигнал. Соответствующие уравнения реакции можно записать в следующем виде:
A R kA P; B R kB P,
где А и В – атомы-комплексообразователи; R – реагент, содержащий лиганд; kA и kB – константы соответствующих реакций. Продукт реакции для простоты можно считать одним и тем же. Если кинетика каждого компонента подчиняется псевдопервому порядку (т. е. R0 A0 , R0 B0 ) и скорости реакций различны, то в любой момент времени t сумма концентраций А и В есть
Ct Аt Вt Р Рt А0 exp kAt В0 exp kBt . |
(6.1) |
Суммарная же концентрация продуктов: |
|
Рt А0 Аt B0 Bt A0 1 e kAt B0 1 e kBt . |
(6.2) |
Предполагается, что в начальный момент времени продукт в системе отсутствует, максимально возможная его концентрация – Р .
Уравнения (6.1), (6.2) можно использовать в анализе, если константы kA и kB заметно различаются. Концентрацию Р обычно измеряют по истечении достаточно долгого времени; сама по себе она служит мерой суммарного начального содержания компонентов A0 B0 . В уравнениях [P] можно за-
менить на величину пропорционального концентрации аналитического сигнала
– оптической плотности, интенсивности флуоресценции или потенциала и т. д. Существует целый ряд графических и математических приемов дифференциального кинетического определения компонентов смесей. Наиболее значимыми из них являются методы логарифмической экстраполяции, линейной экстраполяции и пропорциональных уравнений. Пригодность того или иного метода для решения аналитической задачи зависит от относительных значений констант скорости и соотношения концентраций компонентов.
25

Задача определения содержания двух или более компонентов смеси значительно облегчается, если отношение констант kA 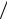 kB велико или мало
kB велико или мало
(т. е. одна из констант скорости очень мала). В противном случае необходимо селективно определить содержание более быстро реагирующих компонентов, либо подбирая подходящие условия, либо маскируя прочие компоненты при помощи ингибитора. Затем можно определить другие компоненты – снова подбирая подходящие условия или по разности.
6.1. Метод логарифмической экстраполяции
Метод логарифмической экстраполяции – один из наиболее распространенных методов. Он основан на использовании логарифмической формы
(6.1). Заявисимость lgCt или lg Р Рt от времени представляет собой
кривую (рис. 6.1). Прямолинейной она будет только в случае kA kB . Если компонент А расходуется в реакции быстрее, чем В (т. е. kA kB ), то Аt 0 , и кривая в
|
конце концов превращается в прямую ли- |
|
нию, уравнение которой имеет вид |
Рис. 6.1. Графическая интерпретация |
lgCt lg Р Рt |
метода логарифмической |
lg В0 kBt 2.303. |
экстраполяции |
По отрезку, отсекаемому прямой на оси ординат, находят начальную концентрацию В0 . Концентрацию A0 можно найти по разности, если определить
сумму A0 B0 по значению Р .
Описанный метод имеет целый ряд преимуществ. Он не требует предварительной информации о константах скорости для компонентов А и В, устойчив к погрешностям, применим к тронным смесям, если все константы скоростей достаточно различаются, и даже к реакциям, в которых проявляется синергизм.
Однако для получения адекватных результатов необходимо, чтобы в реакцию вступило не менее 99 % более быстро реагирующего компонента, необходимо знать суммарную начальную концентрацию компонентов. Также метод требует непрерывной регистрации аналитического сигнала.
С усовершенствованием приборов-детекторов и наличием возможностей компьютерной обработки данных этот метод получает все большее распро-
26

странение. Также у метода логарифмической экстраполяции наиболее широкий по сравнению с другими дифференциальными кинетическими методами диапазон определения концентраций веществ в смеси.
6.2. Метод линейной экстраполяции
Существует несколько разновидностей метода линейной экстраполяции. Если предположить, что в (6.2) kA kB , exp kBt 0 и exp kBt 1, но достаточно отличается от нуля:
Рt А0 В0 1 e kBt ,
то метод сводится к построению зависимости Рt от exp kBt . Получающаяся прямая линия отсекает на оси при t 0 и t отрезки, соответствующиеА0 и А0 В0 . По разности определяется В0 . Кроме того, с меньшей точностью А0 можно определить по графику зависимости Рt от exp kBt
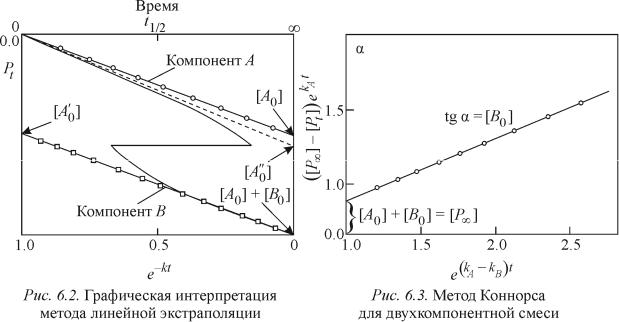
(рис. 6.2).
Данный метод не требует знания суммарной начальной концентрации, однако необходимо знать оба значения констант скорости.
Как одну из разновидностей метода линейной экстраполяции можно рассматривать метод Коннорса. Он также не требует знания суммарной начальной концентрации, но требует значений констант скорости. Данный
метод применим при очень маленьком отношении kA kB |
или при большом |
||||
значении отношения А0 B0 . |
|
|
|
|
|
Если P А0 В0 и kA kB , (6.1) можно преобразовать к виду |
|||||
P Pt ekAt |
А0 В0 e kA kB t . |
(6.3) |
|||
Концентрацию В0 определяется по наклону зависимости выражения, сто- |
|||||
ящего влевой части (6.3) от exp k |
A |
k |
B |
t (рис. 6.3). МолярнаядоляВв смеси |
|
|
|
|
|
||
определяется по тангенсу угла наклона прямой к свободному члену, поскольку последний(t 0, exp kA kB t 1) соответствует P А0 В0 .
Другой предложенный Коннорсом графический метод применим в случае близких значений констант скорости, их значения при этом не требуются, но необходимо знать начальную суммарную концентрацию.
Используя серию зависимостей Pt от времени для различных стандартных смесей, концентрации компонентов в пробе можно найти по той кривой
27
(градуировочной), которая наиболее близка к получающейся при анализе.
При этом |
С |
С |
и, следовательно, |
|
А |
|
|
А |
, |
B |
|
B |
, |
||
|
t пр |
t ст |
|
|
|
|
0пр |
|
0ст |
0пр |
0ст |
||||
где Сt пр |
– концентрация пробы в момент времени t; |
Сt ст |
– концентрация |
||||||||||||
стандарта в момент времени t; |
А |
и |
B |
|
– начальные концентрации |
||||||||||
|
|
|
|
0пр |
|
0пр |
|
|
|
|
|
|
|
||
компонентов А и В в пробе соответственно; |
А |
|
и |
B |
|
– начальные |
|||||||||
|
|
|
|
|
|
|
|
0ст |
|
0ст |
|
|
|
||
концентрации компонентов в стандарте.
Уравнения для пробы и стандарта на основе (6.1):
P Рt пр А0пр e kAt B0пр e kBt ;
P Рt ст А0ст e kAt B0ст e kBt .
Вычитание одного уравнения из другого дает:
Рt пр Рt ст А0ст А0пр e kAt B0ст B0пр e kBt .
Поскольку
А0пр B0пр А0ст B0ст ,
то
Рt пр Рt ст B0ст e kBt e kAt B0пр e kBt e kAt .
Зависимость Рt пр Рt ст от B0ст для серии стандартов (с точно определенными B0ст ) – прямая линия, которая отсекает на оси абсцисс отрезок, соответствующий B0пр (рис. 6.4).
28
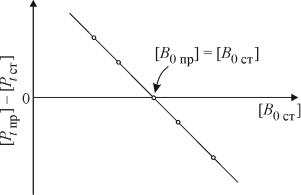
Начальная концентрация А0 определяется из P по разности.
Разновидностью метода Коннорса является способ расчетов, основанный на использовании дополнительного уравнения для определения концентрации более быстро реагирующего компонента. Для этого метода требуется знать константы скорости, но нет необходимости определять P (например, если требуется
много времени для установления P
Рис. 6.4. Зависимость Рt пр Рt ст от B0ст для серии стандартов по методу Коннорса
или P А0 B0 ). Необходимое
уравнение выводится в предположении, что общая скорость реакции равна сумме скоростей для индивидуальных компонентов.
6.3. Метод пропорциональных уравнений
Метод пропорциональных уравнений применяется при анализе смесей близких по свойствам соединений (кроме систем, в которых наблюдается синергизм) и не требует предварительного определения суммарной концентрации. Необходимым условием применения метода является отношение не меньше четырех констант. Метод основан на аддитивности измеряемого свойства и требует очень точного вычисления констант скорости.
Метод состоит в измерении Ci в два (или больше) различных момента времени и использования двух уравнений на основе (6.1):
P Рt1 А0 exp kAt1 B0 exp kBt1 ;
P Рt2 А0 exp kAt2 B0 exp kBt2 .
Решив эту систему уравнений при известных значениях констант скорости, можно определить начальные концентрации компонентов.
Данный метод не очень распространен ввиду небольшого количества аналитических реакций, удовлетворяющих перечисленным требованиям.
29
Список рекомендуемой литературы
Байрамов В. М. Основы химической кинетики и катализа: учеб. пособие для студентов высш. учеб. заведений. М.: ИЦ «Академия», 2003. 256 с.
Барковский В. Ф., Ганопольский В. И. Дифференциальный спектрофотометрический анализ. М.: Химия, 1969. 168 с.
Еремин Е. Н. Основы химической кинетики: учеб. пособие для ун-тов. 2-е
изд., доп. М.: Высш. шк., 1976. 376 с.
Кнорре Д. Г., Эммануэль Н. М. Курс химической кинетики. М.: Высш.
шк., 1984. 463 с.
Марк Г., Рехниц Г. Кинетика в аналитической химии. М.: Мир, 1972. 368 с. Никольский Б. П. Физическая химия. Теоретическое и практическое ру-
ководство / под ред. акад. Б. П. Никольского. Л.: Химия, 1987. 880 с. Перес-Бендито Д., Сильва М. Кинетические методы в аналитической
химии. М.: Мир, 1991. 395 с.
Сапунов В. М., Шмид Р. Неформальная кинетика. В поисках путей химических реакций. М.: Мир, 1985. 264 с.
Connors К. А. Chemical Reactions. The study of reaction rates in solution. New York: VCH Publishers, 1990. 496 p.
30
