
LS-Sb88915
.pdf
МИНОБРНАУКИ РОССИИ
–––––––––––––––––––––––––––––––––
Санкт-Петербургский государственный
электротехнический университет «ЛЭТИ»
–––––––––––––––––––––––––––––––––––––––
О. В. РАХИМОВА В. В. ГУСАРОВ O. A. ЛЕБЕДЕВ
АБСОРБЦИОННЫЕ МЕТОДЫ ХИМИЧЕСКОГО АНАЛИЗА РАСТВОРОВ
Электронное учебное пособие
Санкт-Петербург
Издательство СПбГЭТУ «ЛЭТИ»
2012

УДК 54.062 ББК 24.4
Г96
Рахимова О. В., Гусаров В. В., Лебедев О. А.
Г96 Абсорбционные методы химического анализа растворов: Электронное учеб. пособие. СПб.: Изд-во СПбГЭТУ «ЛЭТИ», 2012. 28 с.
ISBN 978-5-7629-1313-3
Содержит сведения о физико-химических основах абсорбционного метода анализа растворов. Приводится описание работы спектрофотометра. Дается подробное описание порядка работы при химическом анализе некоторых ионов, растворенных в воде, с использованием спектрофотометрического метода.
Предназначено для студентов технических вузов, специализирующихся в области экологии и защиты окружающей среды. Кроме того, пособие может быть полезно для инженерно-технических работников, связанных с анализом экологической ситуации в лабораторных и полевых условиях.
Рецензенты: кафедра канд. хим. наук В. А. Кескинов (кафедра технологии редких элементов и наноматериалов на их основе (СП6ГТИ(ТУ)).
УДК 54.062 ББК 24.4
Утверждено редакционно-издательским советом университета
в качестве электронного учебного пособия
ISBN 978-5-7629-1313-3 |
© СПбГЭТУ «ЛЭТИ», 2012 |
2
ВВЕДЕНИЕ
Основной задачей аналитической химии является определение химического состава веществ и их смесей. Аналитический процесс проходит на разных иерархических уровнях:
1.Определение общих физико-химических принципов анализа.
2.Создание конкретного аналитического метода.
3.Разработка индивидуальной аналитической методики, содержащей точные инструкции по проведению отдельного определения (рабочей прописи).
Рабочая пропись должна содержать подробное описание операции пробоотбора, пробоподготовки, порядка проведения измерений, перечня необходимых реактивов, данных об области определяемых концентраций и селективности, об источниках погрешности и точности анализа, о затратах времени на проведение анализа и его стоимости.
Независимо от метода любой химический анализ состоит из следующих стадий:
– пробоотбора;
– пробоподготовки;
– измерения (определения);
– оценки результатов.
Так как точность любой методики определяется максимальной погрешностью ее отдельных стадий, то для рациональной аналитической работы необходимо, чтобы относительные погрешности всех стадий были соизмеримы. Обычно лимитирующей точность анализа является стадия измерения. Поэтому переход от одного метода измерения к другому вызван прежде всего необходимостью повышения точности химического анализа. В частности, это является причиной перехода от колориметрического метода к фотометрии в рамках одной группы методов, базирующихся на поглощении (абсорбции) светового потока.
1.ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ АБСОРБЦИОННЫХ МЕТОДОВ ХИМИЧЕСКОГО АНАЛИЗА
Абсорбционные методы химического анализа (от лат. sarbeo – по-
глощаю) основаны на явлении ослабления светового потока при его прохождении через поглощающую среду. Поглощение света веществом проис-
ходит вследствие электронного возбуждения составляющих его атомов и мо-
3
лекул. Энергия квантов поглощаемого света – фотонов – равна разности энергий возбужденного и основного электронных состояний атомов (ионов). Следует отметить, что при поглощении света возбуждаются только электроны, находящиеся на внешних – валентных – орбиталях атомов. Кроме того, в молекулах и комплексах видимый свет может также возбуждать неспаренные электроны, π-электронные пары и d-электроны центрального атома.
Закон Ламберта–Бера. Рассмотрим однородное тело, на которое падает монохроматический поток излучения (монохроматическим называют излучение с определенной длиной волны). Интенсивность света, прошедшего через вещество, может быть определена на основании соотношения, впервые предложенного Бугером:
In(I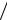 I0 ) = −kl,
I0 ) = −kl,
где I0 – интенсивность падающего пучка монохроматического светового из-
лучения, Вт/м2; I – интенсивность света, прошедшего через раствор, Вт/м2; k – константа; l – толщина поглощающего слоя. Отношение
T = I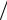 I0
I0
называют пропусканием, а
A= −lgT
–поглощением (оптической плотностью).
Несложными преобразованиями приведенных выражений можно вывести закон Ламберта:
A = lg(I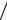 I0 ) = −lg(T ) = al,
I0 ) = −lg(T ) = al,
где А – оптическая плотность раствора, зависящая от длины волны падающего света и характеристик поглощающей среды; а – показатель поглощения раствора единичной концентрации.
Для смеси веществ величина а пропорциональна концентрации поглощающего вещества в растворе (закон Бера):
a = εc,
где ε – молярный десятичный коэффициент поглощения, в настоящее время чаще называемый коэффициентом экстинкции, в единицах СИ (ИЮПАК) выражается в м2/моль, в справочной литературе обычно используется единица измерения л/моль·см; с – концентрация поглощающего вещества, моль/л.
Комбинация последних двух выражений представляет собой закон Лам-
берта– Бера:
4
A = lg(I0 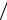 I ) = εcl.
I ) = εcl.
Данный закон справедлив только для разбавленных растворов, в которых концентрация определяемого вещества не превышает 0,01 моль/л, так как выполняется лишь при условии постоянства коэффициента преломления среды, значение которого зависит от концентрации веществ в растворе. Подобная зависимость коэффициента преломления приводит к нелинейности градуировочного графика при использовании абсорбционных методов для количественного химического анализа веществ в растворах.
2. КОЛОРИМЕТРИЯ
Колориметрией называется метод определения концентрации вещества в растворе по его окраске в видимой области спектра. Принцип колори-
метрии обычно используется в тест-методах контроля качества воды в полевых условиях.
Интенсивность окраски пробы при колориметрическом методе анализа визуально сравнивают с интенсивностью окраски ряда стандартных растворов известной концентрации. В качестве стандартов могут быть использованы и растворы одинаковой концентрации, но с разной толщиной поглощающего слоя. В соответствии с законом Ламберта–Бера для двух растворов одного и того же вещества в одном и том же растворителе при одинаковых значениях оптической плотности выполняется соотношение
c1l1 = c2l2,
где c1, c2 – концентрации поглощающего вещества в первом и втором раство-
рах; l1, l2 – толщина первого и второго поглощающих слоев соответственно.
Если известны значения c1 и l1 то, зная l2 , можно рассчитать c2.
|
|
Таблица 2.1 |
Дополнительные цвета в видимой области |
||
|
|
|
Поглощаемый свет |
Длина волны λ, нм |
Наблюдаемая окраска |
Фиолетовый |
40 |
Желто-зеленая |
Синий |
450 |
Желтая |
Сине-зеленый |
500 |
Красная |
Зеленый |
550 |
Пурпурная |
Желтый |
600 |
Синяя |
Оранжево-красный |
650 |
Сине-зеленая |
Красный |
700 |
Сине-зеленая |
Темно-красный |
750 |
Сине-зеленая |
5
Точность визуального колориметрического определения концентрации невелика – не превышает 5 %, но вследствие простоты и достаточно высокой чувствительности данного метода он часто применяется для определения следовых количеств веществ.
Для определения веществ со слабой собственной окраской их предварительно переводят в интенсивно окрашенные комплексы. Например, для идентификации иона Fe3+ в раствор добавляют роданид калия, что приводит к образованию внутримолекулярного комплекса роданида Fe(III), окрашенного в красный цвет:
Fe3+ + 3KCNS →[Fe(CNS)3 ] + 3K+ .
Следует отметить, что видимая окраска поглощающего вещества являет-
ся дополнительной к цвету поглощаемого веществом светового луча (табл. 2.1).
|
|
|
Таблица 2.2 |
|
Примеры колориметрического определения элементов |
||
|
|
|
|
Элемент |
|
Реагент |
Окраска |
AI(III) |
|
Оксихинолин |
Желтая |
Со(II) |
|
Роданид калия |
Синяя |
Сr(III) |
|
Перекись водорода |
Оранжевая |
Сu(II) |
|
Аммиак |
Интенсивно-синяя |
Fe(II) |
|
о-Фенантролин |
Темно-красная |
Fe(III) |
|
Роданид калия |
Красная |
Hg(II) |
|
Дитизон |
Оранжевая |
Мn(II) |
|
Периодат-ион |
Фиолетовая |
Ni(II) |
|
Диметилглиоксим |
Красная |
Pb(II) |
|
Дитизон |
Розовая |
Ti(II) |
|
Перекись водорода |
Желтая |
Zn(II) |
|
Дитизон |
Малиновая |
Некоторые варианты использования колориметрического метода для определения ионов металлов в водных растворах приведены в табл. 2.2.
3.ФОТОМЕТРИЯ
Внастоящее время измерение интенсивности окраски осуществляется не визуально, а с использованием различных приборов, которые позволяют проводить определения поглощения света определенной длины волны. Метод, в ко-
тором вместо белого света используется излучение определенной длины волны,
называется фотометрией. При фотометрических измерениях осуществляют сравнение интенсивности потоков падающего и прошедшего через поглощаю-
6
щее вещество света. Результаты измерений выражают в виде значений оптической плотности. Неизвестную концентрацию находят по градуировочному графику, построенному по результатам измерений оптических плотностей рас-
творов известных концентраций в координатах A = f (c). Относительная по-
грешность фотометрических методов анализа обычно не превышает 1…2 % Точность получаемых результатов сильно зависит от качества градуиро-
вочного графика. Поэтому к построению градуировочной зависимости предъявляют достаточно жесткие требования:
–число точек на градуировочной кривой должно быть достаточно большим (не менее 6–10);
–измерения проводят при постоянных условиях (температура, растворитель, кювета, влажность воздуха);
–диапазон концентраций на градуировочной кривой должен быть шире диапазона возможных концентраций определяемого вещества;
–для уменьшения систематических погрешностей в качестве холостого раствора необходимо использовать смесь реагентов;
–построение градуировочной кривой по данным градуировочных измерений необходимо осуществлять с использованием адекватных математических моделей зависимости оптической плотности от концентрации и соответствующих конкретному случаю методов математической обработки результатов измерений (выбор метода зависит от количества экспериментальных точек, степени прецизионности измерений и др.).
Погрешность фотометрических измерений значительно уменьшается при использовании метода «внутреннего эталона». Суть метода состоит в том, что к анализируемой пробе добавляют известное количество другого светопоглощающего вещества – внутреннего эталона – и строят градуировочную зависимость отношения значения оптической плотности определяе-
мого вещества к значению оптической плотности внутреннего эталона от
концентрации определяемого вещества Другим способом уменьшения погрешности фотометрического определе-
ния количества вещества в растворе является использование метода добавок. Данный метод основан на том факте, что в первом приближении оптическая плотность смеси различных веществ является величиной аддитивной. В этом
случае становится возможным фотометрическое определение одновременно нескольких компонентов. Для двухкомпонентных смесей проводят измерения
7

при двух различных длинах волн. Разрешая получающуюся при этом систему
двух уравнений с двумя неизвестными – концентрациями c(1) и c(2) :
Aλ1 = ε(1)λ1c(1)l + ε(2)λ1 c(2)l,
Aλ2 = ε(1)λ2c(1)l + ε(2)λ2 c(2)l,
можно найти значение определяемой концентрации вещества в растворе. Фотометрия используется также для индикации конечной точки титрова-
ния (фотометрическое титрование). Преимущества фотометрического метода по сравнению с визуальной индикацией определяются большей точностью анализа и возможностью использования ультрафиолетовой области спектра.
4. УСТРОЙСТВО СПЕКТРОФОТОМЕТРОВ
Принцип работы прибора. Приборы для измерения оптической плотности называют спектрофотометрами. Принципы спектрофотометрического метода технически реализованы в различных модификациях спектрофотометров и фотоколориметров (фотоэлектроколориметров). Ниже приведена упрощенная оптическая схема работы спектрофотометра:
1 –источникизлучения;2–регуляторинтенсивностиизлучения;3–монохроматор (призма,дифракционнаярешетка,светофильтр);4–кюветноеотделение,дляпомещения образцов;5–детектор(фотоэлемент,термоэлемент);6 –усилительсигнала;
7 –регистрирующееустройство(визуальное,графическое,цифровое,компьютерное)
Белый свет от источника проходит последовательно через щель, моно-
хроматор (призма, дифракционная решетка или светофильтр), измеритель-
ную ячейку (кювету с анализируемым образцом или образцом сравнения) и
попадает на детектор излучения (фотоэлемент). В детекторе происходит пре-
образование светового сигнала в электрический, который через усилитель подается на регистрирующее устройство. Результаты измерений выражают в виде значений оптической плотности или в процентах пропускания как функции длины волны или волнового числа излучения.
Для уменьшения систематических погрешностей принято использовать при фотометрировании кварцевые кюветы.
8
Модели современных спектрофотометров очень разнообразны. В зависимости от поставленных задач (анализ растворов, суспензий, кристаллических или полимерных объектов, биологических образцов) используются как приборы с однолучевой, так и с двухлучевой схемами. Однолучевые спектрофотометры уступают двухлучевым по своим характеристикам, на результатах измерения спектров называется нестабильность светового излучения ламп, чувствительности ФЭУ и электронной системы усиления фототока. Особенность двухлучевой схемы состоит в том, что луч с помощью системы зеркал делится на два когерентных потока, один из которых проходит через анализируемое вещество, а второй служит для сравнения. Такая схема позволяет получить более точные и устойчивые результаты. Это объясняется тем, что измерение в данном варианте приборов осуществляется по разностной схеме. Детектор измеряет разность энергий световых потоков – прошедшего через пробу и потока сравнения. Помехи, связанные с колебаниями внешних – атмосферных – воздействий и нестабильностью работы аппаратуры, при этом взаимно компенсируются.
|
Таблица 4.1 |
Фотоколориметры и спектрофотометры |
|
|
|
Наименование прибора |
Описание/технические характеристики |
Спектрофотометр ПЭ 5300ВИ |
Спектральный диапазон – 325…1000 нм |
Спектрофотометр ПЭ 5400ВИ |
Спектральный диапазон – 325…1000 нм |
Спектрофотометр ПЭ 5400УФ |
Спектральный диапазон – 325…1000 нм |
Спектрофотометр ПЭ 3000УФ |
Спектрофотометр однолучевой, сканирующий, |
|
до 3000 нм/мин |
Спектрофотометр ПЭ 3200С/УФ |
Спектрофотометр однолучевой, сканирующий, |
|
до 3000 нм/мин |
Спектрофотометр ПЭ 6100УФ |
Спектрофотометр двухлучевой, сканирующий, |
|
до 3000 нм/мин |
Фотоколориметр КФК -5М ЗОМС |
Малогабаритный, полевой (питание 220/12 В) |
Фотоколориметр КФК-3-01 ЗОМС |
Фотометр фотоэлектрический (спектрофотометр) |
|
Спектральный диапазон – 315…990 нм. Вариан- |
|
ты исполнения: КФК-3-01-«ЗОМЗ» – базовая мо- |
|
дель; КФК-3-02-«ЗОМЗ» – с термостатируемым |
|
кюветным отделением; КФК-3-03-«ЗОМЗ» – с |
|
проточной кюветой с насосом и внешним термо- |
|
статом для подготовки проб |
Спектрофотометр ЮНИКО1201 |
Спектральный диапазон – 325…1000 нм. Одно- |
(КФК 3 КМ) |
лучевые фотометры с переменной длиной волны |
|
видимого диапазона 325…1000 нм, встроенное |
|
кюветное отделение с 3-позиционным держате- |
|
лем для кювет российского производства (стан- |
|
дарта КФК); встроенный порт RS232 для работы |
|
с компьютером |
9
|
Окончание табл. 4.1 |
|
|
Наименование прибора |
Описание/технические характеристики |
Спектрофотометр ЮНИКО 2100 |
Спектральный диапазон – 325…1000 нм. Однолуче- |
|
вые фотометры с переменной длиной волны види- |
|
мого диапазона 325…1000 нм, встроенное кюветное |
|
отделение с 3-позиционным держателем для кювет |
|
российского производства (стандарта КФК); встро- |
|
енный порт RS232 для работы с компьютером |
Спектрофотометр ЮНИКО 2800 |
Спектрофотометр однолучевой, сканирующий, |
|
190…1100 нм, –0,3…3 А, 4 нм, 5…50 мм. Скани- |
|
рующий спектрофотометр ультрафиолетового и |
|
видимого (190…1100 нм) диапазонов, графический |
|
дисплей с выводом спектра и встроенная память; |
|
возможность автономной работы без подключения |
|
к компьютеру; встроенное кюветное отделение с |
|
3-позиционным держателем для кювет российского |
|
производства (от КФК) размером до 100 мм; смен- |
|
ный 4-позиционный держатель для кювет 10×10 мм |
|
в комплекте с 2 кварцевыми кюветами; встроенный |
|
порт RS232 для работы с компьютером |
Спектрофотометр ЮНИКО 2802 |
Спектрофотометр однолучевой, сканирующий, |
|
190…1100 нм, –0,3…3 А, 1,8 нм, 5…50 мм |
Спектрофотометр ЮНИКО 2802S |
Спектрофотометр однолучевой, сканирующий, |
|
190…1100 нм, –0,3…3 А, сменные, 5…50 мм |
Спектрофотометр ЮНИКО 2804 |
Спектрофотометр двухлучевой, сканирующий, |
|
190…1100 нм, –0,3…3 А, 1,8 нм, 5…100 мм |
Спектрофотометр СФ -56 |
Однолучевой спектрометр УВИ-диапазона. Спек- |
|
тральный диапазон – 190…1100 нм |
Спектрофотометр СФ 103 |
Однолучевой сканирующий спектрофотометр, ра- |
|
ботающий в ультрафиолетовом (УФ) и видимом |
|
(190…1100 нм) диапазонах длин волн. Автомати- |
|
ческий программно-управляемый держатель на |
|
8 кювет позволяет производить калибровку (до |
|
7 точек) нажатием одной кнопки. Данные двух по- |
|
следних калибровок автоматически заносятся в па- |
|
мять спектрофотометра и могут быть отображены |
|
на графическом дисплее. Возможно подключение |
|
термостатируемой ячейки и проточных кювет объ- |
|
емом 1,8 мл и 80 мкл. Полученный спектр выво- |
|
дится на графический ЖК-дисплей и может быть |
|
распечатан на термопринтере (при его наличии) |
|
либо передан в компьютер через порт RS232 (при |
|
наличии программного обеспечения) |
Спектрофотометр СФ-2000 |
Однолучевой спектрометр УВИ-диапазона. Спек- |
|
тральный диапазон – 190…1100 нм |
Спектрофотометр СФ-2000 -2 |
Однолучевой спектрометр УВИ-диапазона Спек- |
|
тральный диапазон – 190…1100 нм |
Спектрофотометр SPEKOL 1300 AJ |
УФ–ВИД однолучевой спектрометр. Возмож- |
с УФ фильтром. |
ность использования кювет от 10 до 100 мм. |
|
Спектральный диапазон – 190…1100 нм |
10
