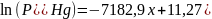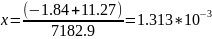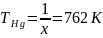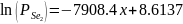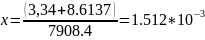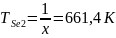- •Аннотация
- •Содержание
- •Введение
- •Описание структуры, свойств и применения селенида ртути
- •Описание селенида ртути
- •Исходные данные
- •Анализ синтеза соединения HgSe из газообразных компонентов
- •Расчет термодинамических величин для основного процесса
- •Определение температурного диапазона синтеза соединения HgSe
- •Анализ процессов сублимации и испарения исходных компонентов
- •Анализ процесса испарения Hg
- •Анализ процесса сублимации Se
- •Построение p-t-диаграмм
- •Определение термодинамических условий проведения процесса
- •Оценка возможности окисления компонентов
- •Заключение
- •Список литературы
Определение термодинамических условий проведения процесса
Для определения температур в реакторе решим систему уравнений:
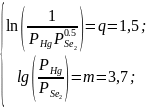
где q – значение натурального логарифма константы равновесия в рабочей точке, обеспечивающее протекание процесса в прямом направлении (пункт 2); m – значение логарифма отношения реальных давлений, обеспечивающих образование n-типа электропроводности (пункт 4).
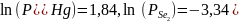
Используя расчеты из п.3, найдем температуры дополнительных источников:
|
|

Рис. 8. Распределение температур в реакторе
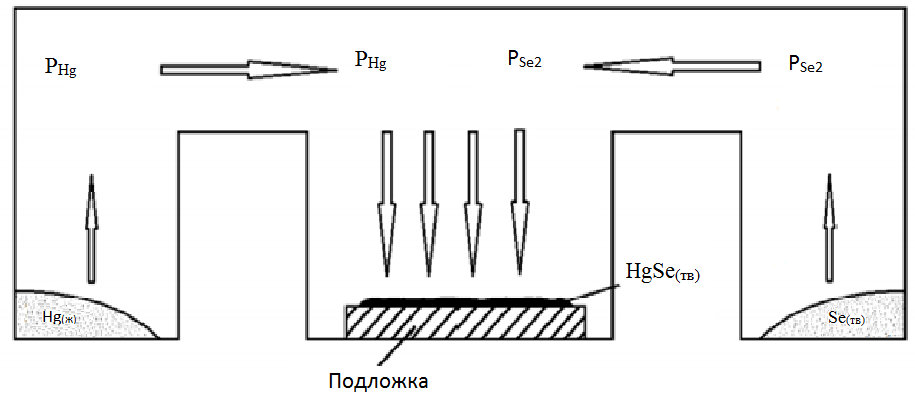
Рис. 9. Схема реактора
Оценка возможности окисления компонентов
В атмосфере реактора неизбежно будет присутствовать кислород, который окислит вещества, участвующие в реакции. Рассмотрим окисление ртути. Поскольку процесс окисления нежелателен, задача анализа состоит в поиске условий, при которых процесс окисления становится термодинамически невыгоден, т. е. изменение свободной энергии Гиббса положительно.
Процесс окисления ртути соответствует химической реакции:
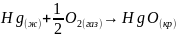
Рассчитываем термодинамические функции:
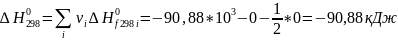
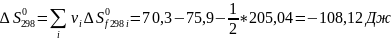
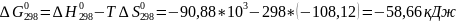


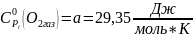 ;
;
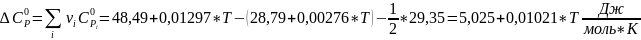
Для T=494 К:
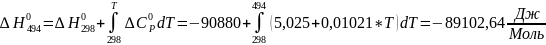 ;
;
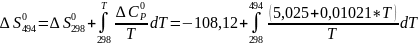
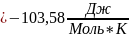


Таблица 6: Значения рассчитанных термодинамических величин
T,K |
dH,дж/моль |
dS,дж/(моль*K) |
dG,дж/моль |
ln(kp4) |
298 |
-90880 |
-108,12 |
-58660,24 |
23,688 |
494 |
-89102,64 |
-103,58 |
-37934,62 |
9,24 |
843 |
-84996,86 |
-97,33 |
-2917,51 |
0,416 |
1043 |
-82036,25 |
-94,22 |
16233,56 |
-1,873 |
Реакция
окисления будет происходить при Δ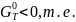
 ;
;
При максимальной откачке давление кислорода в реакторе
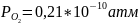 ,
при атмосферных условиях давление
кислорода в реакторе составляет 0,21 атм.
,
при атмосферных условиях давление
кислорода в реакторе составляет 0,21 атм.
;
;

Рис. 10. Анализ условий окисления компонента Hg в реакторе
Из графика видно, что для TA=762 K существует диапазон значений lnkp4: от 1,631 до 12,29, при котором выполняется условие ΔG>0. Избежать окисления можно, откачав воздух до любого значения lnkp4 из этого диапазона.
Заключение
В ходе выполнения данной курсовой работы:
1. Были выбраны термодинамические параметры компонентов реакции и конечного соединения HgSe. (пункт 1)
2. Анализировали основной процесс и выбрали условия, при которых он реализуется (рабочая точка (1/843;1,5)). Определили зависимость константы равновесия от температуры. (пункт 2)
3. Для определения температур в зонах сублимации компонентов Hg и Se2 проводился термодинамический анализ процессов сублимации каждого из компонентов. Так же была получена зависимость константы равновесия от температуры. (пункт 3)
4. На основании расчетов равновесий трех приведенных процессов (сублимация Hg и Se, образование HgSe) были построены P-T диаграммы для соединения HgSe в виде линий трехфазных равновесий в системе. При решении систем уравнений нашли значения давления компонентов на границах области гомогенности и на линии стехиометрии. (пункт 4).
5. Для создания n-типа электропроводности оценили диапазон отношения давления в пределах области гомогенности фазы HgSe при температуре основного процесса ТHgSe =843 К и выбрали необходимое соотношение давлений компонентов. (пункт 4)
6. Опираясь на результаты 2 и 4 пункта определили парциальные давления паров Hg и Se, а также нашли температуры дополнительных источников опираясь на пункт 3. (пункт 5)
7. При оценке возможности окисления Hg получили, что процесса окисления можно избежать, откачав воздух до давления из диапазона 1,631<lnkp4<12.29. (пункт 6)
Таким образом, на основании проделанной работы можно синтезировать соединения HgSe n-типа электропроводности при использовании необходимого оборудования и рассчитанных в работе данных.