
- •Аннотация
- •Содержание
- •Введение
- •Описание структуры, свойств и применения селенида ртути
- •Описание селенида ртути
- •Исходные данные
- •Анализ синтеза соединения HgSe из газообразных компонентов
- •Расчет термодинамических величин для основного процесса
- •Определение температурного диапазона синтеза соединения HgSe
- •Анализ процессов сублимации и испарения исходных компонентов
- •Анализ процесса испарения Hg
- •Анализ процесса сублимации Se
- •Построение p-t-диаграмм
- •Определение термодинамических условий проведения процесса
- •Оценка возможности окисления компонентов
- •Заключение
- •Список литературы
Исходные данные
Таблица 1
|
|
|
cp |
ΔHпл, кДж/моль |
Тпл, К |
Литература |
|
а, Дж/моль·К |
b*10^-3, Дж/моль·К2 |
||||||
Hg(газ) |
61,4 |
174,85 |
20,79 |
0 |
- |
- |
1* |
Se2(газ) |
136,7 |
243,6 |
43,73 |
0 |
- |
- |
1* |
HgSe(тв) |
-54 |
104,6 |
48,95 |
0 |
- |
1043 |
1* |
Hg(жид) |
0 |
75,9 |
28,79 |
2,76 |
- |
234 |
1* |
Se(тв) |
0 |
42,3 |
17,89 |
25,1 |
5,4 |
494 |
1* |
О2(газ) |
0 |
205,04 |
29,35 |
0 |
- |
- |
1* |
HgО(тв) |
-90,88 |
70,3 |
48,49 |
12,97 |
- |
- |
1* |
Литература:
1*: «Thermochemical Data of Elements and Compounds» M. Binnewies, E. Mike.
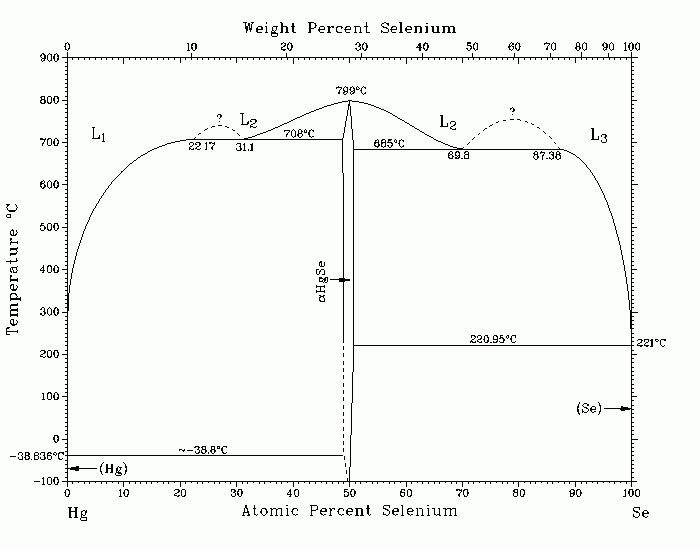
Рис. 2. T-x проекция диаграммы состояния системы Hg-Se
Анализ синтеза соединения HgSe из газообразных компонентов
Расчет термодинамических величин для основного процесса
Реакция:
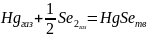
Примеры расчёта:
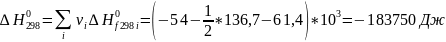 ;
;
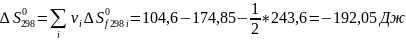 ;
;
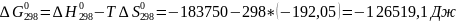 ;
;
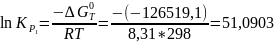 ;
;
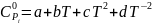 ;
;


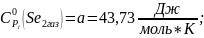
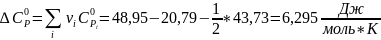 ;
;
Для T=494 К:
 ;
;
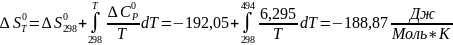 ;
;
 ;
;
Таблица 2: Значения рассчитанных термодинамических величин
T,K |
|
S, Дж/(моль*K) |
G, Дж/моль |
ln(kp1) |
T=298 |
-183750 |
-192,05 |
-126519,1 |
51,0903 |
Т=ТплSe=494 |
-182516,2 |
-188,87 |
-89215,27 |
21,733 |
Т=ТрабHgSe =843 |
-180319,225 |
-185,5 |
-23939,36 |
3,42 |
Т= ТплHgSe =1043 |
-179060,225 |
-184,16 |
13022,68 |
-1,502 |
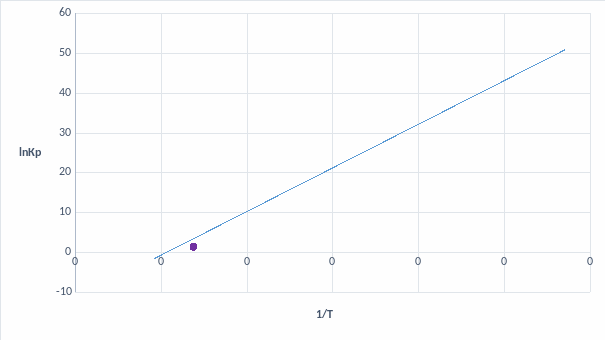
Рис. 3. Анализ возможности протекания процесса и выбор рабочей точки
Определение температурного диапазона синтеза соединения HgSe
Диапазон синтеза соединения HgSe равен 70-90% от
 :равновесие
от 730,1 К до 938,7 К.
:равновесие
от 730,1 К до 938,7 К.
Выберем рабочую температуру
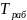 = 843 К
= 843 КУсловия протекания процесса:
Равновесие в системе (
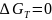 ):
):
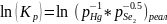
Протекание процесса в прямом направлении (
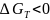 ):
):

Невозможность протекания процесса в прямом направлении (
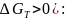

Для обеспечения
протекания процесса в прямом направлении
выберем рабочую точку:
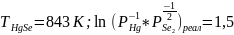 ,
,
Анализ процессов сублимации и испарения исходных компонентов
Анализ процесса испарения Hg
Испарение Hg рассматривается при температуре от 298 К до температуры Т, ограничивающейся температурой плавления соединения HgSe. На этом промежутке Hg не испытывает полиморфное превращение (не плавится), поэтому при расчете изменения свободной энергии Гиббса для любой температуры Т достаточно использовать полученные выше формулы для случая системы, не испытывающей фазовый переход:
Примеры расчета:
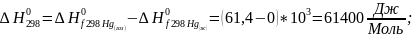
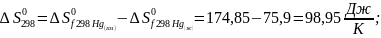
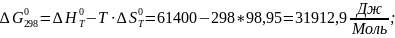

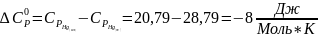
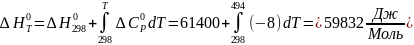 ;
;
 ;
;
 ;
;
Таблица 3: Значения рассчитанных термодинамических величин для вспомогательного процесса(испарения)
T,K |
H, Дж/моль |
S, Дж/(моль*K) |
G, Дж/моль |
ln(kp2) |
T=298 |
61400 |
98,95 |
31912,9 |
-12,887 |
Т=ТплSe=494 |
59832 |
94,91 |
12948,21 |
-3,154 |
Т=ТрабHgSe =843 |
57040 |
90,63 |
-19361,94 |
2,764 |
Т= ТплHgSe =1043 |
55440 |
88,93 |
-37311,8 |
4,305 |
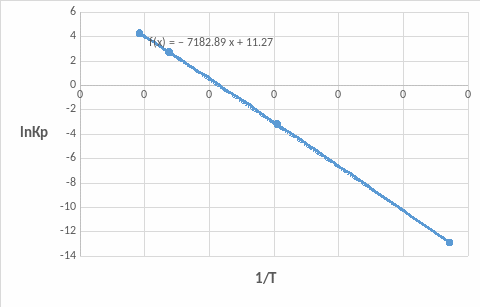
Рис. 4. Температурная зависимость равновесных давлений паров Hg
Выбираем расчетную температуру кипения Hg: Tрасч=625 K
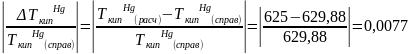
Погрешность получившейся температуры составляет 0,7%

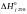 ,
кДж/моль
,
кДж/моль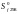 ,
Дж/моль·K
,
Дж/моль·K H,
Дж/моль
H,
Дж/моль