
лаба 6. Standartizatsia_rastvora_nitrata_serebra_po_metodu_Moru
.docxРабота 5. Стандартизация раствора нитрата серебра по методу Мору.
В основе метода Мора лежат следующие реакции:
Ag+ + Cl- ↔ AgCl
2Ag+
+
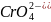 ↔ Ag2CrO4
↔ Ag2CrO4
Посуда и реактивы: химический штатив; бюретка вместительностью 25 мл; конические колбы для титрования (3 шт.); пипетка Мора вместительностью 10 мл; химические стаканы вместительностью 100 мл (2 шт.).
Хлорид натрия, NaCl, 0,0500 М.
Индикатор: хромат калия, K2CrO4, насыщенный раствор.
Нитрат серебра, AgNO3,0,0500 M стандартный раствор.
Ход работы.
Номер колбы |
Объем раствора, NaCl, мл |
Объем AgNO3, пошедший на титрование, мл |
Концентрация раствора AgNO3, моль/л |
T(AgNO3/Cl) |
1 |
10,0 |
10 |
0,050 |
0,001700 |
2 |
10,0 |
11 |
0,045 |
0,001600 |
3 |
10,0 |
9,5 |
0,052 |
0,001800 |
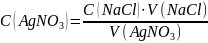
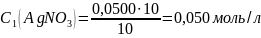
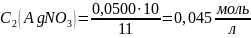
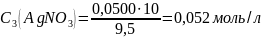
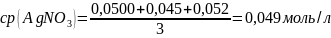
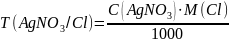
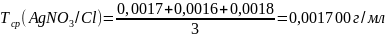
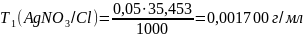
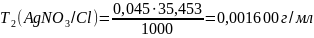
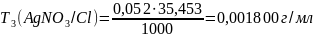
Оценка на наличие грубых ошибок:
Вывод: в ходе лабораторной работы была проведена стандартизация раствора нитрата серебра по методу Мора. Была найдена концентрация раствора нитрата серебра, которая равна 0,049 моль/л и найден титр раствора нитрата серебра по хлору, равный 0,001700 г/мл.
Работа 6. Определение ионов хлора по методу Мора.
Номер колбы |
Объем раствора NaCl, мл |
Объем AgNO3, пошедший на титрование, мл |
Содержание хлорид-ионов в анализируемом растворе, г |
1 |
10,0 |
9,5 |
0,1615 |
2 |
10,0 |
9,5 |
0,1615 |
3 |
10,0 |
9,6 |
0,1632 |
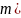
г
г
Оценка на наличие грубых ошибок:
Вывод: в ходе работы была определена масса ионов хлора, которая составила 0,1620 г и была проведена оценка на наличие грубых ошибок.
