
Алкилирования ароматических углеводородов
.pdf
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Содержание
Лист
Введение
I. Процессы гидрирования и дегидрирования
1.1. Теоретические основы процессов гидрирования и дегидрироиания. 1.2. Лабораторная работа №1. Дегидрирование этилбензола в стирол.
1.3. Лабораторная работа №2. Дегидрирования циклогексанола в циклогексанон. II. Процессы алкилирования
2.1.Реакции алкилирования. Алкилирования ароматических углеводородов спиртами в присутствии серной кислоты.
2.2.Лабораторная работа №3. Алкилирование бензола толуола бензоловым спиртом.
III. Процессы окисления
3.1.Реакции окисления. Окисление по двойной связи. Окисление первичных и вторичных спиртов, до альдегидов или кетонов. Окисление альдегидов и кетонов до кислот. Получение хинонов окислением.
IV. Процессы этерификации, гидролиза, гидратации, дегидратации
4.1.Сущность и значение процессов этерификации, гидратации, дегидратации.
4.2.Лабораторная работа №4. Гидратация ацетилена.
V Процессы присоединения конденсации по карбонильной группе
5.1.Лабораторная работа №5. Получение бензойной кислоты.
5.2.Лабораторная работа №6. Получение бензинового спирта. VI. Процессы сульфирования и сульфатирования
6.1.Реакции сульфирования. Сульфирование ароматических соединений.
6.2.Лабораторная работа №7. Получение 2- нафталинсульфокислоты. Вывод.
Литература

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Введение
Нефтеперерабатывающая и нефтехимическая промышленность вырабатывает самые разнообразные продукты: газообразное и жидкое топливо, смазочные и специальные масла, консистентные смазки, битумы, сажу, парафин, нефтяные кислоты, кокс, синтетические спирты, синтетические жирные кислоты, продукты полимеризации, ароматические углеводороды, ацетон, фенол и многие другие, технические и химические продукты.
Требования ко всем этим продуктам исключительно разнообразны и диктуются постоянно изменяющимися условиями применения или эксплуатации того или иного конкретного нефтепродукта.
Основная задача технического анализа в нефтегазоперерабатывающей промышленности — наиболее полно и четко охарактеризовать необходимые химические, физические и эксплуатационные свойства конечных продуктов производства, с учетом специфических особенностей их назначения и применения.
Не менее важной задачей технического анализа является производственнотехнологическая оценка исходного сырья: сырой нефти, дистиллятных и остаточных нефтяных продуктов, природного, попутного и промышленных углеводородных газов. Производственно технологическая оценка проводится главным образом по физикохимическим показателям, характеризующим состав и свойства сырья.
Взадачи технического анализа в нефтегазоперерабатывающей промышленности входит также определение состава и свойств катализаторов, технической воды и ряда вспомогательных материалов и реагентов.
Втехническом анализе перечисленных выше весьма разнообразных продуктов применяются следующие способы, методы и приемы исследования.
Химические; использующие классические приемы качественного и главным образом количественного объемного, газометрического и реже весового методов анализа, а также современные методы с применением комплексонов и органических реактивов.
Физические: определение плотности, теплоты сгорания, вязкости, температуры плавления, температуры замерзания, температуры кипения; определение малакометрических характеристик смазок и битумов (пенетрация, дуктильность); разнообразные методы разделения, базирующиеся на применении экстракции, перегонки, ректификации, кристаллизации и других физических методов.
Физико-химические: колориметрия, потенциометрическое титрование, нефелометрия, рефрактометрия, спектроскопия, газовая и жидкостная хроматография.
Специальные методы испытания различных эксплуатационных свойств или состава анализируемого продукта, К этой группе следует отнести такие методы и способы анализа
ииспытания, которые как бы моделируют обстановку и условия, в которых используется или работает тот или иной нефтепродукт, и фиксируют его поведение в этих условиях. К подобного рода определениям относятся, например, определение моторных свойств жидкого топлива (октановое число, цетановое число, сортность), химической стабильности топлив и масел в условиях ускоренного окисления, термоокислительной стабильности и моющих свойств смазочных масел для двигателей внутреннего сгорания, индекса активности катализаторов, а также испытание на коррозию нефтепродуктов и некоторые другие.
Для проведения анализов и установления качества нефтепродуктов всеми указанными методами созданы многочисленные и разнообразные приборы и установки, которые в большинстве требуют ручного управления.
Однако в последние годы и в области лабораторного «контроля стали довольно широко применяться средства автоматизации, как для проведения самого анализа, так и для фиксации его результатов. Особенно это относится к методам газоадсорбционной и газожидкостной хроматографии.

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
В настоящее время уже разработаны и внедряются в практикозаводских лабораторий автоматизированные анализаторы для определения основных качественных показателей нефти и нефтепродуктов: фракционного состава, температуры помутнения, кристаллизации и застывания, температуры вспышки, содержания воды и др.
Приступая к изучению технического анализа, необходимо иметь ясное представление о целях и задачах этой дисциплины и о тех Необходимых условиях, которые должны обеспечить получение достоверных и точных результатов при практическом выполнении тех или иных анализов и определений.
Одной из главных целей изучения курса технического анализа является получение четких представлений о том, какие физикохимические и специальные показатели характеризуют тот или иных. Продукт и каковы их относительная ценность и значение.
Еще более важно выяснить глубокие причинные связи между качественными показателями конечных продуктов производства и поведением их в реальных условиях эксплуатации и применения. Такой товароведческий подход позволит в конечном итоге более глубоко оценить важность борьбы за качество продуктов нефтепереработки и нефтехимического синтеза и необходимость внедрения передовой технологии и новых прогрессивных методов переработки нефтяного и газового сырья.
Непосредственными задачами практического обучения в лаборатории технического анализа является изучение теоретических основ и аппаратурного оформления основных определений и освоение методики их практического выполнения.
Достоверность, точность и воспроизводимость результатов анализов и технических испытаний в практических условиях производственного предприятия зависят от разнообразных факторов, в том числе и от прочных навыков у экспериментаторов. Однако
впервую очередь здесь надо обращать внимание на следующие моменты:
1.Проба испытуемого продукта, поступившая на анализ, должна быть отобрана с соблюдением всех положений соответствующих правил и инструкций. Особенно важно, чтобы при маркировочных анализах, когда устанавливается соответствие состава и свойств данной партии анализируемого продукта требованиям ГОСТа или технических условий, проба, поступающая на анализ, была действительно средней, а не случайной.
2.Перед проведением анализа или испытанием анализируемый продукт должен быть подготовлен в соответствии с требованиями методики (обезвоживание, фильтрование, нагрев, охлаждение, измельчение, перемешивание и т. д.). Невыполнение этих простых операций может полностью обесценить результаты анализа.
3.Метод анализа, выбранный для данного конкретного продукта и определения, должен быть либо рекомендован ГОСТом или техническими условиями, либо предварительно проверен в нескольких лабораториях, как на искусственных смесях, так и на реальных продуктах. Если представляется возможность выбора, то всегда надо останавливаться на более простых и доступных методах и на тех, где влияние различных внешних факторов (чистота реактивов и т. п.) на точность анализа менее значительно. Для методов внутрицеховых экспресс - анализов главные достоинства — это простота аппаратуры и методики и быстрота выполнения. Для методов анализа, выполняемых в центральных заводских лабораториях, на базах, складах и тем более в научноисследовательских институтах, на первый план выступает уже не быстрота, а точность и воспроизводимость результатов.
4.При проведении практической работы по анализу или специальному испытанию необходимо строго и точно придерживаться всех без исключения указаний ГОСТов или апробированных прописей данной методики.
5.Подсчеты результатов анализа следует проводить с точностью, предусмотренной в ГОСТе или прописи и обеспеченной точностью соответствующих измерений.

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
I. Процессы гидрирования и дегидрирования
1, 1 Теоретические основы процессов гидрирования и дегидрирования
ГИДРИРОВАНИЕ (гидрогенизация), присоединение Н2 к орг. соединениям (обратная реакция наз. дегидрированием). Гидрирование и дегидрирование связано подвижным равновесием, положение которого определяется темп-рой и давлением H2. Гидрирование обычно происходит при сравнительно низких температурах (20-200 °С), дегидрирование - при более высоких. Повышение давления благоприятствует гидрированию.
Обычно гидрирование осуществляют в условиях гетерогенного или гомогенного катализа. В промышленности наиболее распространено гетерогенное гидрирование молекулярным водородом. При этом Hi, активированный катализатором, ступенчато присоединяется к субстрату; стадией, лимитирующей скорость гидрирования, обычно является перенос водорода на субстрат. Катализаторы - химические элементы с недостроенными d-оболочками, чаще всего металлы VIII гр. периодической системы, оксиды и сульфиды металлов, а также многокомпонентные катализаторы.
При гетерогенное гидрировании увеличение числа и объема заместителей при кратной связи приводит к затруднению координации соединений с повышенностью катализатора и доступа к нему Н2. Скорость гидрирования часто определяется природой гидрируемой связи. Достаточно легко гидрируются ацетилены, олефины, нитросоединения, труднее ароматические углеводороды, альдегиды, кетоны, карбоновые кислоты и их производные (см. табл.). Недостаток процесса - невысокая селективность вследствие протекания побочных реакций крекинга, гидрогенолиза и т.н.
Условие каталитического дегидрирования различных органических соединений
При гомогенном гидрировании активация водорода и субстрата происходит путем их включения в координационную сферу каталитического комплекса. При этом идет гетеролитическая или гомолитическая диссоциация водорода, что и создает условия для гидрирования. Связь субстрата с атомом металла катализатора должна быть достаточно

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
лабильной. Алкены, образующие слишком прочные связи, не гидрируются в этих условиях. В качестве катализаторов используют соединения переходных металлов: соли, карбонилы, фосфиновые комплексы, двухкомпонентные системы, получаемые взаимод. солей с восстановителями или комплексообразователями (напр., катализаторы Циглера - Натты). Вследствие большей активности катализаторов и соответственно более мягких условий гомогена. Гидрирование обычно более избирательно, чем гетерогенное. Важная область применения таких процессов - синтез оптически активных веществ, например гидрирование фенилакриловой кислоты, катализируемое комплексами RhCl3 с фосфинами и проводимое в смеси бензол-этанол.
В органическом синтезе широко используется некаталитические гомогенны гидрирования. Доноры водорода в этом случае - металлы в спиртах, кислотах, аммиаке и аминах; комплексные гидриды металлов (например, Na[BH4], Li(АlН4)), бораны. При некаталитическом гидрировании первоначально идет атака нуклеоф. агента (электрона или гидрид - иона) по месту наименьшей электронной плотности в молекуле ненасыщенного соединения с последним присоединением протона. При этом поляризованные двойные связи гидрируются легче неполяризованных.
Ионное гидрирование основано на способности гидрируемого соединения присоединять протон с образованием активного промежуточного иона карбения, который в свою очередь отрывает гидрид-ион от подходящего донора. Обычно донорами протонов служат сильные кислоты, например трифторуксусные, донорами гидрид-ионов - триалкилсиланы, жирно-ароматич. или неполностью гидрированные ароматические углеводороды. Ионное гидрирование используют для восстановления некоторых гетероциклических соединении - производных тиофена, фурана, индола.

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
1.2. Лабораторная работа №l
Дегидрирование этилбензола в стирол
Цель работы — практическое воспроизводство процесса получения стирола каталитическим дегидрированием этилбензола с определением выхода стирола в зависимости от применяемого катализатора и условий процесса.
Порядок выполнения лабораторной работы.
Вкачестве реактора применяется фарфоровая трубка, помещаемая в электрическую печь. В реакционную трубку помещается катализатор. Последний приготавливается путем пропитки окисла одного элемента (ZnO или AI2O3) раствором азотнокислой соли другого (Сг203 и др.).
Получающаяся тестообразная масса просушивается и прокаливается до прекращения выделения окислов азота. Образующаяся после прокаливания пористая масса дробится, загружается в реакционную трубку.
Для подачи этилбензола в реакционную печь служит специальная бюретка. По выходе из реакционной печи продукты дегидрирования проходят холодильник и высококипящие фракции (в том числе стирол), конденсирующиеся в первую очередь, собираются
вприемнике. Не сконденсировавшиеся в первом холодильнике продукты дегидрирования поступают в абсорбер, наполненный активированным углем.
Дегидрирование в присутствии катализаторов с Al2O3, проводится при температуре не выше 625°. Выше этой температуры наблюдается глубокое разложение этилбензола с выделением газообразных углеводородов и значительным отложением угля на катализаторе. При дальнейшем повышении температуры дегидрирования резко возрастает также и количество высококипящих продуктов уплотнения, образующихся при реакции.
Вприсутствии катализаторов с Cr2O3-j-MgO процесс дегидрирования ведется при
650°.
Опыт осуществляется при скорости подачи этилбензола равной 0,9—1 г/мин на 100 смЗ катализатора.
Впроцессе каталитического дегидрирования этилбензола наряду с твердыми, жидкими высококипящими продуктами уплотнения и газообразными углеводородами, образующимися вследствие протекания побочных реакций, получается и некоторое количество углеводородов, кипящих при более низкой температуре по сравнению с температурой перегонки этилбензола. Так, если первая капля конденсата при перегонке этилбензола получается, например, при 130°, то при перегонке продуктов дегидрирования первая капля конденсата появляется уже при 123°.
По окончании опыта определяют содержание стирола в конденсате продукта дегидрирования бромированием непредельной связи.
Определение содержания стирола в полученных конденсатах производится по количеству брома, пошедшего на реакцию бромирования стирола.
Титрованный 0,1 н раствор брома готовится на водном растворе КВг.
При отсутствии в смеси большого количества полимера навеску в 0,2—0,25 г стирола 1 вносят в колбу с притертой пробкой емкостью 250—300 смЗ, приливают из бюретки 30—35 смЗ, титрованного раствора брома, взбалтывают и оставляют стоять в течение 5—10 минут. После этого прибавляют 10—15 смЗ 10% раствора йодистого калия и столько же воды, перемешивают и спустя 5—10 мин. оттитровывают выделившийся иод 0,1 н раствором гипосульфита натрия, приливая к концу титрования раствор крахмала в качестве индикатора.

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Краткие сведения о процессе
Стирол, Q,IIo—СН=СН2, иначе называемый фенил-этиленом и винилбензолом, представляет собой бесцветную жидкость с удельным весом (при 20°) 0,906 и кипящую при 145,2°.
Благодаря наличию винильной группы стирол полимеризуется, образуя при продолжительном стоянии (скорее на свету) весьма твердую прозрачную массу, так называемый полистирол. Полимеризация стирола ускоряется в присутствии перекиси водорода или органических перекисных соединений.
В последнее время стирол получил весьма большое значение в качестве полупродукта для производства прозрачных пластических масс, отличающихся большой твердостью и химической стойкостью, и для получения различных сортов синтетического каучука (совместной полимеризацией стирола с дивинилом).
Полистирол легко растворим в различных углеводородах. Растворы полистирола в органических растворителях применяют для изготовления пленок.
Термопластичность стирола позволяет использовать его для прессования изделий. Полистирол обладает высокими диэлектрическими свойствами, вследствие чего он широко применяется в качестве электроизоляционного материала.
Существуют различные методы получения стирола. Из них наиболее важным в промышленном отношении является получение стирола по методу Залькинда — из этилбензола как наиболее доступного исходного материала. Последний получается алкилированием бензола этиленом в присутствии хлористого алюминия по уравнению:
Известны и другие катализаторы, пригодные для осуществления этой реакции — как-то: HF, BF3 так называемая «твердая фосфорная кислота» (фосфорная кислота, нанесенная на кизельгур, в количестве 62—63% Р205) и др.
Ю. С. Залькиндом разработаны два метода получения стирола из этилбензола:
1)через метилфенилкарбинол: этилбензол хлорируют и образовавшийся а— хлорэтилбензол омыляют с образованием метилфенилкарбинола. При отщеплении от последнего молекулы воды (дегидратация) получается стирол:
2)непосредственное дегидрирование этилбензола:
Технология производства стирола из этилбензола по первому методу представляется несколько более сложной, чем по второму методу. Основные затруднения возникают в процессе переработки а-хлорэтилбензола и получение стирола из метилфенилкарбинола. При дальнейшем изучении этого процесса оказалось возможным значительно усовершенствовать отдельные его стадии. Например, А. А. Ваншейдтом было найдено, что проведение дегидратации метилфенилкарбинола лучше всего осуществлять в паровой фазе. В этом случае, как показал А. А. Ваншейдт, получаются более высокие выходы стирола.
Так, при пропускании паров карбинола над окисью алюминия, осажденной углекислотой из алюмината, при температуре в 380—400° со скоростью 0,5—1,5 кг/л час, выход стирола достигает 90%.
Достоинством этого метода является получение сравнительно чистого продукта без применения сложной очистки. Второй метод является более простым в технологическом оформлении, а также более интенсивным и экономичным.
Непосредственное отщепление водорода от этилбензола по этому методу производится над катализатором, состоящим из окиси цинка с добавкой Сг203, СаО, КОН при температуре 550—600°. При этом получается смесь стирола с непрореагировавшим этилбензолом и примесью 0,5—2% высококипящих продуктов уплотнения.
Дегидрирование этилбензола происходит и при других условиях с тем или иным выходом. Так, если пропустить этилбензол через нагретую до 650° железную трубку, то также образуется стирол, но с большим выходом (-30%).
При пропускании этилбензола в смеси с парами воды при 650° над силикагелем или активным углем выход стирола несколько увеличивается.

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
II. Процессы алкилирования
2.1.Реакции алкилирования. Алкилирование ароматических углеводородов спиртами в присутствии серной кислоты
Алкилированием называют процессы введения алкильных групп в молекулы органических и некоторых неорганических веществ. Эти реакции имеют очень большое практическое значение для синтеза алкилированных в ядро ароматических соединений, изопарафинов, многих меркаптанов и сульфидов, аминов, веществ с простой эфирной связью, элемент- и металлорганических соединений, продуктов переработки а-оксидов и ацетилена. Процессы алкилирования часто являются промежуточными стадиями в производстве мономеров, моющих веществ и т. д.
Многие из продуктов алкилирования производятся в очень крупных масштабах. Так, в США синтезируют ежегодно около 4 млн. т этилбензола, 1,6 млн. т изопропилбензола, 0,4 млн. т высших алкилбензолов, свыше 4 млн. т гликолей и других продуктов переработки алкиленоксидов, около 30 млн. т изопарафинового алкилата, около 1 млн. т трет бутилметилового эфира и т. д.
Алкилирование ароматических соединений по методу Фриделя-Крафтса.
Некоторые ароматические соединения |
в присутствии хлорида |
алюминия могут |
легко алкилироваться гапогенолакилами, |
олефинами и спиртами. |
Скорость реакции |
зависит от природы галогена и алкилируемого агента.
В лаборатории алкилирование по Фриделю-Крафсту имеет ограниченное значение. При алкилировании бензола получается смесь моно-, ди- и полизамещенных углеводородов. Это объясняется тем, что скорость реакции алкилирования самого бензола меньше, чем скорость реакции алкилирования образующегося на первой стадии алкилбензола. Под влиянием хлорида алюминия может происходить не только замещение алкильным радикалом водорода ароматического ядра, но и дегидрирование, гидрирование, изомеризация и полимеризация продуктов. Течение реакции алкилирования бензола частично можно регулировать путем подбора соответствующих количеств реагентов. Если хотят получить моноалкилзамещенный продукт бензола, то берут большой избыток последнего, а для получения полиалкилзамещенных производных бензола применяют избыток алкилирующего агента. Однако нельзя полностью избежать образования продуктов разной степени замещения, что снижает выход и представляет определенные трудности при выделении основного продукта. Во время взаимодействия ароматического соединения с первичными галогеналкилами, имеющими неразветвленную цепь углеводородных атомов, могут получаться производные с разветвленную боковой цепью. Например, из бензола и пропилхлорида получается изопропилбензол, из бутилбромида и бензола-втор-бутилбензол.
Алкилирование в присутствии хлорида алюминия, на примере образования изопропилбензола, можно представить следующим образом. В безводном хлориде алюминия атом алюминия имеет лишь шесть электронов на внешней орбитали. Он дополняет эту группировку до октета за счет оттягивания электронов хлора пропилхлорида.
Перед синтезом по методу Фриделя-Крафтса все реагенты должны быть тщательно высушены, так как хлорид алюминия очень легко подвергается гидролизу. Аппаратуру для проведения синтеза также должна быть высушена и защищена от доступа влаги

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
2.2. Лабораторная работа № 2 Алкилирование толуола бутанолом
Сборка приборов
1.Трехгорлую круглодонную колбу вместимостью 500 мл снабжают обратными холодильником, капельной воронкой и мешалкой.
2.Прибор для фракционной разгонки.
Выполнение синтеза В трехгорлую круглодонную колбу вместимостью 500 мл помещают 75 мл 85 %-й
серной кислоты и из капельной воронки в течение 1 ч при энергичном перемешивании и нагревании на водяной бане при 70-80 °С по каплям вносят смесь, состоящую из 33 мл толуола и 14 мл 1 -бутанола.
Необходимо поддержать строго определенную концентрацию кислоты, так как это сильно влияет на выход продукта. Опыт ведется при интенсивном перемешивании, чтобы реакционная смесь не разделялась на две несмешивающихся слоя серной кислоты и толуола. Необходимо строго следить за температурным режимом, так как при 55°С реакция идет очень медленно, а при повышении ее до 95°С продукты начинают сульфироваться. После внесения смеси размешивание продолжают еще в течение 5 ч при той же температуре.
После окончания реакции переливают содержимое реакционной колбы в делительную. Воронку, отделяют верхний углеводородный слой, два раза промывают его водой, высушивают над хлоридом кальция, а затем переносят в круглодонную колбу и проводят фракционную разгонку, отбирая две фракции: до 190 °С и 190-196,0°С. Последняя фракция представляет собой частный втор-бути л бензол.
1-Втор—Бутил-4-метилбензол-жилкостъ; t кип=196°С; /т=873 кг/м3 n20D= 1.497.
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
III. Процессы окисления
3.1 Реакции окисления
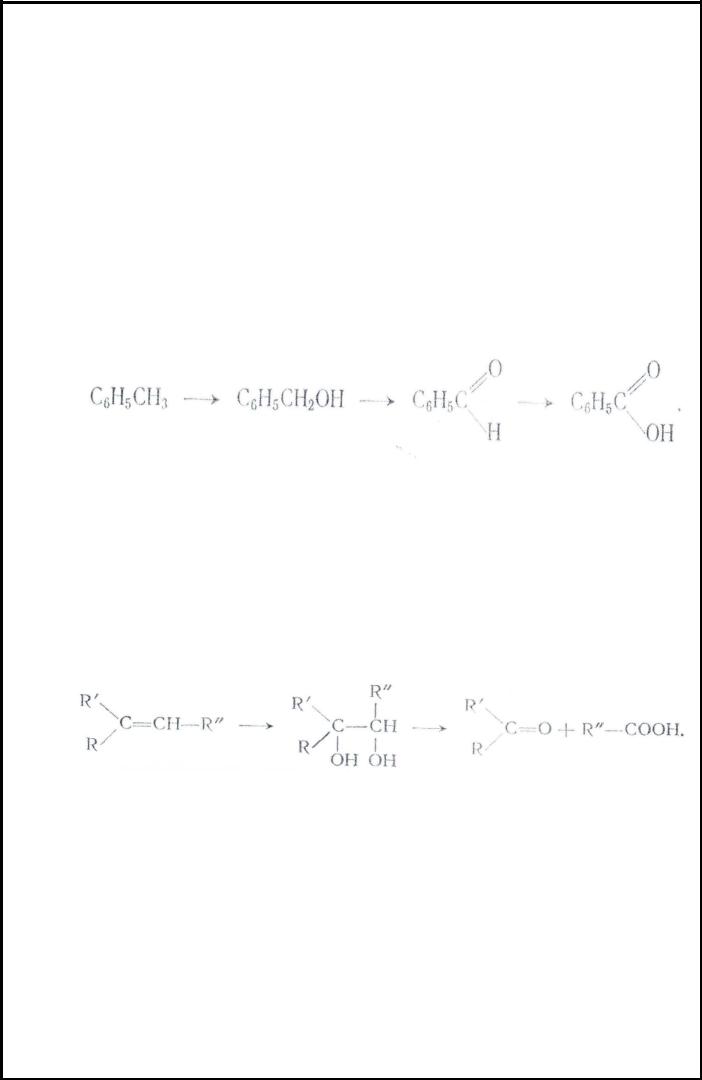
Реакции окисления широко используются для получения различных кислородсодержащих соединений. Окисление органических соединений чаще всего осуществляется при помощи следующих окислителей: кислорода воздуха, перманганата калия, хромовой смеси(получаемой растворением бихромата калия или натрия в серной кислоте), хромового ангидрида азотной кислоты озона диоксида свинца, оксида серебра и др. Действие окислителя на органическое соединение зависит от характера окисляемого вещества и от химической природы самого окислителя. Так, например, при окислении аналина хромовой смесью образуется бензохинон, бертолетовой солью, или хромпиком в присутствии катализатора (соли ванадия меди или железа ) – анилиновый черный(краситель сложного строения), перманганатом калия в нейтральной среде - азобензол, в щелочной - нитробензол, хлорноватой кислотой -n- аминофенол. Окисляемость органического соединения связана с наличием атомов водорода, так окисление идет с отдачей атомов водорода или с присоединением атомов кислорода. Например, толуол легко окисляется:
а третичные спирты окисляются в жестких условиях с разрывом углеродной цепи. Частный случай реакции окисления - дегидрирование, т.е. отщепление водорода.
В промышленности важнейшим методом получения альдегидов и кетонов является каталитическое дегидрирование первичных и вторичных спиртов. В качестве катализаторов используют металлическую медь, серебро, хромоксид и оксид цинка. Дегидридрование - процесс эндотермический, поэтому катализатор постоянно нагревают.
Окисление по двойной связи Двойная связь очень чувствительна к хромовой смеси и перманганату калия. Под
воздействием окислителя сначала происходит присоединение двух гидроксильных групп; образовавшийся гликоль окисляется дальше с расщеплением углеродной связи при этом получаются кетоны или кислоты:
Эта реакция используется для получения гликолей кетонов и кислот из непредельных углеводородов, а также для установления строения непредельных соединений. Окисление по двойной связи можно производить действием озона с целью получение альдегидов и кетонов, если их нельзя получить другими методами, а также чтобы определить положение двойных связей и структуру ненасыщенных соединений. Озон присоединяется по двойной связи образуя очень неустойчивые, взрывчатые озониды, которые под действием воды легко разлагаются до альдегидов или кетонов:
