
Алкилирование углеводородов
.pdf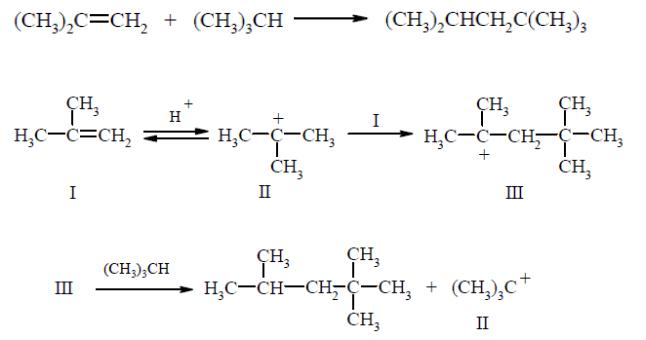
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Для образования переходного состояния требуется определенная энергия активации, при этом скорость реакции зависит от концентрации каждого реагента.
Алкены также могут быть использованы для алкилирования различных органических соединений. Алкилирующая способность олефинов обусловлена ненасыщенностью их молекул, склонностью вступать в реакции присоединения (чаще всего по электрофильному или гомолитическому механизмам).
Применение алканолов в качестве алкилирующих средств возможно
в
случае разрыва в их молекулах связи углерод-кислород. Обычно для этого требуется присутствие сильных кислот.
Специфическим алкилирующим действием обладают диалкилсулфаты.
При их применении используется только одна алкильная группа.
1.1 Алкилирование углеводородов
Алкилирование алканов алкенами имеет промышленное значение.Эти реакции протекают в присутствии серной или фосфорной кислот и характеризуются удлинением углеродной цепи:
Возможный механизм этой реакции:
Взаимодействие начинается с протонирования изобутилена (I) до триметилкарбониевого иона (II), который на второй стадии реакции присоединяется к изобутилену с образованием димерного катиона (III).
6
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Последний реагирует с изобутаном, в результате чего получаются изооктан и
промежуточный ион (II).
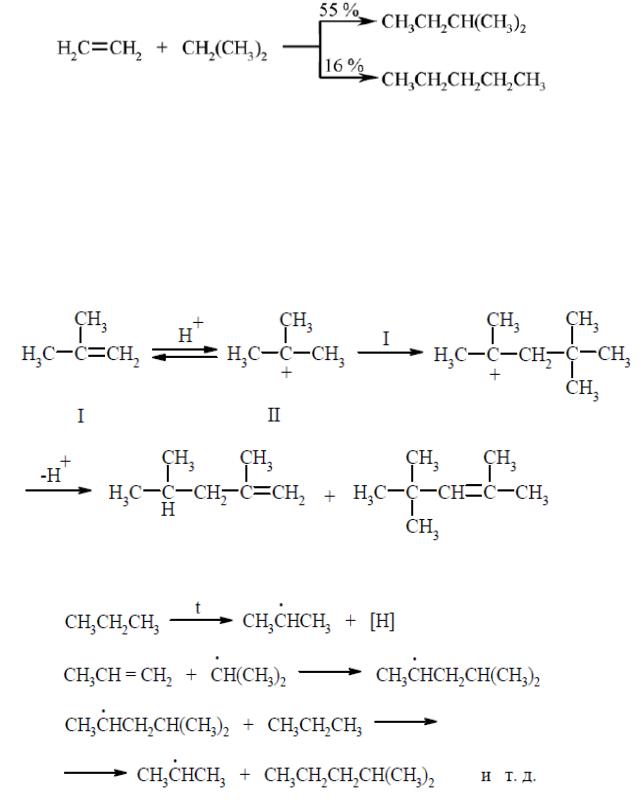
Эта реакция применяется для получения высокооктанового бензина. Термическое алкилирование пропана этиленом дает смесь изопентана и н- пентана:
Димеризацию изобутена в изооктен можно рассматривать как алкилирование алкенов алкенами. Она протекает в присутствии кислот и заключается в следующем. Сначала к концевому углеродному атому двойной связи изобутена (I) присоединяется протон и образуется третбутилкарбониевый ион (II), который атакует вторую молекулу изобутена.
В результате образуется димерный катион. Последняя стадия заключается в отщеплении атома водорода в виде протона, что приводит к возникновению двойной связи и образованию смеси изомерных изооктенов, входящих в состав авиационного бензина:
Алкилирование алкенов алканами можно осуществить и по гомолитическому механизму. Например:
7
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
В результате образуется смесь алканов с большим числом углеродных атомов в молекулах по сравнению с исходными соединениями с большим разветвлением углеродной цепи.
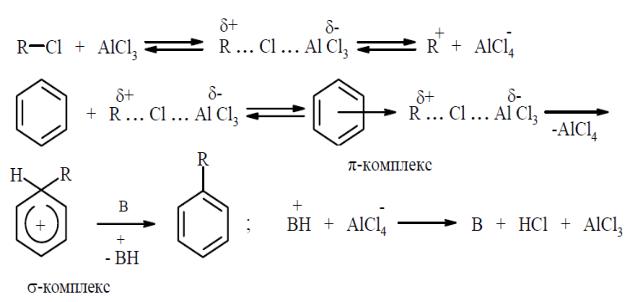
Реакция Фриделя – Крафтса в её многочисленных видоизменениях является наиболее важным методом введения алкильных групп в ароматическое кольцо. В качестве алкилирующих агентов используют галоидные алкилы, спирты или, особенно в промышленности, алкены. Катализаторами реакции служат кислоты Льюиса: хлористый или бромистый алюминий, фторид бора, фосфорная кислота и др. Механизм этой реакции – бимолекулярное электрофильное замещение (SE2). Роль катализатора заключается в увеличении электрофильности алкилирующего агента вследствие перевода его в сильнополяризованный комплекс или ионную пару:
Сильнополяризованный комплекс галоидного алкила с катализатором взаимодействует с ароматическим соединением с образованием π-комплекса, который переходит в более прочный σ- комплекс. Далее происходит отщепление протона от образовавшегося катиона под действием основания (В), в качестве которого может выступать молекула растворителя. Образование π-комплекса происходит на быстрой предварительной стадии, его роль невелика и на скорость процесса в целом практически не влияет.
Образование и распад σ-комплекса с отщеплением протона является основным направлением реакции. В отдельных случаях σ-комплексы можно выделить, если их распад затруднен, например, по стерическим причинам или вследствие отсутствия сильного основания.
Реакционная способность галоидных алкилов в этой реакции изменяется в ряду трет. > втор. > первичн. > метил. Этот порядок объясняется увеличением поляризации связи углерод – галоген под
8
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
влиянием алкильных групп, что приводит к повышению электрофильности действующего реагента.
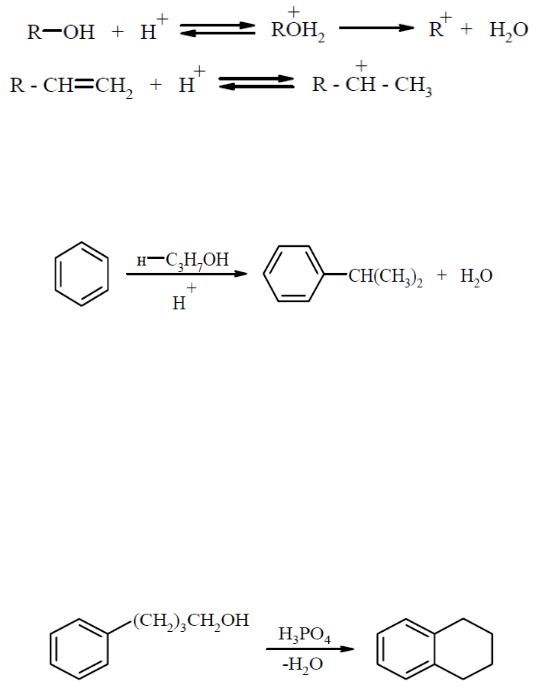
Поскольку введение одной алкильной группы приводит к активированию бензольного кольца в реакции электрофильного замещения, то процесс трудно бывает остановить на стадии моноалкилирования. С этой целью используют избыток ароматического углеводорода. При алкилировании ароматических соединений спиртами или алкенами в качестве электрофильного агента выступает карбкатион:
Эти реакции можно рассматривать как видоизменения реакции Фриделя-Крафтса. Участие карбкатионов в этих превращениях подтверждается тем, что реакция может сопровождаться перегруппировками, приводящими к изменению углеводородного скелета алкильной группы. Например, когда используют реагенты с н-пропильной группой, то введенной часто оказывается изопропильная группа:
Алкилирование ароматических соединений, содержащих электронодонорные заместители (первого рода) протекает легче, так как при этом увеличивается нуклеофильность ароматического кольца. Реакция приводит к образованию смеси орто- и параалкильных производных, соотношение изомеров зависит от строения уже имеющегося в кольце заместителя и от условий проведения процесса. Ароматические соединения с электроноакцепторными группами практически не алкилируются по методу Фриделя – Крафтса. Алкилирование по Фриделю
– Крафтсу может осуществляться внутримолекулярно, в результате чего образуется новый цикл. Так, при нагревании 4-фенил-1-бутанола в фосфорной кислоте образуется продукт циклизации – 1,2,3,4- тетрагидронафталин (тетралин):
Важным использованием внутримолекулярной реакции ФриделяКрафтса является построение полициклического углеводородного скелета
9

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
терпенов и стероидов.
1.2 Алкилирование аминов
Основными алкилирующими агентами для этого класса органических соединений являются галоидные алкилы и диалкилсульфаты.
При нагревании спиртовых растворов аммиака с галоидными алкилами образуется смесь соединений, состоящая из солей первичных, вторичных и третичных аминов, а также четвертичных солей аммония (реакция Гофмана):
Первичный амин, образующийся из аммиака и галогеналкана по реакции бимолекулярного нуклеофильного замещения (SN2) через стадию образования галогенида алкиламмония, подвергается дальнейшему алкилированию и превращается во вторичный амин и т. д. Разделение смеси полученных продуктов достигается фракционной перегонкой.
Алкилирование аминов проводят первичными и вторичными галогеналканами, третичные в условиях этой реакции подвергаются элиминированию с образованием алкенов.
С помощью диалкилсульфатов в молекулу амина можно ввести только одну алкильную группу:
Вследствие низкой реакционной способности арилгалогениды можно превратить в амины лишь в том случае, если в кольце содержатся сильные электроноакцепторные заместители, или реакцию проводят при высокой температуре, или в присутствии сильноосновного реагента, или катализатора – меди и её соединений:
10
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Алкилирование ароматических соединений спиртами в присутствии кислот используют в промышленности для получения вторичных и третичных жирно-ароматических аминов:
Чистые жирно-ароматические амины можно получить алкилированием ацильных производных аминов с последующим гидролизом:
Многие альдегиды и кетоны превращаются в амины при обработке водородом и аммиаком в присутствии катализатора (скелетный никель).
Этот процесс называют восстановительным алкилированием аммиака или аминов. Реакция, вероятно, включает стадию гидрирования промежуточно образующихся аминов:
Восстановительное алкилирование можно провести и для первичных аминов:
11

СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Врезультате образуются вторичные амины.
1.3Алкилирование спиртов и фенолов
Алкилирование спиртов и фенолов приводит к простым эфирам. Спирты медленно реагируют с галогеналканами, тогда как
алкоголят-анионы вследствие своей большей склонности к реакциям типа SN2 очень быстро взаимодействуют с этими агентами:
Эта реакция может сопровождаться побочным процессом – отщеплением галогенводорода от галогеналкана под влиянием алкоголятаниона.
Преимущественное направление реакции определяется строением действующей молекулы галогеналкана и условиями проведения процесса.
Взаимодействие фенолят-аниона с алкилгалогенидом приводит к образованию алкилариловых эфиров:
Алкилирование спиртов и фенолов можно провести и с помощью диалкилсульфатов в щелочной среде:
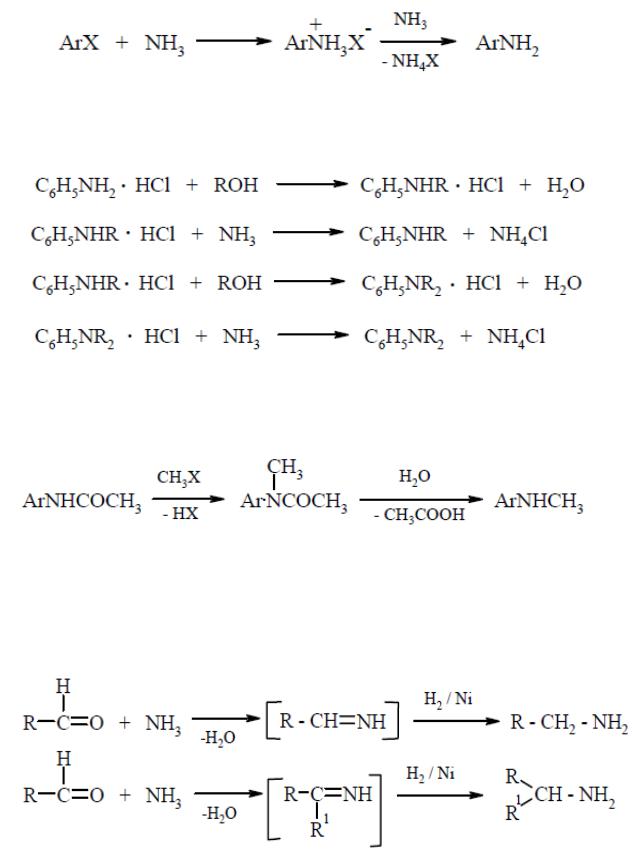
Фенолы обладают большей кислотностью по сравнению со спиртами, что можно объяснить взаимодействием неподеленных электронных пар атома кислорода с электронами ядра. Поэтому образование фенолят-аниона энергетически выгоднее, чем алкоголятаниона, так как в первом случае возможна делокализация заряда и, следовательно, дополнительная стабилизация системы. В случае алкоголят-аниона такой возможности нет.
12
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
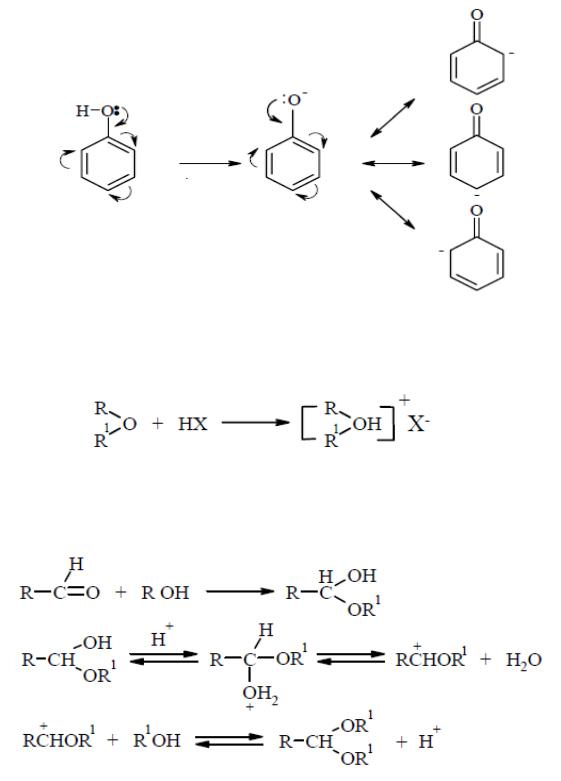
Простые эфиры присоединяют галогенводородные кислоты, при
этом протон кислоты присоединяется к атому кислорода за счет его
неподеленной электронной пары:
Образующиеся при этом соединения называются оксониевыми.
При взаимодействии спиртов с альдегидами образуются полуацетали,
которые в присутствии следов минеральных кислот переходят в ацетали:
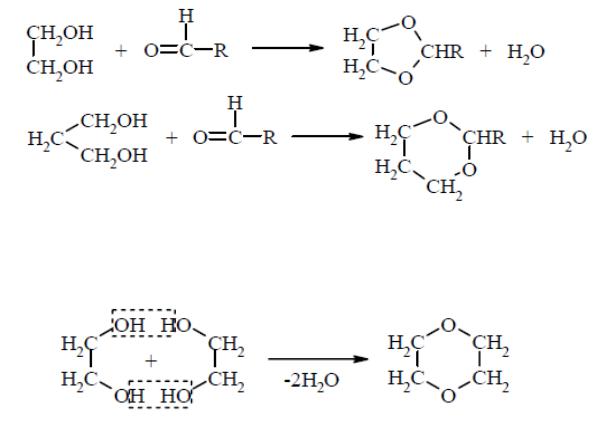
1,2- и 1,3-гликоли взаимодействуют с альдегидами с образованием циклических ацеталей:
13
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
При перегонке этиленгликоля с серной кислотой А.Е. Фаворский получил циклический эфир, названный им диоксаном:
Диоксан используют как полупродукт в органическом синтезе, а также в качестве растворителя.
2 Методическая часть
2.1
Алкилирование фенола изобутиловым спиртом в присутствии серной кислоты
Цель: изучения процесса алкилирования
Исходные вещества: Фенол Изобутиловый спирт Серная кислота.
14
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Вколбу вносят 0.5 моля (47 г.) фенола и 0.6 моля изобутилового спирта. При непрерывном и сильном перемешивании содержимое колбы нагревают до 85˚С и при этой температуре из капельной воронки по каплям приливают 30 г. серной кислоты (плотностью 1.83-1.84 г/см3). Температуру реакции (85-86˚С) регулируют скоростью подачи в колбу серной кислоты. По окончании приливания серной кислоты смесь подогревают при непрерывном перемешивании до 130-140 С и эту температуру поддерживают в течение 2 ч. Затем прекратив нагревание, смесь перемешивают ещё 2 часа и оставляют на 10-12 ч. После этого застывшую кристаллическую массу смывают из колбы горячей водой (60˚С) до исчезновения кислой реакции на Конго. Промытый продукт реакции отделяют от воды.
Врезультате переработке реакционной смеси получают третбутилфенол, имеющий т.пл. 95-96˚С.
Алкилированные фенолы широко применяются в качестве сырья для получения антикоррозионных лаковых покрытий и многофункциональных присадок к смазочным маслам.
2.2Алкилирование фенола изобутиловым спиртам в присутствии КУ-
2
Цель: изучения процесса алкилирования
Исходные вещества: Фенол Изобутиловый спирт
Катионит КУ-2 безводный
К смеси 94 г. фенола и 30 г. катионита при 60-90°С, непрерывно перемешивая, подают из капельной воронки 74 г. изобутилового спирта. После того как всё количество изобутилового спирта будет прибавлено, продолжают нагрев ещё в течение 1 ч, повышая температуру до 135°С (в жидкости). После этого алкилат фильтрованием отделяют от катионита. Отфильтрованный алкилат при охлаждении застывает в сплошную кристаллическую массу. Полученные (отфильтрованные) кристаллы технического трет-бутилфенола плавятся при 88°С (совершенно чистый п- трет-бутилфенол имеет т. пл. 99-100°С)
Выделенный чистый п-трет-бутилфенол из алкилата можно перегонкой при атмосферном давлении.
15
