
Патологическая анатомия Серов
.pdf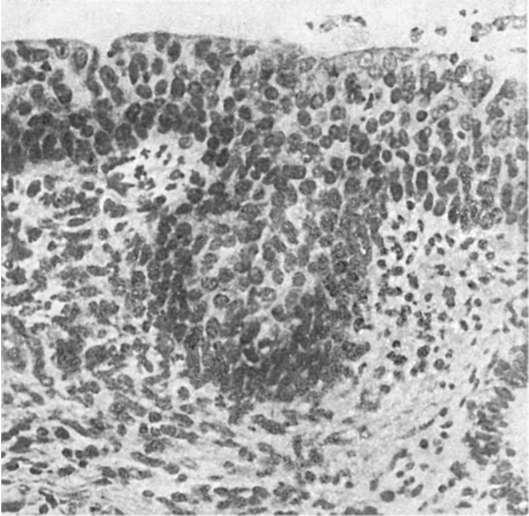
Рис.
Метаплазия эпителия может быть фоном для развития раковой опухоли.
Метаплазия соединительной ткани с образованием хряща и кости встречается в рубцах, в стенке аорты (при атеросклерозе), в строме мышц, в капсуле заживших очагов первичного туберкулеза, в строме опухолей. Во всех этих случаях образованию хрящевой и костной ткани предшествует выраженная в разной степени пролиферация молодых клеток соединительной ткани, дифференцирующихся в направлении хондро- и остеобластов.
Своеобразным видом метаплазии является миелоидная метаплазия селезенки, лимфатических узлов, возникновение очагов внекостномозгового кроветворения (см. Регенерация).
Дисплазия. Термин дисплазия, обозначающий своеобразный адаптивный процесс, принят в онкоморфологии. Он включает выраженные нарушения пролиферации и дифференцировки эпителия с развитием клеточной атипии и нарушением гистоархитектоники. Клеточная атипия представлена различной величиной и формой клеток, увеличением размеров ядер и их гиперхромией, увеличением числа фигур митоза, появлением атипичных митозов
(см. Патология клетки). Нарушения гистоархитектоники при дисплазии проявляются потерей полярности эпителия, а иногда и тех его черт, которые характерны для данной ткани
231
или данного органа (потеря гистоили органоспецифичности эпителия). Однако базальная мембрана не нарушается. Как видно, дисплазия - понятие не клеточное, а тканевое.
В соответствии со степенью пролиферации и выраженностью клеточной и тканевой атипии выделяют три стадии (степени) дисплазии: I - легкая (малая); II - умеренная (средняя); III - тяжелая (значительная).
Дисплазия встречается главным образом при воспалительных и регенераторных процессах, отражая нарушение пролиферации и дифференцировки клеток. Ее начальные стадии (I-II) трудно отличимы от па-
тологической регенерации, особенно если учесть, что может возникать дисплазия и метаплазированного эпителия. Эти стадии дисплазии чаще всего обратимы. Изменения при тяжелой дисплазии (III стадия) значительно реже подвергаются обратному развитию и рассматриваются как предраковые - предрак. Иногда их трудно отличить от карциномы in situ («рак на месте»). Это хорошо прослежено при изучении материала повторных биопсий при раке шейки матки, желудка и других органов.
Компенсация
Компенсация направлена для коррекции нарушенной функции при болезни. Компенсаторный процесс стадийный, в нем различают три фазы: становления, закрепления и истощения. Фаза становлениякомпенсации (Струков А.И., 1961), которую называют также аварийной (Меерсон Ф.З., 1973), характеризуется включением всех структурных резервов и изменением обмена органа (системы) в ответ на патогенное воздействие. В фазе закрепления компенсаторные возможности раскрываются наиболее полно: появляется
перестройка структуры и обмена органа (системы), обеспечивающая их функцию в условиях повышенной нагрузки. Эта фаза может длиться весьма долго (например, компенсированный порок сердца, компенсированный цирроз печени). Однако в зависимости от многих условий (возраст больного, продолжительность и тяжесть болезни, характер лечения и т.д.) развивается недостаточность компенсаторных возможностей, которая характеризует фазу истощения или декомпенсации (например, декомпенсированный порок сердца, декомпенсированный цирроз печени). Следует помнить, что оптимальное раскрытие компенсаторной реакции и нормализация нарушенных функций не всегда означают выздоровление, а нередко представляют собой лишь период скрытого течения болезни, что может неожиданно выявиться при неблагоприятных для больного условиях. Развитие фаз становления, закрепления и истощения (декомпенсация) компенсаторного процесса обусловливается сложной системой рефлекторных актов нервной системы, а также гуморальных влияний. В связи с этим при декомпенсации очень важно искать ее причину не только в больном органе, но и за его пределами среди тех механизмов, которые регулируют его деятельность.
Морфологически компенсация проявляется преимущественно гипертрофией. При этом органы увеличиваются в размере, но сохраняют свою конфигурацию. Полость органа или
232
расширяется (эксцентрическая гипертрофия), или уменьшается (концентрическая гипертрофия). В клетках гипертрофированного органа наблюдаются структурнофункциональные изменения, свидетельствующие о повышении интенсивности обмена. Усиленная функция гипертрофированного органа происходит за счет увеличения числа его специфических внутриклеточных образований, причем в одних случаях этот процесс развертывается на базе предсуществующих клеток и приводит к увеличению их объема (гипертрофия), в других - сопровождается образованием новых клеток (клеточная гиперплазия).
Различают два вида компенсаторной гипертрофии: рабочую (компенсаторную) и викарную (заместительную).
Рабочая (компенсаторная) гипертрофия развивается при усиленной работе органа, при этом наблюдается увеличение объема (числа) клеток, определяющих его специализированную функцию. Рабочая гипертрофия может наблюдаться при усиленной нагрузке и в физиологических условиях (например, гипертрофия сердца и гипертрофия скелетной мускулатуры у спортсменов и лиц физического труда). При болезнях усиленная работа органа необходима в случаях наличия в нем дефектов, которые компенсируются усиленной работой сохранивших свою структуру и функцию частей органа.
Рабочая гипертрофия возникает в сердце, желудочно-кишечном тракте, мочевыводящих путях и других органах.
Гипертрофия сердца представляет собой наиболее яркий пример компенсаторной гипертрофии и достигает наибольших степеней при врожденных и приобретенных пороках клапанов, сопровождающихся стенозом атриовентрикулярных отверстий и выносящих сосудистых трактов желудочков, при артериальной гипертензии, сужении аорты, склерозе сосудов легких и т.д. Гипертрофии подвергается преимущественно отдел миокарда, который выполняет основную работу при данных условиях нарушенного кровообращения (левый желудочек при пороках аортальных клапанов, правый - при пороке митрального клапана и т.д.). Масса сердца при этом может в 3-4 раза превышать массу нормального, достигая иногда 900-1000 г. Увеличиваются и размеры сердца (рис. 91). В основе гипертрофии миокарда лежит увеличение массы саркоплазмы кардиомиоцитов, размеров их ядер, числа и величины миофибрилл, митохондрий (см. рис. 91), т.е. гиперплазия внутриклеточных ультраструктур. При этом объем мышечных волокон увеличивается. Одновременно с гипертрофией миокарда происходит содружественная гиперплазия волокнистых структур стромы, интрамуральных сосудистых ветвей, элементов нервного аппарата сердца. Следовательно, в основе гипертрофии миокарда лежат процессы, содружественно протекающие в мышечных волокнах, строме миокарда, его сосудистой системе и интрамуральном нервном аппарате. Каждый из них представляет собой составную часть понятия «гипертрофированное сердце» и обеспечивает свое участие в развертывании и поддержании усиленной работы сердца в течение длительного, иногда многолетнего, периода.
233
При компенсированной гипертрофии миокарда длинник сердца увеличивается за счет выносящего тракта (от основания полулунных клапанов аорты до наиболее отдаленной точки верхушки сердца); приносящий тракт (от верхушки сердца до места прикрепления заднего паруса двустворчатого клапана) не изменяется. Происходит расширение полостей сердца,
которое обозначают как активное компенсаторное, или тоногенное.
Развитию компенсаторной гипертрофии сердца способствуют не только механические факторы, препятствующие току крови, но и ней-
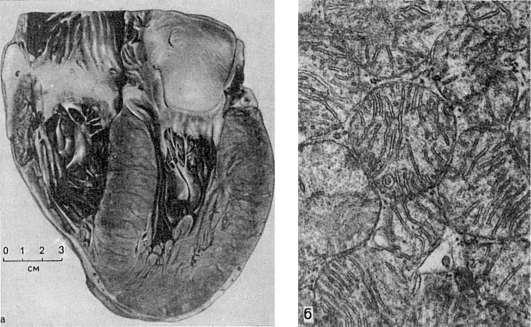 Рис.
Рис.
91. Рабочая гипертрофия левого желудочка сердца:
а - внешний вид; б - гиперплазия митохондрий при гипертрофии сердца. Электронномикроскопическое исследование
рогуморальные влияния. Полноценное осуществление компенсаторной гипертрофии требует определенного уровня иннервации сердца и гормонального баланса. В этом глубокий биологический смысл компенсаторной гипертрофии сердца, обеспечивающей необходимый функциональный уровень общего кровообращения и близкую к нормальной функцию органа. Однако это благополучие только кажущееся, морфологические изменения миокарда в фазе компенсации могут нарастать, если не будет устранена вызывающая их причина. В гипертрофированных кардиомиоцитах возникают дистрофические изменения, в строме миокарда - склеротические процессы, сократительная деятельность миокарда ослабевает, развивается сердечная декомпенсация, т.е. состояние, при котором мышца сердца не в состоянии продолжать напряженную работу. При декомпенсации гипертрофированного миокарда происходит пассивное (поперечное), или миогенное,расширение полости желудочков сердца.
До развития декомпенсации сердца при устранении причины, вызвавшей рабочую гипертрофию, возможна обратимость процесса гипертрофии; мышечные клетки сердца вновь обретают обычные размеры. Этим в значительной мере объясняются более благоприятные
234
результаты ранних оперативных вмешательств на сердце при заболеваниях, сопровождающихся его гипертрофией. Но из этого следует и общее положение о том, что колебание числа внутриклеточных ультраструктур, происходящее в результате непрерывной смены гиперпластических и атрофических про-
цессов, определяется и регулируется степенью функциональной активности, которая требуется от органа в каждый данный момент.
Гипертрофия стенки желудка или кишки возникает выше участка сужения их просвета. Гладкомышечный слой их стенки гипертрофируется, функциональная способность сохраняется. Просвет полости выше сужения обычно расширен. Спустя определенный период времени фаза компенсации сменяется декомпенсацией в результате несостоятельности гипертрофированного мышечного слоя.
Гипертрофия стенки мочевого пузыря встречается при гиперплазии (аденоме) предстательной железы, суживающей мочеиспускательный канал (рис. 92), других затруднениях опорожнения пузыря. Стенка мочевого пузыря утолщается, со стороны слизистой оболочки видны мышечные трабекулы (трабекулярная гипертрофия).
Функциональная несостоятельность гипертрофированных мышц ведет к декомпенсации, расширению полости пузыря.
Викарная (заместительная) гипертрофия наблюдается при гибели в связи с болезнью или после оперативного вмешательства одного из парных органов (легкие, почки и др.). Компенсация нарушенной функции обеспечивается усиленной работой оставшегося органа, который подвергается гипертрофии. По патогенетической сущности и значению для организма викарная гипертрофия близка к регенерационной гипертрофии. В ее возникновении большую роль играет комплекс рефлекторных и гуморальных влияний, как и при компенсаторной гипертрофии.
235
СКЛЕРОЗ
Склерозом (от греч. sklerosis - уплотнение) называют патологический процесс, ведущий к диффузному или очаговому уплотнению внутренних органов, сосудов, соединительнотканных структур в связи с избыточным разрастанием зрелой плотной соединительной ткани. При склерозе фиброзная соединительная ткань замещает паренхиматозные элементы внутренних органов или специализированные структуры соединительной ткани, что ведет к снижению, а иногда и к утрате функции органа или ткани.
Умеренно выраженный склероз без выраженного уплотнения ткани называют также фиброзом, хотя четкого разграничения этих понятий не существует.
Для выраженного склероза с деформацией и перестройкой органа используют термин «цирроз» (цирроз печени, цирроз легкого). Локальный очаг склероза, замещающий раневой дефект или фокус некроза, называютрубцом. Не всякое уплотнение ткани относится к склерозу. Например, кальциноз (петрификация) и гиалинозткани к склерозу отношения не имеют, хотя некоторые исследователи полагают, что гиалиноз занимает промежуточное положение между дистрофией (см. Стромально-сосудистые диспротеинозы) и склерозом.
Классификация склероза учитывает этиологию и патогенез, морфогенез и возможность обратимости склеротических изменений (Шехтер А.Б., 1981).
Руководствуясь этиологией и патогенезом, склеротические процессы делят на следующие: 1) склероз как исход хронического продуктивного воспаления инфекционного, инфекционно-аллергического или иммунопатологического генеза, а также вызванного инородными телами (пневмокониозы, инкапсуляция); 2) склероз как исход системной (ревматические болезни, системные врожденные дисплазии) или локальной (контрактура Дюпюитрена, келоид) дезорганизации соединительной ткани (см. Стромально-сосудистые белковые дистрофии - диспротеинозы); 3) заместительный склероз как исход некроза и атрофии ткани в результате нарушений кровообращения и обмена, воздействия физических и химических факторов; 4) формирование рубцов в результате заживления раневых и язвенных дефектов (см. Регенерация); 5) организация тромбов, гематом, фибринозных наложений; образование спаек, облитерация серозных полостей.
Исходя из особенностей морфогенеза склероза, можно выделить три основных механизма: 1) новообразование молодой соединительной ткани за счет пролиферации фибробластов, усиленный синтез ими коллагена, фибриллогенез и образование фиброзно-рубцовой ткани. Таков механизм заживления ран, склероза при продуктивном воспалении, организации некротических очагов; 2) усиленный синтез коллагена фибробластами и фибриллогенез без выраженной гиперплазии клеток, изменение соотношения клеток и волокнистых структур в пользу последних, превращение рыхлой соединительной ткани в фиброзную, а также нарастание массы и изменение структуры специализированных видов соединительной ткани.
Подобный механизм определяет склероз при дезорганизации и дисплазии соединительной ткани, он характерен для застойного склероза органов (мускатный фиброз печени, бурая
236
индурация легких); 3) склероз при коллапсе стромы в результате некроза или атрофии паренхимы внутренних органов (например, постнекротический цирроз печени).
С точки зрения обратимости склеротические процессы делят на: 1) лабильные, или обратимые (после прекращения действия патогенного фактора); 2) стабильные, или частично обратимые (в течение длительного времени самостоятельно или под влиянием лечения); 3) прогрессирующие, или необратимые.
Регуляция роста соединительной ткани при склерозе осуществляется как центральными
(нейроэндокринными), так и местными (регуляторные системы) механизмами. Местные регуляторные системы работают на основе взаимодействия клеток соединительной ткани (фибробластов, лимфоцитов, макрофагов, лаброцитов) между собой, с коллагеном, с протеогликанами и эпителиальными клетками (Серов В.В., Шахтер А.Б., 1981).
Эти взаимодействия осуществляются с помощью межклеточных контактов, медиаторов (лимфокины, монокины, фиброкины, «твердые» медиаторы), а также продуктов распада клеток и межклеточного вещества. Регуляция межклеточных взаимодействий действует по принципу обратной связи (схема XV).
Схема XV. Регуляция роста соединительной ткани (по А.Б. Шехтеру)
ОПУХОЛИ
Общие сведения
Опухоль, новообразование, бластома (от греч. blasto - росток) - патологический процесс, характеризующийся безудержным размножением (ростом) клеток; при этом нарушения роста и дифференцировки клеток обусловлены изменениями их генетического аппарата. Автономный, или бесконтрольный, рост - первое основное свойство опухоли.
Клетки опухоли приобретают особые свойства, которые отличают их от нормальных клеток. Атипизм клетки, который касается ее структуры, обмена, функции, антигенной структуры, размножения и дифференцировки, - второе основное свойство опухоли.
Приобретение опухолевой клеткой новых, не присущих нормальной клетке свойств получило название анаплазии (от греч. ana - приставка, обозначающая обратное действие, и plasis - образование) или катаплазии (от греч. kata - приставка, обозначающая движение сверху вниз, и plasis - образование).
Термины «анаплазия» и «катаплазия» неоднозначны. Под анаплазией понимают дедифференцировку клеток, приобретение ими эмбриональных свойств; в последние годы
237
это понятие подвергается критике, так как установлены достаточно высокая ультраструктурная организация опухолевых клеток и способность их к специфической дифференцировке. Термин «катаплазия» отражает приобретение опухолевой клеткой лишь особых свойств, он более принят в современной литературе.
Опухоль может возникать в любой ткани, любом органе, наблюдается как у человека, так и у многих животных и растений.
Данные эпидемиологии онкологических заболеваний свидетельствуют о различной частоте заболеваемости и смертности от злокачественных опухолей в разных странах. Показана зависимость возникновения опухолей от природных, биологических факторов, условий социальной среды, уклада жизни, бытовых привычек определенных групп населения. По данным ВОЗ, до 90% опухолей связано с воздействием внешних факторов.
По данным статистики, число больных раком и умерших от него растет во всех странах мира. Это объясняют как ухудшением экологии человека, так и улучшением диагностики онкологических заболеваний, налаженной системой регистрации больных со злокачественными новообразованиями, относительным увеличением в составе населения лиц пожилого и старческого возраста.
Каждый год число новых случаев рака, регистрируемых в мире, составляет около 5,9 млн. Интенсивный показатель смертности от злокачественных новообразований в развитых странах - 182 на 100 000, в развивающихся - 65 на 100 000. Число случаев смерти в мире ежегодно от рака желудка составляет 575 000, от рака легкого - 600 000, от рака молочной железы - 250 000. Уровни заболеваемости и смертности от опухолей в мире сильно варьируют. Наиболее высокая онкологическая заболеваемость - от 242,3 до 361,1 на 100 000 зарегистрирована в ряде районов Италии, Франции, Дании, США, Бразилии.
ВЕвропе по заболеваемости и смертности лидируют рак легкого и рак желудка. В США в структуре заболеваемости у мужчин первые места занимают рак легкого, предстательной железы, толстой и прямой кишок, у женщин - рак молочной железы, рак толстой и прямой кишок, опухоли матки. В странах Азии и Африки большую долю опухолей составляют злокачественная лимфома, печеночно-клеточный и назофарингеальный рак.
ВСССР абсолютное число больных со злокачественными опухолями в 1986 г. составило 641 000 (191,0 на 100 000 населения). Из 544 200 заболевших - 18% больных раком желудка, 14,3% - раком легкого, 11,3% - раком кожи, 7,4 - раком молочной железы. Из 371 200 умерших 23,7% - больные раком желудка, 18,5% - раком легкого, 5,4% - раком молочной железы.
Изучением опухолей занимается онкология (от греч. oncos - опухоль). Патологическая анатомия решает как теоретические, так и практические (диагностические) задачи: дает описание структуры опухолей, изучает причины их возникновения, гистогенез и морфогенез, определяет систематику (классификацию) опухолей, занимается их прижизненной и посмертной диагностикой, установлением степени злокачественности. Для этих целей используются все современные методы гистологии и цитологии (рис. 93).
238

Рис.
Строение опухоли, особенности опухолевой клетки
Внешний вид опухоли разнообразен. Она может иметь форму узла, шляпки гриба или напоминать цветную капусту. Поверхность ее бывает гладкой, бугристой или сосочковой. Опухоль может быть расположена в
239
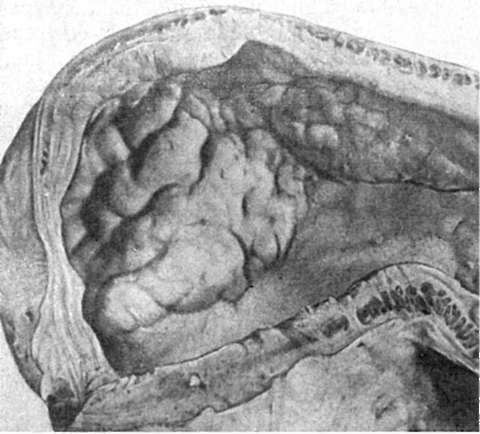
Рис. 94. Диффузный
рост злокачественной опухоли (рака) в стенке желудка
толще органа или на его поверхности. В одних случаях она диффузно пронизывает орган (рис. 94) и тогда границы ее не определяются, в других - расположена на поверхности органа (слизистой оболочки) в виде полипа (рис. 95). В компактных органах опухоль может выступать над поверхностью, прорастать и разрушать капсулу, аррозировать (разъедать) сосуды, вследствие чего возникает внутренее кровотечение. Она часто подвергается некрозу и изъязвляется (раковая язва). На разрезе опухоль имеет вид однородной, обычно бело-серой или серорозовой ткани, напоминая иногда рыбье мясо. Иногда ткань опухоли пестрая в связи с наличием в ней кровоизлияний, очагов некроза; опухоль может быть и волокнистого строения. В некоторых органах (например, в яичниках) опухоль имеет кистозное строение.
Размеры опухоли различные, что зависит от скорости и продолжительности ее роста, происхождения и расположения; консистенция зависит от преобладания в опухоли паренхимы или стромы: в первом случае она мягкая, во втором - плотная.
Вторичные изменения в опухолях представлены очагами некроза и кровоизлияний, воспалением, ослизнением и отложением извести (петрификация). Иногда эти изменения происходят в связи с применением лучевой терапии и химиотерапии.
Микроскопическое строение опухоли отличается большим разнообразием. Однако все опухоли имеют некоторые общие черты строения: опухоль состоит из паренхимы и стромы, соотношения которых могут сильно варьировать.
240
