
Патологическая анатомия Серов
.pdfотличаются поверхностной альтерацией клеток и тканей, что объясняют отсутствием участия комплемента в реакции и преобладанием сосудисто-экссудативных изменений, связанных
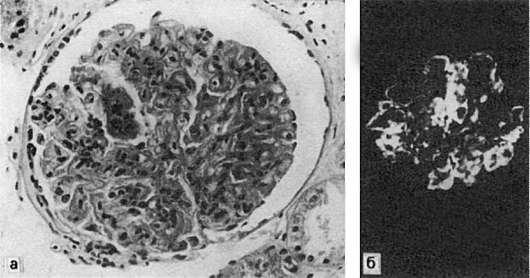 Рис.
Рис.
79. Реакция гиперчувствительности немедленного типа:
а - острое иммунное воспаление: участки фибриноидного набухания и фибриноидного некроза капилляров почечного клубочка при волчаночном гломерулонефрите; б - в участках фибриноида фиксация IgG (иммунолюминесцентное исследование)
с массивной дегрануляцией тканевых базофилов (лаброцитов) и выбросом гистамина; в инфильтрате преобладают эозинофилы - ингибиторы базофилов. Примером реагиновой реакции могут служить изменения при атонической бронхиальной астме (см. Бронхиальная астма).
Реакция гиперчувствительности замедленного типа (ГЗТ). В этой реакции участвуют два вида клеток -сенсибилизированные лимфоциты и макрофаги. Лимфоцитарная и макрофагальная инфильтрация в очаге иммунного конфликта являются выражением хронического иммунного воспаления, лежащего в основе ГЗТ.
Разрушение клетки-мишени, т.е. иммунологически обусловленный клеточный цитолиз, обычно связан с действием белков-перфоринов лимфоцитов-киллеров (см. схему
XIII). Макрофаги вступают в специфическую реакцию с антигеном при помощи медиаторов клеточного иммунитета - лимфокинов и цитофильных антител, адсорбированных на поверхности этих клеток. При этом между лимфоцитами и макрофагами появляются контакты в виде цитоплазматических мостиков, которые, повидимому, служат для обмена информацией между клетками об антигене. Иммунологически обусловленный клеточный цитолиз может быть связан и с клеточными антителами, т.е. с NK- и К-клетками (см. схему
XIII).
Доказательством участия Т-лимфоцитов в ГЗТ является тот факт, что с помощью сенсибилизированных лимфоцитов возможна передача ГЗТ.
201
Воспаление в виде лимфогистиоцитарной и макрофагальной инфильтрации ткани в сочетании с сосудисто-плазморрагическими и паренхиматозно-дистрофическими процессами может считаться иммунным, т.е. отражающим ГЗТ, лишь при наличии доказательств связи клеток инфильтрата с сенсибилизированными лимфоцитами. Эти доказательства могут быть найдены при гистохимическом и электронномикроскопическом исследовании (см. рис. 78).
К клинико-морфологическим проявлениям ГЗТ относят: реакцию туберкулинового типа в коже в ответ на введение антигена, контактный дерматит (контактную аллергию), аутоиммунные болезни, реакции при многих вирусных и некоторых бактериальных (вирусный гепатит, туберкулез, бруцеллез) инфекциях. Морфологическим проявлением ГЗТ служит гранулематоз
(см. Пролиферативное (продуктивное) воспаление).
Для определения ГЗТ в клинике и эксперименте разработан ряд критериев и тестов. In vivo ГЗТ определяют при помощи внутрикожной пробы с антигеном, путем пассивного
переноса ГЗТ от одного животного другому клетками лимфоидных органов. Для определения ГЗТ in vitro используют: реакцию бласттрансформации лимфоцитов под действием антигена или неспецифического антигенного раздражителя, феномен цитопатического действия лимфоцитов на нормальные фибробласты в культуре ткани в присутствии антигена, реакцию угнетения макрофагов под действием антигена и реакцию адсорбции на лимфоцитах аутоэритроцитов, нагруженных антигеном.
Реакции ГНТ и ГЗТ нередко сочетаются или сменяют друг друга, отражая динамику иммунопатологического процесса.
Проявления трансплантационного иммунитета представлены реакцией организма реципиента на генетически чужеродный трансплантат донора, т.е. реакцией отторжения трансплантата. Антигены трансплантата индуцируют выработку специфических антител, которые циркулируют в крови, и продукцию сенсибилизированных лимфоцитов, осуществляющих клеточную инвазию трансплантата. Основную роль в реакции отторжения играют сенсибилизированные лимфоциты, поэтому проявления трансплантационного иммунитета подобны ГЗТ.
Морфологические проявления реакции отторжения сводятся к нарастающей инфильтрации трансплантата в основном лимфоцитами, а также гистиоцитами в результате инвазии этих клеток и размножения их на месте. Клеточная инфильтрация сопровождается расстройством кровообращения и отеком трансплантата. В финале среди клеток инфильтрата появляется много нейтрофилов и макрофагов. Считают, что иммунные лимфоциты, разрушая клетки трансплантата, способны насыщаться его антигенами, поэтому гуморальные антитела, направленные против трансплантационных антигенов, не только связываются клетками трансплантата, но и лизируют лимфоциты. Высвобождающиеся из активированных лимфоцитов ферменты разрушают клетки трансплантата, что ведет к высвобождению новых трансплантационных антигенов. Так осуществляется все нарастающая ферментативная деструкция трансплантата. Реакция отторжения может быть подавлена с помощью ряда иммунодепрессивных средств. Это позволяет при пересадке органов и тканей пользоваться
202
не только изотрансплантатом (реципиент и донор - близнецы), но и аллотрансплантатом (реципиент и донор чужеродны) как от живого человека, так и от трупа.
Аутоиммунизация и аутоиммунные болезни
Аутоиммунизация (аутоаллергия, аутоагрессия) - состояние, характеризующееся появлением реакции иммунной системы на нормальные антигены собственных тканей.
Аутоиммунизация тесно связана с понятием иммунологической толерантности (от лат. tolerare - переносить, терпеть). Оно характеризуется состоянием ареактивности («терпимости») лимфоидной ткани по отношению к антигенам, способным вызывать иммунный ответ. В период созревания лимфоидной ткани возникает иммунологическая
толерантность к антигенам всех органов и тканей, кроме тканей глаза, щитовидной железы, семенников, надпочечников, головного мозга и нервов. Считается, что антигены этих органов и тканей отграничены от лимфоидной ткани физиологическими барьерами, что и объясняет отсутствие к ним толерантности иммунокомпетентной системы. «Свои» и «чужие» тканевые антигены иммунная система начинает распознавать у новорожденного через несколько недель после рождения. При этом продукция аутоантител в незначительных количествах постоянно происходит на протяжении всей жизни и ауто-антитела, как полагают, принимают участие в регу-
ляции различных функций организма. Их действие находится под контролем Т-супрессоров и антиидиотипических антител, что не позволяет развиться аутоиммунному процессу.
Среди этиологических факторов аутоиммунизации ведущее значение придается хронической вирусной инфекции, радиации и генетическим нарушениям. Этиология тесно связана с патогенезом. В патогенезеаутоиммунных
заболеваний различают предрасполагающие, инициирующие и способствующие факторы. Кпредрасполагающим факторам относят определенные гены системы HLA, определяющие количественные и качественные индивидуальные особенности иммунного ответа; гормональный фон, связанный прежде всего с полом (у женщин аутоиммунные болезни встречаются в 6-9 раз чаще, чем у мужчин), и генетически обусловленные особенности клеток органов-мишеней аутоиммунного процесса. Неблагоприятное сочетание этих факторов определяет 50% риска развития болезни. Инициирующими факторами могут быть вирусные и бактериальные инфекции, физические, химические воздействия как на органы иммунной системы, так и на органы-мишени. Способствующие факторы аутоиммунизации - это дисфункция иммунной системы - снижение супрессорной активности Т-лимфоцитов и антиидиотипических антител.
Аутоиммунные болезни - это болезни, в основе которых лежит аутоиммунизация, т.е. агрессия аутоантител, циркулирующих иммунных комплексов, содержащих аутоантигены, и эффекторных иммунных клеток (лимфоцитов-киллеров) в отношении антигенов собственных тканей организма. Поэтому аутоиммунные болезни называют также аутоагрессивными.
203
Руководствуясь механизмом аутоиммунизации, различают две группы аутоиммунных заболеваний. Первая группа - это органоспецифические аутоиммунные болезни, которые развиваются в связи с повреждением физиологических барьеров иммунологически обособленных органов, что позволяет иммунной системе реагировать на их неизмененные антигены выработкой аутоантител и сенсибилизированных лимфоцитов. При этом в органах развиваются морфологические изменения, характерные преимущественно для ГЗТ: ткань органов инфильтрируется лимфоцитами, паренхиматозные элементы погибают, в финале развивается склероз. В эту группу входят тиреоидит (болезнь Хасимото) (рис. 80), энцефаломиелит, полиневрит, рассеянный склероз, идиопатическая аддисонова болезнь, асперматогения, симпатическая офтальмия.
Вторая группа - это органонеспецифические аутоиммунные заболевания. Ведущими при этих заболеваниях являются нарушения контроля иммунологического гомеостаза лимфоидной системой. Аутоиммунизация при этом развивается по отношению к антигенам многих органов и тканей, не обладающих органной специфичностью и неспособных вызывать продукцию антител при парентеральном введении. В органах и тканях развиваются морфологические изменения, характерные для реак-
Рис.
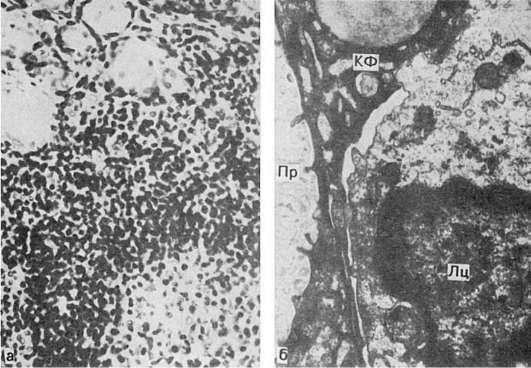
80. Тиреоидит Хасимото:
а - инфильтрация лимфоцитами ткани щитовидной железы, разрушение паренхиматозных элементов (микроскопическая картина); б - миграция лимфоцита (Лц) между клетками фолликула (КФ); множественные контакты и переплетения цитоплазматических отростков лимфоцита и фолликулярных клеток. Пр - просвет фолликула. Электронограмма. χ10 000 (по Ирвину и Муру)
204
ций гиперчувствительности как замедленного, так и особенно немедленного типов. К этой группе аутоиммунных заболеваний относят системную красную волчанку, ревматоидный артрит, системную склеродермию, дерматомиозит (группа ревматических болезней), вторичную тромботическую тромбоцитопеническую пурпуру (болезнь Мошковича).
Существуют аутоиммунные болезни промежуточного типа, т.е. близкие аутоиммунным заболеваниям первого или второго типа. Это миастения гравис, сахарный диабет I типа, тиреотоксикоз, синдромы Шегрена и Гудпасчера и др.
Помимо аутоиммунных заболеваний, выделяют болезни с аутоиммунными нарушениями. Появление аутоантигенов при этих заболеваниях связывают с изменением
антигенных свойств тканей и органов - денатурацией тканевых белков (при ожоге, облучении, травме, хроническом воспалении, вирусной инфекции); образование аутоантигена возможно при воздействии бактериального антигена, особенно перекрестно реагирующего (например, при гломерулонефрите, ревматизме). В образовании аутоантигена большое значение придается гаптенному механизму, причем в роли гаптена могут выступать как продукты обмена тела, так и микроорганизмы, токсины и лекарственные средства. Аутоиммунизация в
этих условиях определяет не возникновение заболевания, а прогрессирование характерных для него локальных (органных) изменений, которые отражают «морфологию реакций гиперчувствительности замедленного и немедленного типов. В эту группу заболеваний включают: определенные формы гломерулонефрита, гепатита, хронического гастрита и энтерита, цирроз печени, ожоговую болезнь, аллергические анемии, тромбоцитопению, агранулоцитоз, лекарственную аллергию.
Иммунодефицитные синдромы
Иммунодефицитные синдромы являются крайним проявлением недостаточности иммунной системы. Они могут быть первичными, обусловленными недоразвитием (гипоплазия,
аплазия) иммунной системы -наследственные и врожденные иммунодефицитные синдромы, или вторичными (приобретенными), возникающими в связи с болезнью или проводимым лечением.
Первичные иммунодефицитные синдромы
Первичные иммунодефицитные синдромы могут быть выражением недостаточности: 1) клеточного и гуморального иммунитета; 2) клеточного иммунитета; 3) гуморального иммунитета.
Синдромы недостаточности клеточного и гуморального иммунитета называют комбинированными. Они встречаются у детей и новорожденных,
наследуются по аутосомно-доминантному типу (агаммаглобулинемия швейцарского типа, или синдром Гланцманна-Риникера; атаксиятелеангиэктазия Луи-Бар). При этих синдромах находят гипоплазию как вилочковои железы, так и периферической лимфоидной ткани (табл. 4), что и определяет дефект клеточного и гуморального иммунитета. В связи с
205
несостоятельностью иммунитета у таких детей часто возникают инфекционные заболевания, которые имеют рецидивирующее течение и дают тяжелые осложнения (пневмония, менингит, сепсис), отмечается задержка физиологического развития. При комбинированных иммунодефицитных синдромах часто возникают пороки развития и злокачественные мезенхимальные опухоли (атаксия-телеангиэктазия Луи-Бар).
Синдромы недостаточности клеточного иммунитета в одних случаях наследуются обычно по аутосомно-доминантному типу (иммунодефицит с ахондроплазией, или синдром Мак-Кьюсика), в других являются врожденными (агенезия или гипоплазия вилочковои железы, или синдром Дайджорджа). Помимо агенезии или гипоплазии вилочковои железы и Т- зависимых зон периферической лимфоидной ткани, что определяет дефицит клеточного иммунитета, для этих синдромов характерны множественные пороки развития (см. табл. 4). Дети погибают от пороков развития либо от осложнений инфекционных заболеваний.
Синдромы недостаточности гуморального иммунитета имеют наследственную природу,
причем установлена сцепленность их с Х-хромосомой (см. табл. 4). Болеют дети первых пяти лет жизни. Для одних синдромов
Таблица 4. Первичные иммунодефицитные синдромы
Клинико-морфологические Название синдрома Тип наследования Иммунные наруш
проявления Комбинированные иммунодефицитные синдромы
Комбинированный тип Гланцманна и Риникера, или агаммаглобулинемия швейцарского типа
Атаксия-телеангиэказия Луи-Бар
Комбинированный тип с наличием В-лимфоцитов и иммуноглобулинов (синдром Незелофа)
|
Гипоплазия вилочковой железы и |
Тотальный дефект |
|
|
и гуморального им |
||
|
периферической лимфоидной |
||
|
|
||
Аутосомнорецессивныйткани, лимфопения, частые |
потеря способност |
||
|
инфекционные заболевания |
синтезировать |
|
|
иммуноглобулины |
||
|
|
||
|
Гипоплазия вилочковой железы и |
|
|
|
периферической лимфоидной |
|
|
|
ткани, лимфопения, атрофия |
Дефект клеточного |
|
То же |
коры мозжечка (атаксия), |
иммунитета, недос |
|
телеангиэктазия бульбарной |
иммуноглобулинов |
||
|
|||
|
конъюнктивы, мезенхимальные |
дефицит IgA |
|
|
злокачественные опухоли, |
|
|
|
рецидивирующая пневмония |
|
|
|
|
Содержание |
|
|
Гипоплазия вилочковой железы и |
иммуноглобулинов |
|
|
нормальное, возмо |
||
»» |
периферической лимфоидной |
||
дисгаммаглобулин |
|||
|
ткани, лимфопения, сепсис |
||
|
Дефект клеточного |
||
|
|
||
иммунитета
Синдромы недостаточности клеточного иммунитета |
|
|||
Агенезия или гипоплазия |
Не известен |
Отсутствие вилочковой железы и Содержание |
||
вилочковой железы |
околощитовидных желез |
иммуноглобулинов |
||
|
||||
|
|
|
206 |
|
(синдром Дайджорджа) |
|
(тетания), отсутствие Т- |
нормальное. Дефе |
|
|
|
лимфоцитов |
клеточного иммуни |
|
Окончание табл. 4 |
|
|
|
|
Название синдрома |
Тип |
Клинико-морфологические |
Иммунные |
|
наследования проявления |
нарушения |
|||
|
||||
Синдромы недостаточности гуморального иммунитета |
|
|||
Агаммаглобулинемия, |
|
Вилочковая железа сохранена. |
Дефект гуморального |
|
|
Отсутствие В-зависимых зон и |
иммунитета, потеря |
||
сцепленная с Х- |
Сцепленный с клеток плазмоцитарного ряда в |
|||
хромосомой (синдром |
Х-хромосомой лимфатических узлах и |
способности к |
||
синтезу |
||||
Брутона) |
|
селезенке, частные |
||
|
иммуноглобулинов |
|||
|
|
инфекционные заболевания |
||
|
|
|
||
|
|
Структура лимфоидной ткани |
|
|
|
|
сохранена. Проявления |
|
|
|
|
аллергии. Частые инфекции |
|
|
Избирательный |
|
дыхательных путей и |
Потеря способности к |
|
дефицит IgA (синдром |
То же |
желудочнокишечного тракта в |
||
синтезу IgA |
||||
Веста) |
|
сочетании с аутоиммунными |
||
|
|
|||
болезнями, синдром нарушенного всасывания, иногда с опухолями
(агаммаглобулинемия, сцепленная с Х-хромосомой, или синдром Брутона) характерна потеря способности к синтезу всех иммуноглобулинов, что морфологически подтверждается отсутствием В-зависимых зон и клеток плазмоцитарного ряда в периферической лимфоидной ткани, прежде всего в лимфатических узлах и селезенке. Другим синдромам свойствен дефицит одного из иммуноглобулинов (например, избирательный дефицит IgA, или синдром Веста), тогда структура лимфоидной ткани остается сохранной. Однако при всех синдромах недостаточности гуморального иммунитета развиваются тяжелые бактериальные инфекции с преобладанием гнойно-деструктивных процессов в бронхах и легких, желудочнокишечном тракте, коже, ЦНС, нередко заканчивающихся сепсисом.
Помимо иммунодефицитных, известны синдромы недостаточности системы моноритарных фагоцитов и нейтрофилов, среди которых наследственные заболевания и синдромы - хроническая гранулематозная болезнь, синдромы Чедиака-Хигаси и Джоба и др.
Вторичные иммунодефицитные синдромы
Вторичные (приобретенные) иммунодефицитные синдромы в отличие от первичных возникают в связи с болезнью или определенным видом лечения.
Среди заболеваний, ведущих к развитию недостаточности иммунной системы, основное значение имеет безудержно распространяющийся во многих странах мира синдром приобретенного иммунного дефицита,или СПИД, - самостоятельное заболевание, вызываемое определенным вирусом (см. Вирусные инфекции). К развитию вторичных иммунодефицитных синдромов ведут также другие инфекции, лейкозы, злокачественные
207
лимфомы (лимфогранулематоз, лимфосаркома, ретикулосаркома), тимома, саркоидоз. При этих заболеваниях возникает недостаточность гуморального и клеточного иммунитета в результате дефекта популяции как В-, так и Т-лимфоцитов, а возможно, и их предшественников.
Среди видов лечения, ведущих к вторичной недостаточности иммунной системы, наибольшее значение имеют лучевая терапия, применение кортикостероидов и иммунодепрессантов, антилимфоцитарной сыворотки, тимэктомия, дренирование грудного протока и др.
Недостаточность иммунной системы, развивающаяся в связи с лечением той или иной болезни, рассматривается как патология терапии (ятрогения).
При вторичных, как и при первичных, иммунодефицитных синдромах часто наблюдаются гнойные инфекции, обострение туберкулезного процесса, сепсис.
РЕГЕНЕРАЦИЯ
Общие сведения
Регенерация (от лат. regeneratio - возрождение) - восстановление (возмещение) структурных элементов ткани взамен погибших. В биологическом смысле регенерация представляет собой приспособительный процесс,выработанный в ходе эволюции и присущий всему живому. В жизнедеятельности организма каждое функциональное отправление требует затрат материального субстрата и его восстановления. Следовательно, при регенерации происходит самовоспроизведение живой материи, причем это самовоспроизведение живого отражает принцип ауторегуляции и автоматизации жизненных отправлений (Давыдовский И.В., 1969).
Регенераторное восстановление структуры может происходить на разных уровнях - молекулярном, субклеточном, клеточном, тканевом и органном, однако всегда речь идет о возмещении структуры, которая способна выполнять специализированную функцию.
Регенерация - это восстановление как структуры, так и функции. Значение регенераторного процесса - в материальном обеспечении гомеостаза.
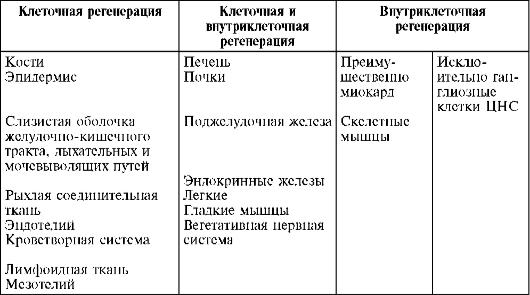
Восстановление структуры и функции может осуществляться с помощью клеточных или внутриклеточных гиперпластических процессов. На этом основании различают клеточную и внутриклеточную формы регенерации (Саркисов Д.С., 1977). Для клеточной формы регенерации характерно размножение клеток митотическим и амитотическим путем,
для внутриклеточной формы, которая может быть органоидной и внутриорганоидной, - увеличение числа (гиперплазия) и размеров (гипертрофия) ультраструктур (ядра, ядрышек, митохондрий, рибосом, пластинчатого комплекса и т.д.) и их компонентов (см. рис. 5, 11, 15).Внутриклеточная форма регенерации является универсальной, так как она свойственна всем органам и тканям. Однако структурно-функциональная специализация органов и тканей в фило- и онтогенезе «отобрала» для одних преимущественно клеточнуую форму, для других - преимущественно или исключительно внутриклеточную, для третьих - в равной мере обе
208
формы регенерации (табл. 5). Преобладание той или иной формы регенерации в определенных органах и тканях определяется их функциональным назначением, структурнофункциональной специализацией. Необходимость сохранения целостности покровов тела объясняет, например, преобладание клеточной формы регенерации эпителия как кожи, так и слизистых оболочек. Специализированная функция пирамидной клетки головного
мозга, как и мышечной клетки сердца, исключает возможность деления этих клеток и позволяет понять необходимость отбора в фило- и онтогенезе внутриклеточной регенерации как единственной формы восстановления данного субстрата.
Таблица 5. Формы регенерации в органах и тканях млекопитающих (по Саркисову Д.С., 1988)
Эти данные опровергают существовавшие до недавнего времени представления об утрате некоторыми органами и тканями млекопитающих способности к регенерации, о «плохо» и «хорошо» регенерирующих тканях человека, о том, что существует «закон обратной зависимости» между степенью дифференцировки тканей и способностью их к регенерации. В настоящее время установлено, что в ходе эволюции способность к регенерации в некоторых тканях и органах не исчезла, а приняла формы (клеточную или внутриклеточную), соответствующие их структурному и функциональному своеобразию (Саркисов Д.С., 1977). Таким образом, все ткани и органы обладают способностью к регенерации, различны лишь ее формы в зависимости от структурно-функциональной специализации ткани или органа.
Морфогенез регенераторного процесса складывается из двух фаз - пролиферации и дифференцировки. Особенно хорошо эти фазы выражены при клеточной форме регенерации. В фазу пролиферацииразмножаются молодые, недифференцированные клетки. Эти клетки называют камбиальными (от лат. cambium- обмен, смена), стволовыми
клетками и клетками-предшественниками.
Для каждой ткани характерны свои камбиальные клетки, которые отличаются степенью пролиферативной активности и специализации, однако одна стволовая клетка может быть родоначальником нескольких видов
209
клеток (например, стволовая клетка кроветворной системы, лимфоидной ткани, некоторые клеточные представители соединительной ткани).
В фазу дифференцировки молодые клетки созревают, происходит их структурнофункциональная специализация. Та же смена гиперплазии ультраструктур их дифференцировкой (созреванием) лежит в основе механизма внутриклеточной регенерации.
Регуляция регенераторного процесса. Среди регуляторных механизмов регенерации различают гуморальные, иммунологические, нервные, функциональные.
Гуморальные механизмы реализуются как в клетках поврежденных органов и тканей (внутритканевые и внутриклеточные регуляторы), так и за их пределами (гормоны, поэтины, медиаторы, факторы роста и др.). К гуморальным регуляторам относят кейлоны (от
греч. chalaino - ослаблять) - вещества, способные подавлять деление клеток и синтез ДНК; они обладают тканевой специфичностью. Иммунологические механизмырегуляции связаны с «регенерационной информацией», переносимой лимфоцитами. В связи с этим следует заметить, что механизмы иммунологического гомеостаза определяют и структурный гомеостаз. Нервные механизмы регенераторных процессов связаны прежде всего с трофической функцией нервной системы, афункциональные механизмы - с функциональным «запросом» органа, ткани, который рассматривается как стимул к регенерации.
Развитие регенераторного процесса во многом зависит от ряда общих и местных условий, или факторов. Кобщим следует отнести возраст, конституцию, характер питания, состояние обмена и кроветворения, кместным - состояние иннервации, крово- и лимфообращения ткани, пролиферативную активность ее клеток, характер патологического процесса.
Классификация. Различают три вида регенерации: физиологическую, репаративную и патологическую.
Физиологическая регенерация совершается в течение всей жизни и характеризуется постоянным обновлением клеток, волокнистых структур, основного вещества соединительной ткани. Нет таких структур, которые не подвергались бы физиологической регенерации. Там, где доминирует клеточная форма регенерации, имеет место обновление клеток. Так происходит постоянная смена покровного эпителия кожи и слизистых оболочек, секреторного эпителия экзокринных желез, клеток, выстилающих серозные и синовиальные оболочки, клеточных элементов соединительной ткани, эритроцитов, лейкоцитов и тромбоцитов крови и т.д. В тканях и органах, где клеточная форма регенерации утрачена, например в сердце, головном мозге, происходит обновление внутриклеточных структур. Наряду с обновлением клеток и субклеточных структур постоянно совершаетсябиохимическая регенерация, т.е. обновление молекулярного состава всех компонентов тела.
Репаративная или восстановительная регенерация наблюдается при различных патологических процессах, ведущих к повреждению клеток и тка-
210
