
- •Предмет и основное содержание фармацевтической химии. Объекты и области исследования фармацевтической химии.
- •Источники получения лекарственных средств – химический синтез, выделение из животных и растительных объектов, биотехнологические методы. Показать на примере тиреоидина, ампициллина, фенола.
- •Номенклатура, методологические основы и принципы классификации (химической и фармакологической) лекарственных средств, их достоинства и недостатки.
- •Определение понятия "растворимость", условные термины, принятые гф и Британской фармакопеей для выражения растворимости. Способы определения растворимости соединений с неизвестной растворимостью
- •Общие методы минерализации органических галогенсодержащих лекарственных веществ. Метод сжигания в колбе с кислородом, поглощающие жидкости.
- •Возможность прогнозирования сроков годности на основании метода “ускоренного старения” – уравнения Вант-Гоффа, Аррениуса.
- •Сравнительная оценка пригодности современных химических и физико-химических методов для количественного определения основного действующего компонента.
- •Анализ воды очищенной и воды для инъекций. Особенности контроля качества. Тесты на пирогенность.
- •Период полувыведения – важнейший фармакокинетический параметр, позволяющий:
Анализ воды очищенной и воды для инъекций. Особенности контроля качества. Тесты на пирогенность.
Вода очищенная. Aqua purificata
Вода очищенная получается методом дистилляции, обратным осмосом, ионным обменом и другими методами. Это наиболее часто используемый растворитель для лекарственных веществ. На воде очищенной готовят микстуры, жидкости для наружного применения. На воде для инъекций готовят инъекционные растворы, глазные капли. Вода очищенная должна соответствовать определенным требованиям в отношении чистоты. Это должна быть бесцветная, прозрачная жидкость без запаха и вкуса, с рН в пределах 5—7. Определение, в соответствии с требованиями ГФ, должно проводиться потенциометрическим методом. В воде очищенной определяют 0 сухой остаток после выпаривания 100 мл. После высушивания при 100-105 °С до постоянного веса остаток не должен превышать 0,001% (1 мг в 100 г воды) В воде очищенной не должно быть восстанавливающих вещест; (остатки микроорганизмов). Это определение проводят путем кипячения 100 мл воды, 1 мл 0,01 н. раствора КМп04 и 2 мл разведен нойH2S04 в течение 10 мин. Розовая окраска раствора должна со храниться, а в случае присутствия восстанавливающих веществ, он; исчезнет:
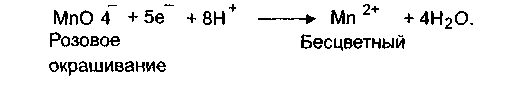
Вода легко поглощает С02. В воде очищенной этого примесного вещества не должно быть. Обнаруживают его по помутнению в присутствии известковой воды [Са(ОН)2]. Определение ведут в течение 1 ч в закрытом сосуде, заполненном доверху равными объёмами испытуемой воды и воды известковой. Помутнение указывает на наличие СО, в воде очищенной:
![]()
В воде очищенной должны отсутствовать нитраты и нитриты, которые определяют по посинению раствора дифениламина (химизм — см. стр. 14,15). Раствор дифениламина готовят на концентрированной H2S04. В воде очищенной допускается содержание примесного иона аммония в пределах не более 0,00002%. Для оценки регламентированного количества аммиака в воде необходимо использовать эталонный раствор, содержащий 0,00002% аммиака. В испытуемой воде и в эталонном растворе проводят реакцию с реактивом Несслера (раствор K2HgI4 в КОН). Окраска в испытуемой воде не должна быть интенсивнее, чем в эталонном растворе:
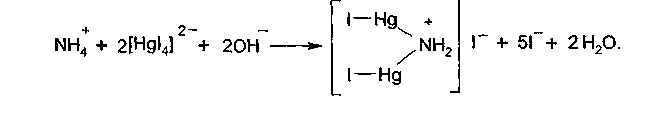
В воде очищенной должны отсутствовать хлориды, сульфаты, ионы кальция и тяжелых металлов. Хлорид-ионы открывают по реакции с раствором AgN03 в присутствии HNO3, (химизм - см. с. 18). Не должно быть помутнения или опалесценции. Азотная кислота делает реакцию специфичной, т.к. осадки AgN03 с другими ионами (за исключением В г- и 1~-ионов) в HN03растворяются. Сульфаты обнаруживают по реакции с раствором ВаС12 в присутствии НС1, в которой растворяются осадки иона бария с другими ионами, например S032~, С032~ (химизм — см. с. 14, 18). Не должно быть помутнения. Ионы кальция обнаруживают по реакции с раствором оксалата аммония в присутствии аммиачного буфера, создающего оптимальные условия для реакции, рН 6,0 — 7,5 (химизм — см. с. 18). Не должно быть помутнения. Ионы тяжелых металлов обнаруживают по реакции с раствором натрия сульфида в среде кислоты уксусной. Данная реакция позволяет выявить ионы тяжелых металлов, дающие с 52~-ионами темные осадки. Поскольку концентрация ионов крайне мала, наличие примесей ионов тяжелых металлов характеризуется появлением бурого окрашивания:
Микробиологическая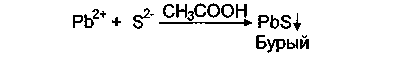 чистота
должна соответствовать требованиям,
предъявляемым к питьевой воде не более
100 микроорганизмов в 1 мл при отсутствии
бактерий семейств Enterobacteriaceae, Staphylococcus
aureus, Pseudomonas aeruginosa. Испытания проводят в
соответствии с ФС «Испытание на
микробиологическую чистоту». Хранится
вода очищенная в закрытых емкостях,
изготовленных из материалов, не изменяющих
свойства воды и защищающих ее от инородных
частиц и микробиологических загрязнений.
чистота
должна соответствовать требованиям,
предъявляемым к питьевой воде не более
100 микроорганизмов в 1 мл при отсутствии
бактерий семейств Enterobacteriaceae, Staphylococcus
aureus, Pseudomonas aeruginosa. Испытания проводят в
соответствии с ФС «Испытание на
микробиологическую чистоту». Хранится
вода очищенная в закрытых емкостях,
изготовленных из материалов, не изменяющих
свойства воды и защищающих ее от инородных
частиц и микробиологических загрязнений.
Вода для инъекций — Aqua pro injectionibus. Вода для инъекций должна отвечать требованиям, предъявляемым к воде очищенной. Кроме того, она должна быть апирогенной, не содержать антимикробных веществ и других добавок. Определение пирогенности проводят в соответствии с ФС «Испытание на пирогенность». Для определения пирогенности инъекционных препаратов (и в том числе воды для инъекций) в настоящее время наряду с испытаниями на кроликах используют ЛАЛ-реактив. В ФС «Бактериальные эндотоксины» описаны требования к ЛАЛ-реактиву, процедура анализа, расчет предельного содержания бактериальных эндотоксинов.ЛАЛ-тест основан на способности лизата амебоцитов (клеток крови) мечехвоста Limulus polyphemus (Лизат Амебоцитов Лимулюс — ЛАЛ-реактив) специфически реагировать с эндотоксинами бактерий (липополисахаридами). Этот тест может быть использован в медицине для ранней диагностики заболеваний, вызванных грамотрицательными бактериями. Реакция между эндотоксинами и лизатом дает помутнение реакционной смеси и увеличение ее вязкости вплоть до образования плотного геля. Такой результат является доказательством присутствия эндотоксинов. Анализ называется гель-тромб-тестом и используется для определения соответствия реального содержания бактериальных эндотоксинов предельному их содержанию, указанному в частной статье ГФ (качественный анализ), а также для определения содержания бактериальных эндотоксинов в испытуемом препарате (количественный анализ). Основным методом проведения анализа на соответствие показателю «Бактериальные эндотоксины» является качественный анализ (при отсутствии других указаний). Этот метод является также арбитражным. ЛАЛ-реактив представляет собой лиофилизированный препарат. Вода для ЛАЛ-теста должна соответствовать требованиям, предъявляемым к воде для инъекций и не содержать бактериальные эндотоксины в количествах, определяемых используемым ЛАЛ-реакти-вом в данном тесте. Используют воду для инъекций свежеприготовленную или хранящуюся не более 24 ч при температуре 5—10 °С или 80—95 °С в закрытых ёмкостях, изготовленных из материалов, не изменяющих свойства воды, защищающих воду от попадания механических включений и микробиологического загрязнения.
Преимущество данного теста перед испытанием на кроликах заключается в его высокой чувствительности. Кроме того, определение не требует много времени — результат может быть получен через 30—60 мин.
Специфика установления и соблюдения сроков годности в связи с радиохимической стабильностью и содержанием радиоизотопной примеси радиофармацевтических средств. Этикетирование, хранение, меры предосторожности при обращении.
Радиофармацевтические препараты — это химические вещества, содержащие радиоактивный нуклид и разрешенные для введения человеку с диагностической или лечебной целью.
Растворы радиоактивных фармацевтических препаратов для инъекций обычно поставляются в таре (контейнерах), закрытой таким образом, чтобы можно было брать одну за другой отдельные дозы по мере необходимости. В соответствии с требованиями Международной фармакопеи такие растворы для инъекций обычно должны содержать подходящий бактериостатический агент в подобранной должным образом концентрации.
Многие известные бактериостатические агенты, например бензиловый спирт, постепенно разрушаются в водных растворах под действием радиации. Скорость разрушения зависит от ряда факторов, в том числе от природы радиоизотопа и радиоактивной концентрации раствора. Поэтому не всегда возможно определить эффективный бактериостатический агент для раствора радиофармацевтического препарата для инъекций, и для ряда препаратов добавление такого агента нежелательно; по этой причине включение бактериостатических агентов не является обязательным. Природа бактериостатического агента, если таковой присутствует, должна быть указана на этикетке; если бактериостатический агент не введен в препарат, это также должно быть указано на этикетке. Желательно, чтобы радиофармацевтические препараты со сроком годности более одних суток и не содержащие бактериостатический агент поставлялись в таре для одноразового применения.
Другие требования
Радиоактивные фармацевтические препараты, применяемые парентерально, должны отвечать соответствующим требованиям для инъецируемых лекарственных форм, указанным в Международной фармакопее, за исключением тех случаев, когда они должны удовлетворять требованиям, касающимся объема раствора для инъекций в таре для одноразового применения.
Срок годности
Ввиду особой природы радиоактивных фармацевтических препаратов для них должен быть установлен срок годности, после которого их дальнейшее применение не рекомендуется. Установленный срок годности начинается с того дня, который указан на этикетке как день определения радиоактивности, и может выражаться в сутках, неделях или месяцах. Для долгоживущих радиоизотопов срок годности не превышает 6 мес. Срок годности зависит от радиохимической стабильности и от содержания долгоживущей радиоизотопной примеси в конкретном препарате. К концу срока годности радиоактивность уменьшится настолько, что станет недостаточной для применения в назначенных целях или дозу активного ингредиента надо будет увеличить до такой степени, что это вызовет нежелательную физиологическую реакцию. Кроме того, химическое или радиационное разложение может снизить радиохимическую чистоту до неприемлемого уровня, а содержание радиоизотопной примеси может оказаться настолько высоким, что больной получит нежелательную дозу радиации. Поэтому применять продукты после окончания срока годности не рекомендуется.
Этикетирование
Как травило, следующая информация должна быть приведена на таре (контейнере), непосредственно содержащей препарат (например, на флаконе):
1) наименование препарата;
2) указание, что продукт является радиоактивным;
3) наименование и адрес предприятия-изготовителя;
4) общая радиоактивность на указанный день и час (если период полураспада составляет более 30 сут, то указывают только день);
5) дата окончания срока годности «ли период годности;
6) номер или другое указание, по которому можно восстановить по стадиям процесс производства продукта, например, номер серии или партии;
7) для растворов должен быть указан общий объем раствора;
8) специальные условия хранения ,в отношении температуры и света.
ПРИМЕЧАНИЕ. Для растворов вместо указания общей радиоактивности может быть указана радиоактивная концентрация (например, в мкюри или МБк на 1 мл раствора).
При перевозке радиоактивных веществ следует руководствоваться специальными национальными и международными правилами, регламентирующими упаковку и наружное этикетирование.
Хранение
Радиоактивные фармацевтические препараты следует хранить в хорошо укупоренной таре (контейнерах), в местах, предназначенных для этой цели. Условия хранения должны быть такими, чтобы лица, которые могут подвергнуться действию радиации, не получили дозу, превышающую приемлемый уровень. Следует принимать меры для соблюдения национальных требований, касающихся защиты от ионизирующей радиации. Стеклянная тара может темнеть под воздействием радиации.
Специфические свойства радиоактивных препаратов требуют соблюдения особых условий их упаковки, хранения и транспортировки.
Радиоактивные вещества, не используемые в работе, должны находиться в хранилищах, где имеется защита от проникающих излучений и вытяжная вентиляция со специальными фильтрами. Для хранения предусматриваются ниши, колодцы, сейфы, защищенные бетоном, стальными или свинцовыми плитами, снижающими дозы излучений до предельно допустимых.
Хранят α- и мягкие β-излучатели в контейнерах-пеналах из пластмассы. Источники жесткого β-излучения дополнительно экранируют свинцом. γ-Излучатели хранят в свинцовых или чугунных контейнерах. В этих контейнерах осуществляют и транспортировку радиоактивных препаратов.
Хранение радиоактивных веществ в открытом виде (негерметической упаковке) разрешается только в строго установленных количествах.
При транспортировке должны строго соблюдаться особые условия, указанные на этикетках и в сопроводительных документах (допустимые температуры, атмосферное давление, сроки доставки).
При нарушении радиационной упаковки необходимо, не вскрывая защитный контейнер и не проверяя его содержимое, создать комиссию и оформить в установленном порядке акт, а также немедленно известить грузоотправителя, местные органы санитарного надзора. Если при проверке обнаружится частичное или полное отсутствие радиоактивного вещества, то должны быть приняты неотложные меры по установлению местонахождения утраченного количества вещества, выявлению причин этой недостачи и мест возможных загрязнений радиоактивными веществами.
Применяя радиофармацевтические препараты, необходимо строго соблюдать технику безопасности и правила работыс радиоактивными веществами, установленные нормативными актами.
Работа с радиофармацевтическими препаратами допускается только в условиях, исключающих превышение допустимых норм излучения.
1. Халат должен надежно защищать одежду от радиоактивных загрязнений.
2. Работать следует в косынке (шапочке), защитных очках и резиновых (хлорвиниловых) перчатках.
3. После работы необходимо тщательно мыть руки теплой водой с мылом.
4. Для исключения возможности загрязнения радиоактивными веществами руки и одежду периодически проверяют с помощью радиометрических приборов.
Растворы радиофармацевтических препаратов упаковывают и хранят, руководствуясь требованиями ФС и специальными правилами.
Растворы фармакопейных радиофармацевтических препаратов выпускают во флаконах, не только закрытых резиновыми пробками и металлическими колпаками, но и обязательно упакованных в защитные контейнеры.
Флаконы должны иметь этикетку с названием препарата и изотопа,
а к контейнеру прилагают паспорт, в котором указывают активность препарата и содержание в нем химических, радиохимических и радиоизотопных примесей.
Хранят растворы радиофармацевтических препаратов по списку Ав специальных шкафах для радиоактивных веществ, строго соблюдая ОСПОРБ-99 «Основные санитарные правила обеспечения радиационной безопасности».
Срок годности радиофармацевтического препарата определяется такими факторами, как
· стабильность его химического и радиохимического состава;
· уменьшение активности с течением времени по закону радиоактивного распада, т.е. от периода полураспада и составляют от нескольких минут до нескольких суток;
· возрастание относительного состава долгоживущих радионуклидных примесей, имеющих периоды полураспада большие, чем у основного радионуклида.
Срок хранения каждого радиофармацевтического препарата приводится в соответствующей ФС.
После истечения срока годности препараты подлежат возврату на завод-изготовитель. Ни в коем случае не разрешается выбрасывать растворы радиоактивных веществ в канализацию или мусоропроводы (мусорные ящики).
В последние годы в медицине все шире используются радиофармацевтические препараты, меченные позитронизлучающими радионуклидами:
11С с периодом полураспада 20 мин.,
13N — период полураспада 10 мин,
15О — период полурапада 2 мин.
Относительно малый период полураспада указанных радионуклидов не позволяет проводить их аналитический и радиоаналитический контроль в полном объеме и на тех методических принципах, которые используются для других радиофармацевтических препаратов (131I, 123 I, 111 I и др.).
В связи с дополнительными техническими и аппаратными сложностями возникают трудности составления для них НД. Это усугубляется также небольшими объемами производства радиофармацевтических препаратов с короткоживущими радионуклидами за один технологический цикл 3-5 единиц упаковок в серии
Анализ лекарственных веществ в биологических жидкостях. Общее представление о фармакокинетике и биологической доступности. Терминология – константа скорости элиминации, период полуэлиминации, клиренс, объём распределения.
Количественное определение ЛС в биологических жидкостях является основным этапом фармакокинетических исследований ЛС.
Определение ЛС в биологических жидкостях включает в себя следующие стадии:
1)отбор проб и их хранение. Чаще всего определение ЛС проводят в крови (цельной, плазме или сыворотке крови), также бывает необходимо анализировать содержание ЛС в слюне, моче, реже спинномозговой или внутрисуставной жидкости. Время отбора проб после приема анализируемого ЛС определяется задачами исследования. Количество жидкости отбираемое для исследования должно обеспечивать два определения (в слу-
чае если возникнет необходимость повторного измерения). Хранятся пробы в замороженном виде при температуре от -180Си ниже. Так, например при температуре-350С90 % ЛС могут храниться без изменения содержания в течение 6 месяцев. Незначительное число ЛС требуют еще более низкой температуры хранения или не хранятся и должны анализироваться сразу после отбора проб. Пробы могут быть заморожены только один раз. Разморозка, повторная заморозка и затем опять разморозка для анализа недопустимы. Поэтому рекомендуется одну пробу разливать и хранить в двух пробирках: одна берется для анализа, а вторая остается в морозилке для повторного анализа этой пробы в случае необходимости. Все пробы должны иметь четкую, подробную маркировку;
2)выбор метода количественного определения и подбор условий анализа. Для получения достоверных результатов важное значение имеет правильный выбор метода количественного определения ЛС в биологической жидкости, который зависит от химических свойств вещества и задач исследования. Подбор условий анализа может включать выбор аналитической длины волны, состава подвижной фазы и другие в зависимости от метода;
3)изолирование (выделение) ЛС из биологической жидкости с последующим концентрированием. Для этой цели используюттвердо-фазнуюилижидко-фазнуюэкстракцию ЛС из биологической жидкости. Условия экстракции полностью определяются химическими свойствами ЛС. Длятвердо-фазнойэкстракции используют патроны с различными сорбентами (типаSep-Pakили другие).Жидко-фазнаяэкстракция, как правило, осуществляется органическими экстрагентами (хлороформ, эфир, гексан и другие) в необходимой кислой или щелочной среде. Так, например, диклофенак натрия является производнымо-аминофенилуксуснойкислоты, его рКа = 4.0, следовательно, для эффективной экстракции из плазмы крови необходима кислая реакция среды и рН=2.0, что достигается добавлением к пробе 200 мкл 1M раствора о-фосфорнойкислоты. Реже используются и другие способы выделения ЛС, например, осаждение белков 30% раствором НClO4. Концентрирование ЛС достигается путем либо упаривания экстрагента до сухого остатка, который растворяется в нескольких микролитрах растворителя, либо путем реэкстракции;
4)собственно количественный анализ. Как правило, проводится методами абсолютной калибровки или внутреннего стандарта;
5)обработка результатов. В зависимости от поставленной цели исследования проводится статистическая обработка результатов в соответствии
сзадачами исследования, расчет фармакокинетических параметров, расчет оптимального режима дозирования, обсуждение результатов.
т фотоколориметрию. Этот метод применяют, когда нужно определить большие концентрации вещества или
сумму веществ. Недостаток использования фотоколориметрических методик заключается в сравнительно невысокой их точности.
Простотой выполнения и достаточной точностью отличается метод спектрофотометрии в УФ- и видимой областях спектра. Сравнительно невысокая чувствительность спектрофотометрических методик (от 1 мкг/мл до 1 мг/мл) ограничивает применение данного метода для тех групп ЛС, суточная доза которых составляет около 1 г.
По сравнению с УФ-спектрофотометриейчувствительностьфлуориметрического анализа значительно выше (около 0,01 мкг/мл). Особенно высокой чувствительностью отличаются спектрофлуориметрические определения. Недостатком метода является необходимость тщательной очистки испытуемых веществ, так как флуоресцировать могут многие вещества содержащиеся в биологических жидкостях.
Перечисленные методы отличаются большей эффективностью, если их применяют в сочетании с хроматографическими методами.
Тонкослойная хроматография (ТСХ) обладает высокой разрешающей способностью, чувствительностью, а также отличается простотой выполнения. Метод позволяет обнаруживать до 0,025 мг лекарственного вещества. Сочетание с денситометрией позволяет увеличить чувствительность до10-7,а при использовании специальных пластинок для высокоэффективной тонкослойной хроматографии (ВЭТСХ) чувствительность достигает10-9.
Газо-жидкостная хроматография (ГЖХ) позволяет определять мик-
рограммовые и нанограммовые количества ЛС. Относительная погрешность метода + (8-15)%при содержании10-25нг/мл лекарственного вещества в биологической пробе. Метод ГЖХ обладает высокой разрешающей способностью, скоростью, точностью, эффективностью, наличием как специфических, так и универсальных детекторов.
Однако, способность большинства ЛС поглощать в УФ-диапазоне,термолабильность некоторых из них или необходимость получения более летучих производных – все это делает более пригодным для фармакокине-
тических исследований метод высокоэффективной жидкостной хромато-
графии (ВЭЖХ). Чувствительность ВЭЖХ определяется используемым прибором (оборудованием, детектором), а также свойствами анализируемого объекта и может достигать10-9.Благодаря большому количеству различных колонок метод обладает высокой селективностью и разделительной способностью. Это обусловило широкое внедрение метода в практику определения ЛС в биологических жидкостях.
Одним из современных методов анализа является хромато-масс-спектрометрия, в котороммасс-спектрометриспользуется как высокочувствительный детектор к газовому хроматографу (ГХ/МС – метод). Основ-
629
ное достоинство – чрезвычайно высокая чувствительнось, достигающая нескольких пикограммов (10-12).
Внастоящее время активно развивается новый эффективный метод количественного определения – капиллярный электрофорез (КЭФ). КЭФ объединяет различные электрофоретические и хроматографические процессы в единый метод разделения, позволяющий за несколько минут про-
вести воспроизводимые разделения с высоким разрешением при чувствительности до атоммольного уровня (10-18).Объем вводимой пробы составляет5-50нл. КЭФ прост в обслуживании и легко управляется, достигается быстрое разделение на сравнительно коротких колонках. Важным фактором является поддержание постоянства температуры в системе разделения, так как малейшее ее колебание приводит к резкому изменению времени удерживания веществ вследствие изменения вязкости буфера, рН, сопротивления в капилляре.
Для анализа малых концентраций ЛС и их метаболитов в биологических жидкостях широко применяются иммунохимические методы, которые отличаются высокой чувствительностью, специфичностью, простотой исполнения, позволяют одновременно анализировать большое число проб, не требуют дополнительной или специальной очистки пробы или концентрирования и поэтому очень удобны. В основе этих методов лежит специфическая реакция антител с молекулами определяемого вещества (гаптеном).
Фармакокинетика – раздел общей фармакологии, изучающий общие закономерности воздействия организма на лекарственное вещество.
Биодоступность – часть дозы лекарственного вещества, выраженная в процентах, которая достигла системного кровотока после внесосудистого введения.
! Биодоступность при внутривенном введении равна 100%
Биодоступность (F) определяют как отношение площади под фармакокинетической кривой (AUC) при любом пути введения к площади под фармакокинетической кривой при внутривенном введении и обозначают в процентах (рис. 2).
Константа скорости элиминации (обозначение — Ке1, размерность — ч-1, мин-1) — параметр, характеризующий скорость элиминации препарата из организма путем экскреции и биотрансформации. Константа скорости элиминации (kel, мин-1) – показывает, какая часть ЛС элиминируется из организма в единицу времени Kel = Aвыд/Аобщ, где Авыд – количество ЛС, выделяемое в ед. времени, Аобщ – общее количество ЛС в организме.
Значение kel обычно находят путем решения фармакокинетического уравнения, описывающего процесс элиминации лекарства из крови, поэтому kel называют модельным показателем кинетики. Непосредственного отношения к планированию режима дозирования kel не имеет, но ее значение используют для расчета других фармакокинетических параметров.
Константа элиминации прямо пропорциональна клиренсу и обратно пропорционально объему распределения (из определения клиренса): Kel=CL/Vd; [Ke] = час-1/мин-1=доля в час.
Период полуэлиминации (t½, мин) – это время, необходимое для снижения концентрации ЛС в крови ровно наполовину. При этом не играет роли каким путем достигается снижение концентрации – при помощи биотрансформации, экскреции или же за счет сочетания обоих процессов.
Период полуэлиминации определяют по формуле:
![]()
