
817
.pdfСделайте общий вывод о влиянии радиуса, заряда и внешней
электронной оболочки ионов на характер диссоциации гидроксидов. При написании схем диссоциации амфотерных гидроксидов следует учитывать, что в щелочных водных растворах они переходят в комплексные гидроксоанионы. Например, схема диссоциации амфотерного гидроксида
цинка записывается следующим образом:
2OH + Zn+2 + 2H2O = Zn(OH)2 + 2H2O = [Zn(OH)4] 2 + 2H+ .
Опыт 3. Сравнение химической активности кислот
В одну пробирку до 1/3 её объёма налейте 2Н раствор соляной кислоты (НСl) , в другую – столько же 2Н раствора уксусной кислоты (CH3COOH). Выберите два одинаковых кусочка цинка и в каждую пробирку бросьте по одному кусочку. В каком случае водород выделяется более энергично? Напишите ионные уравнения реакций. Объясните различие в скоростях реакций.
Опыт 4. Смещение равновесия диссоциации слабого электролита
а) Влияние разбавления раствора на степень электролитической диссоциации.
Встакан на 100 мл налейте 25 мл концентрированной уксусной кислоты и накройте стакан крышкой с укрепленными электродами (прибор для исследования электропроводности раствора из предыдущего опыта). Замкните цепь. Хорошо ли проводит ток концентрированная уксусная кислота?
Разведите раствор уксусной кислоты: к 20 мл дистиллированной воды добавьте 5 мл концентрированной уксусной кислоты. Вновь измерьте проводимость раствора. Разбавьте полученный раствор еще
впять раз, испытайте проводимость и этого раствора. Как изменяется свечение лампочки? В какую сторону сместилось равновесие диссоциации уксусной кислоты при разбавлении раствора? Объясните наблюдаемое явление, запишите константы диссоциации.
б) Влияние добавления соли слабой кислоты на степень диссоциации этой кислоты.
Вдве пробирки налейте по 1мл 0,1 Н раствора уксусной кислоты. В каждую пробирку добавьте по 2 – 3 капли индикатора метилового оранжевого. Как окрасился индикатор под влиянием ионов водорода? Одну пробирку оставьте в качестве контрольной, в другую добавьте несколько кристаллов сухой соли ацетата натрия
21
(CH3COONa). Перемешайте содержимое пробирки и сравните цвет полученного раствора с цветом раствора в контрольной пробирке.
Напишите уравнение диссоциации уксусной кислоты и выражение константы диссоциации. Объясните, как смещается равновесие диссоциации уксусной кислоты при добавлении к ней ацетат-ионов СН3СОО ? Как меняется при этом степень диссоциации уксусной кислоты и концентрация ионов водорода? Увеличится или уменьшится степень диссоциации уксусной кислоты при добавлении к ней сильной кислоты?
в) Влияние добавление соли слабого основания на степень диссоциации этого основания
Налейте в две пробирки по 1,0 мл 0,1 Н раствора аммиака. В каждую пробирку добавьте по две капли фенолфталеина. Как окрашивается раствор индикатора под влиянием гидроксил-ионов?
Одну пробирку оставьте в качестве контрольной, в другую добавьте несколько кристаллов сухого хлорида аммония (NH4Cl) . Перемешайте содержимое пробирки и сравните окраску полученного раствора с окраской раствора в контрольной пробирке. На увеличение или уменьшение концентрации ионов ОН указывает изменение окраски раствора?
Напишите уравнение диссоциации гидроксида аммония NH4OH. Объясните смещение равновесия диссоциации при добавлении к раствору хлорида аммония. Увеличилась или уменьшилась при этом степень диссоциации гидроксида аммония?
Лабораторная работа № 5
ПРОТОЛИТИЧЕСКОЕ РАВНОВЕСИЕ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ. КИСЛОТНО - ОСНОВНЫЕ ИНДИКАТОРЫ
Вода является слабым электролитом. Процесс диссоциации
воды на ионы происходит лишь в незначительной степени: Н2О = Н+ + ОН– .
Константа равновесия этого процесса называется ионным произведением воды и равна:
Кw= Н+ ОН- = 10 –14.
22

В нейтральном растворе количество ионов водорода равно количеству гидроксил-ионов Н+ = ОН– = 
 KW =10–7. В
KW =10–7. В
разбавленных растворах кислот концентрация ионов водорода также незначительна. Проводить вычисления с такими величинами неудобно, поэтому используют отрицательный логарифм этих чисел. Его называют водородным показателем и обозначают рН.
рН = – lg Н+ .
Тогда для нейтральных растворов рН = – lg(10 –7) = 7. Если концентрация ионов водорода равна 1 моль/л, то рН = – lg1= 0. В сильно щелочной среде, где концентрация гидроксил-ионов составляет 1 моль/л, концентрация ионов водорода Н+ =
K |
1014 |
|
|
|
W |
|
|
14 |
|
OH |
|
10 |
|
. В кислой среде рН 7, а в щелочной среде рН 7. |
1 |
|
|||
Кислотно-основными индикаторами называют химические вещества, имеющие различную окраску при разных концентрациях ионов водорода и гидроксил-ионов, то есть в кислой, нейтральной и щелочной средах. В большинстве случаев индикаторами являются слабые органические кислоты или основания, недиссоциированные молекулы которых имеют одну окраску, а ионы – другую. В общем виде кислотные индикаторы обозначаются как HInd, а основные –
IndOH. Тогда для кислотного индикатора равновесие
HInd = H+ + Ind–
в кислой среде смещено влево, раствор имеет окраску недиссоциированных молекул. В щелочной среде, наоборот, равновесие смещается вправо, в растворе возрастает число ионов, окраска раствора становится такой, как у ионов. Для основного индикатора равновесие IndOH + Н+ = Ind+ + Н2О в кислой среде смещается вправо, раствор имеет окраску, характерную для катионов, а в щелочной среде равновесие сдвигается влево, раствор приобретает окраску недиссоциированных молекул. Изменение окраски индикатора происходит постепенно, в определенном интервале значений рН, который называют интервалом перехода индикатора. Например, индикатор метиловый оранжевый в кислой среде до рН = 3 имеет красную окраску, после рН = 4,4 имеет желтую окраску, а в интервале перехода – оранжевую. Для каждого индикатора существует специфический для него интервал перехода (смотри прил. 2). Универсальным индикатором называют смесь нескольких индикаторов с различными интервалами перехода.
23
Экспериментальная часть
Опыт 1. Окраска кислотно-основных индикаторов в кислой и щелочной средах
Приготовьте 5 пробирок с раствором 0,1 N НCl и 5 пробирок с 0,1 N раствором NaOH. Пронумеруйте пробирки с кислотой от 1 до 5, а со щелочью – от 1а до 5а. Внесите в пробирки индикаторы согласно табл. 4.
|
Таблица 4 |
|
|
|
|
Номера пробирок |
индикатор |
|
1 и 1а |
Малахитовый зеленый |
|
2 и 2а |
Метиловый оранжевый |
|
3 и 3а |
Бромфеноловый красный |
|
4 и 4а |
Бромтимоловый синий |
|
5 и 5а |
Феноловый красный |
|
Вычислите рН растворов кислоты и щелочи, считая, что степень электролитической диссоциации = 1. Запишите свои наблюдения в табл. 5
|
|
|
Таблица 5 |
|
|
|
|
Номера пробирок |
Индикатор |
Наблюдаемая окраска |
|
|
|
Кислая среда |
Щелочная среда |
Пользуясь прил. 2, составьте для исследованных индикаторов схемы изменения их окраски при различных значениях рН (табл. 6).
Таблица 6
Индикатор |
Интервал перехода |
|
|
|
|
Окраска индикатора |
|
|
|
||||||
|
окраски |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
Метиловый |
3,1 – 4,4 |
Красная |
|
Ж е л т а я |
|
|
|
|
|
|
|||||
оранжевый |
|
------ |
|
|
|
--------------------------------------- |
|
|
|
|
|
|
|
|
|
Опыт 2. Определение рН раствора визуально-колориметрическим методом
Получите у преподавателя раствор, для которого необходимо определить кислотность среды. Приготовьте 6 пробирок, в каждую
24
добавьте по 2 мл исследуемого раствора. В пробирку №1 внесите индикатор малахитовый зеленый, в № 2 – метиловый оранжевый, в №3 – бромфеноловый красный, в №4 – бромтимоловый синий, в №5 – феноловый красный, в №6 – ализариновый красный С. Пользуясь табл. 3, составленной в опыте 1, определите рН исследуемого раствора. Учтите, что индикатор ализариновый красный С имеет два интервала перехода: в интервале рН от 3,7 до 5,2 окраска индикатора меняется из желтой в фиолетовую, а в интервале от 10 до 12 – из фиолетовой в бледно-желтую.
Опыт 3. Определение рН раствора при помощи универсальной индикаторной бумаги
Проверьте, правильно ли определен рН в опыте 2 с помощью универсальной индикаторной бумаги. Для этого полоску индикаторной бумаги погрузите на несколько секунд в исследуемый раствор и сравните окраску сырой полоски бумаги со шкалой, помещенной на внутренней стороне обложки книжки с полосками индикаторной бумаги.
Лабораторная работа №6
ГИДРОЛИЗ СОЛЕЙ
Гидролизом солей называется реакция ионного обмена между молекулами соли и воды, в результате которой изменяется кислотность среды (рН). Рассмотрим типичные случаи гидролиза солей.
1.Соль, образованная слабым основанием и сильной кислотой.
Примером такой соли может служить хлорид меди CuCl2. Эта соль образована слабым основанием – гидроксидом меди и сильной соляной кислотой. Равновесие в реакции будет смещено в сторону образования слабого электролита, то есть
Cu+2 + H+OH = CuOH+ + H+.
В растворе накапливаются ионы водорода, среда становится кислой, что препятствует протеканию этой реакции по второй ступени, поэтому гидроксид меди Cu(OH)2 не образуется.
Полное ионное уравнение имеет вид:
Cu+2 + 2Cl + H2O = CuOH+ + H+ + 2Cl .
25
В молекулярном виде уравнение гидролиза хлорида меди запишем следующим образом:
CuCl2 + H2O = CuOHCl + HCl.
То есть при гидролизе соли, образованной слабым основанием и сильной кислотой, образуется основная соль и кислая реакция среды.
2.Соль, образованная сильным основанием и слабой кислотой.
Примером такой соли служит карбонат натрия Na2CO3.
Эта соль образована сильным основанием – гидроксидом натрия и слабой угольной кислотой. Равновесие будет смещено в сторону образования слабого электролита – угольной кислоты:
CO3 2 + H+OH = HCO3 + OH .
В растворе накапливаются гидроксил-ионы, среда становится щелочной, поэтому по второй ступени реакция практически не идет, и угольная кислота не образуется.
Полное ионное уравнение имеет вид:
2Na+ + CO3 2 + H2O = 2Na+ + HCO3 + OH .
В молекулярном виде уравнение гидролиза карбоната натрия запишем так:
Na2CO3 + H2O = NaHCO3 + NaOH.
То есть при гидролизе соли, образованной сильным основанием и слабой кислотой, получается кислая соль и щелочная реакция среды.
3.Соль, образованная слабым основанием и слабой кислотой.
Примером такой соли является ацетат алюминия Al(CH3COO)3. Эта соль образована слабым основанием – гидроксидом алюминия и слабой уксусной кислотой. Уксусная кислота, являясь слабым электролитом, все же растворима в воде, а гидроксид алюминия в воде нерастворим, то есть он – более слабый электролит, равновесие будет смещено в сторону образования гидроксида
алюминия.
Al+3 + H+OH = AlOH+2 + H+.
В растворе накапливаются ионы водорода, поэтому образование дигидроксокатиона алюминия Al(OH)2+ , и тем более гидроксида алюминия не происходит.
Полное ионное уравнение имеет вид:
Al+3 + 3CH3COO + H2O = AlOH+2 + H+ + 3CH3COO .
Молекулярное уравнение гидролиза:
Al(CH3COO)3 + H2O = AlOH(CH3COO)2 + CH3COOH.
26
При гидролизе соли, образованной слабым основанием и слабой кислотой, образуется основная соль и слабокислая среда.
Если же соль образована слабым нерастворимым основанием и слабой летучей или нестойкой кислотой, то в водном растворе такая соль будет подвергаться полному гидролизу. Нерастворимое основание будет выпадать в осадок, а кислота – разлагаться на воду и летучий оксид (например, угольная кислота будет распадаться на воду и углекислый газ) или сама в виде газообразного соединения удаляться из раствора (например, сероводородная кислота). Примером полного гидролиза может служить реакция сульфида хрома с водой:
Cr2S3 + 6H2O = 2Cr(OH)3 + 3H2S.
В ионно-молекулярном виде реакцию запишем следующим образом:
2Cr+3 + 3S + 6H2O = 2Cr(OH)3 + 3H2S.
4.Соли, образованные сильным основанием и сильной кислотой,
гидролизу не подвергаются. Сильные электролиты полностью диссоциируют на ионы, равновесие в реакции с водой полностью смещается влево, ни основные, ни кислые соли не образуются, реакция среды остаётся нейтральной.
Рассмотрим пример вычисления рН раствора соли (МеА, где Ме
– это ион металла, а А – кислотный остаток), образованной сильным основанием (МеОН) и слабой кислотой (НА). Необходимо учитывать, что в этом растворе установилось три равновесия:
МеА = Ме+ + А (диссоциация соли); Н2О = Н+ + ОН (диссоциация воды);
А + Н+ = НА (образование слабой кислоты). Если суммировать эти реакции, то получим
МеА + Н2О = МеОН + НА, или в сокращенном ионном виде
А + Н2О + НА + ОН .
Обозначим концентрацию раствора соли буквой С, тогда
степень гидролиза этой соли будет равна НА , то есть
С
концентрация образующейся слабой кислоты [HA] = С . Так как концентрация образующейся слабой кислоты равна концентрации образующихся в этой же реакции гидроксил – ионов, то есть [HA] = [OH ], то концентрация свободных анионов (кислотных остатков) [A ] =C – [HA] = C - C = C(1 - ).
27

Константа равновесия процесса гидролиза будет равна
НА ОН К А Н2О .
Концентрация воды – это величина постоянная, её можно внести под знак константы, тогда выражение для константы гидролиза примет вид
Кгидр |
НА ОН |
А . |
Умножим числитель и знаменатель на концентрацию ионов водорода [H+]. При этом получим следующее выражение:
Кгидр |
НА ОН Н |
А Н . |
Заметим при этом, что произведение концентраций ионов водорода и гидроксил-ионов – это есть величина постоянная – ионное произведение воды Кw, а произведение концентраций ионов водорода и ионов кислотного остатка – это константа ионизации (диссоциации) слабой кислоты КА. То есть константа гидролиза обратно пропорциональна константе диссоциации кислоты.
Кгидр Кw .
KA
Чем слабее кислота, образующая соль, тем больше константа гидролиза этой соли. Если подставить в уравнение для константы гидролиза значения концентраций молекул слабой кислоты, гидроксил-ионов и ионов кислотного остатка, то получим следующее выражение:
К |
С С |
|
С2 2 |
|
|
С 2 |
|
|
С (1 ) |
С (1 ) |
1 . |
||||||
гидр |
|
|
||||||
Так как степень гидролиза обычно намного меньше 1, то степень гидролиза примерно равна
|
Кгидр |
|
Кw |
, |
|
С |
KA C |
||||
|
|
а концентрация ионов водорода в растворе соли, подвергающейся гидролизу, вычисляется по формуле
28
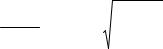
|
|
Кw |
Kw |
|
Kw KA |
||
Н |
|
OH |
|
|
|
|
. |
C |
|
C |
|||||
Кроме силы электролита, образующего соль (константы диссоциации), на степень гидролиза оказывают влияние температура и степень разбавления раствора.
Экспериментальная часть
Опыт 1. Реакция среды в растворах различных солей
В шесть пробирок до 1/3 их объёма налейте нейтральный раствор лакмуса. Одну пробирку оставьте в качестве контрольной, а в остальные добавьте несколько кристалликов следующих солей: в первую – ацетат натрия CH3COONa, во вторую – хлорид алюминия AlCl3, в третью – силикат натрия Na2SiO3, в четвертую – сульфат железа ( ) FeSO4, в пятую – хлорид калия KCl. Обратите внимание, как изменилась окраска раствора лакмуса. Результаты опыта занесите в табл. 7.
|
|
|
|
Таблица 7 |
|
|
|
|
|
№ |
Формула соли |
Окраска раствора |
Реакция среды |
рН раствора |
пробирки |
|
лакмуса |
|
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
5 |
|
|
|
|
Напишите ионные и молекулярные уравнения реакций гидролиза солей. Сделайте вывод о том, какие соли подвергаются гидролизу и как при этом изменяется реакция среды в растворах.
Опыт 2. Влияние температуры на степень гидролиза соли
В пробирку внесите 1 – 2 мл раствора хлорида алюминия и такой же объём раствора ацетата натрия. Запишите реакцию образования ацетата алюминия. Будет ли эта соль подвергаться гидролизу? Запишите уравнение реакции гидролиза, протекающей по первой ступени. Нагрейте пробирку до кипения раствора. Наблюдайте образование белого осадка основной соли алюминия Al(OH)2CH3COO. По какой ступени должна проходить реакция гидролиза ацетата алюминия, чтобы образовался дигидроксоацетат
29
алюминия? Напишите реакцию ступенчатого гидролиза ацетата алюминия.
Опыт 3. Влияние силы кислоты, образующей соль, на степень гидролиза этой соли
В две пробирки до 2/3 их объёма налейте дистиллированной воды. В одну пробирку насыпьте несколько кристалликов сульфита натрия Na2SO3, в другую пробирку – столько же кристалликов карбоната натрия Na2CO3. В каждую пробирку добавьте по одной капле раствора фенолфталеина. Сравните интенсивность окраски растворов. О чем это говорит? В каком растворе концентрация гидроксид-ионов выше? Степень гидролиза какой соли больше? Напишите ионные и молекулярные уравнения реакций гидролиза этих солей. Выпишите из прил. 1 константы диссоциации сернистой и угольной кислоты. Сделайте вывод о том, как влияет на степень гидролиза соли сила кислоты, образующей эту соль.
Опыт 4. Влияние разбавления раствора на степень гидролиза
соли
В пробирку внесите 2 – 3 капли раствора нитрата висмута Bi(NO3)3, постепенно добавьте несколько капель дистиллированной воды. Наблюдайте образование белого осадка дигидроксонитрата висмута. Напишите ионные и молекулярные уравнения гидролиза нитрата висмута по первой и второй ступеням. Как влияет разбавление раствора на степень гидролиза соли?
Опыт 5. Случаи полного (необратимого) гидролиза солей
В пробирку налейте 2 – 3 мл раствора хлорида алюминия и такое же количество раствора карбоната натрия. Отметьте выделение пузырьков углекислого газа и образование белого гелеобразного осадка. Напишите уравнение реакции, в результате которой образовался гидроксид алюминия и углекислый газ. Почему в растворе не образовался карбонат алюминия? Сделайте вывод о том, какие соли подвергаются полному гидролизу.
30
