
625
.pdfФизическая адсорбция осуществляется за счет сил Ван-дер- Ваальса и водородных связей, которые вызывают конденсацию газов. Адсорбат стремится целиком занять всю поверхность адсорбента, но этому препятствует процесс, противоположный адсорбции, – десорбция, вызванный, как и диффузия, стремлением к равномерному распределению вещества вследствие теплового движения. Физическая адсорбция универсальна, то есть не зависит от природы адсорбента и адсорбата, и всегда обратима. Теплота процесса физической адсорбции невелика и соизмерима с теплотой конденсации. Физическая адсорбция является экзотермическим процессом, поэтому повышение температуры уменьшает адсорбцию. Пример – адсорбция
инертных газов на угле. |
|
|
|
|
Хемосорбция осуществляется за счёт х |
м |
ческ х сил, поэтому |
||
десорбция протекает с |
д |
часто |
вещество |
|
большим трудом |
||||
десорбируется химически |
изменённым. |
Х м ческая |
адсорбция |
|
|
а |
|
|
|
обусловлена химической реакцией на поверхностииадсорбента, она |
||||
зависит от природы адсорбента и сорб та и в большинстве случаев необратима. Часто физическая дсор ция предшествует химической – адсорбат, адсорбированный поверхностно в результате физических сил, затем связывается с адсор ентом уже химическими силами.
Теплота абсорбц |
меет порядок теплот химических реакций. |
|
|
|
б |
Протекает хемосорбц я обычно при сравнительно высоких |
||
температурах. Повышение температуры способствует адсорбции. |
||
|
и |
|
С |
|
|
Обменная адсорбция – обмен ионов между двойным электрическим слоем адсорбента и средой. При обменной адсорбции адсорбент, поглощая определённое количество других ионов, выделяет одновременно в раствор эквивалентное количество других ионов того же знака, вытесненных с поверхности.
Адсорбция может протекать в двух случаях:
1)на поверхности жидкости, при этом возможные границы «жидкость – жидкость», «жидкость – газ»;
2)на поверхности твердого тела, возможные границы «твердое – жидкость», «твердое – газ».
31
Дисперсные системы как адсорбенты характеризуются большой поверхностью раздела фаз и обладают значительной адсорбционной активностью. У пористых адсорбентов резко увеличивается площадь раздела фаз не только в результате дисперсности, но и за счёт площади самих пор (активированный уголь, силикагель – это аэрогель обезвоженной кремниевой кислоты).
Адсорбент с развитой внутренней поверхностью характеризуется удельной поверхностью Sуд, т.е. поверхностью, приходящейся на 1 г сорбента. Удельная поверхность измеряется в м2/г; например, для активированного угля Sуд = 500 м2/г.
Количественное описание процесса адсорбции проводят с двух позиций:
1. Измерение абсолютного количества адсорб рованного веще- |
||||||||
ства в поверхностном слое, |
|
|
д |
|
||||
или абсолютной вел ч ны адсорбции а, |
||||||||
на единице площади (или единице массы) а сорбента: |
|
|||||||
|
|
a = |
CS VS |
, |
и |
(9) |
||
|
|
|
|
|||||
|
|
|
|
S |
|
|
|
|
где CS |
− концентрация вещества в поверхностном слое; VS − объем |
|||||||
|
и |
|
|
|
|
|||
поверхностного слоя; S − площадьаповерхности адсорбента. |
|
|||||||
2. Измерение адсор ци |
а как из ыточного количества вещества |
|||||||
|
С |
|
|
|
|
|
|
|
в поверхностном слое побсравнению с его содержанием в объеме |
||||||||
фазы: |
|
a = V (C0 −CV ) |
|
|
||||
|
|
, |
(10) |
|||||
|
|
|
|
S |
|
|
|
|
где C0 − исходная концентрация вещества в объеме фазы; CV − равновесная концентрация в объеме фазы.
Количество адсорбированного вещества на поверхности а, или величина адсорбции, измеряется в моль/м2 или в моль/г; то есть количество молей адсорбата относится к единице площади поверхности или к единице массы адсорбента.
Адсорбция на границе раздела «жидкость–газ». Растворённые вещества могут изменять поверхностное натяжение растворителя. При адсорбции в поверхностном слое увеличивается концентрация вещества с наименьшим поверхностным натяжением. Следствием
32

этого является снижение поверхностной энергии в системе. Величина адсорбции а связана с поверхностным натяжением σ
(11)
где dσ/dС – изменение поверхностного натяжения при адсорбции; С – концентрация адсорбируемого вещества; R – универсальная газовая постоянная; Т – температура.
Уравнение изотермы Гиббса позволяет экспериментально установить зависимость адсорбции от концентрации растворённого вещества.
Величиной, учитывающей адсорбционную способность вещества, является способность его к понижению поверхностного натяжения – поверхностная активность G, которая представляет собой производную dσ/dС, взятую с отр цательным знаком, при
стремлении концентрации вещества к 0: |
.и |
|
|||
а |
|
||||
G = −( |
dσ |
)C→0 |
(12) |
||
|
dC |
|
|
||
б |
дктивности показывает, |
|
|||
Величина поверхностной |
|
как |
|||
изменяется поверхностное натяжение при увеличении концентрации адсорбата. В завис имости от знака G можно выделить две группы растворимых веществ:
1. ВеществаС, для которых G > 0 (поверхностное натяжение уменьшается с увеличением концентрации веществ), называют поверхностно-активными (ПАВ). Поскольку наличие молекул ПАВ в поверхностном слое энергетически выгодно dσ/dС < 0, то происходит самопроизвольное концентрирование растворённого вещества на межфазной границе. В отношении воды ПАВ являются органические вещества, имеющие неполярную (углеводородную) и полярную части. Полярной частью могут быть функциональные группы −ОН,
−СООН, −SО2ОН, −ОSО2ОМе и др.
2. Вещества, для которых G < 0, являются поверхностноинактивными (ПИАВ). ПИАВ в отношении воды являются многие неорганические соединения (соли, кислоты), которые сильно взаимодействуют с молекулами воды.
33
Поверхностная активность тем выше, чем больше уменьшается σ при добавлении тех же количеств веществ.
Высокая поверхностная активность коллоидных ПАВ зависит главным образом от длины углеводородного радикала. Согласно правилу Дюкло − Траубе, увеличение длины радикала на одну группу −СН2− приводит к возрастанию поверхностной активности приблизительно в 3,2 раза.
|
|
|
∂σ |
|
|
||
|
− |
|
|
|
|
||
|
|
|
∂С n+1 |
= 3,2. |
(13) |
||
|
|
|
|
||||
|
− |
∂σ |
|
|
|
||
|
|
|
|
|
|
||
∂C |
|
|
|||||
|
|
|
|
n |
|
|
|
Это правило справедливо для истинно растворимых ПАВ, т.к. |
|||||||
поверхностную активность определяют при бесконечном разбавлении системы. Чем длиннее радикал, тем сильнее выталк ваются ПАВ из
водного раствора (уменьшается раствор мость). Молекулы идут к |
||||
|
|
|
и |
|
поверхности раздела фаз, в результ те поверхностное натяжение |
||||
раствора понижается. |
|
д |
положительную |
|
|
|
|||
В зависимости от показ теля dσ/dС |
р зличают |
|||
и отрицательную адсор цию: |
а |
|
|
|
|
|
|
||
а) для ПАВ − если dσ/dС < 0, |
а > 0 – положительная адсорбция, |
|||
т.е. концентрация в поверхностном слое больше, чем в глубине фазы; |
||
|
б |
|
б) для ПИАВ − если dσ/dС |
> 0, а < 0 – отрицательная |
|
адсорбция, при этом иповерхностное натяжение несколько возрастает в |
||
С |
|
|
результате того, что в растворах сильных электролитов поверхностные молекулы воды втягиваются внутрь раствора с большей силой, чем в чистой воде.
Рассмотрим адсорбцию на поверхности раздела «раствор – воздух». Молекулы спиртов (ROH) в поверхностном слое раствора самопроизвольно ориентированы таким образом, что неполярная углеводородная часть радикала выходит из воды в соседнюю неполярную фазу (воздух), а полярная гидрофильная группа – ОН взаимодействует с водой и остается в водной фазе (рис. 3).
34

Воздух 
 Раствор ПАВ
Раствор ПАВ
Рис. 3. Схема ориентации молекул ПАВ
Такая ориентация и обеспечивает снижение свободной поверхностной энергии раствора и поверхностного натяжения.
Цель работы – изучить процесс адсорбции и влияние на него различных факторов.
Выполнение лабораторной работы
Опыт № 1. |
и |
|
Адсорбция ионов св нца |
з растворов |
|
|
д |
объема 0,05%-ный |
В две пробирки налить до полов ны х |
||
раствор нитрата свинца. В одну из них обавить раствор K2Cr2O7 и наблюдать осаждение желтого PbCrO4. Во вторую пробирку прибавить около 1 г активиров нного угля, закрыть пробкой и
встряхивать 3 мин. После этого р створ отфильтровать в чистую |
|
пробирку и добавить K2Cr2O7а. О ъяснить различную реакцию с |
|
бихроматом калия растворов в первой и второй пробирках. |
|
|
б |
Опыт № 2. Вытеснение с поверхности адсорбента |
|
и |
|
С |
одного вещества другим |
|
|
2.1. В три пронумерованные конические колбы на 250 см3 налить пипеткой по 20 см3 0,1 н. раствора уксусной кислоты. В колбы № 1 и 2 добавить по 20 см3 дистиллированной воды, а в колбу № 3 − 20 см3 ацетона. Колба № 1 является контрольной. В колбы № 2 и 3 внести по 1,0 г активированного угля и взбалтывать жидкость в каждой колбе в течение 5 мин.
2.2. Содержимое колб отфильтровать в другие такие же колбы с соответствующими номерами. Отобрать из каждой колбы при помощи пипетки по 10 см3 фильтрата, добавить по 2 капли раствора фенолфталеина и титровать каждую порцию фильтрата 0,1 н.
35
раствором гидроксида натрия. Результаты определения занести в табл. 10.
2.3. Количество гидроксида натрия, соответствующее адсорбированной углем кислоте, найти по разности количеств NaOH, пошедших на титрование раствора в первой и остальных колбах.
Число миллилитров (см3) NaOH, пошедшее на титрование раствора в первой колбе, принять за 100%. Вычислить количество адсорбированной углем кислоты (в %).
Таблица 10
Результаты титрования и определение количества адсорбированной углем кислоты
|
Содержимое колб |
|
|
|
Номер колбы |
|||
|
|
|
|
|
|
1 |
2 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
д |
|
|
|
|
Уксусная кислота, мл |
|
|
|
|
20 |
20 |
20 |
|
Дистиллированная вода, мл |
|
|
|
|
20 |
20 |
- |
|
|
|
а |
|
|
|
|
||
Ацетон, мл |
|
|
|
|
и |
- |
- |
20 |
Активированный уголь, г |
|
|
|
|
- |
1 |
1 |
|
|
|
б |
|
|
|
|
|
|
Объем раствора NaOH, пошедшего на титров ние, мл |
|
|
|
|||||
Объем раствора NaOH, соответствующий |
дсорбированной |
|
|
|
||||
углем кислоте, мл |
|
|
|
|
|
|
|
|
Количество адсорбированной углем кислоты, % |
|
|
|
|
||||
|
С |
|
|
|
|
|
|
|
Объяснить, почему при одинаковой концентрации уксусной |
||||||||
кислоты процент адсорбированнойи |
уксусной кислоты в колбах № 2 и |
|||||||
3 различен. |
|
|
|
|
|
|
|
|
Опыт № 3. Влияние среды на адсорбцию
В три пронумерованные пробирки прилить по 5 см3 0,05%-ного раствора метиленового синего. Во вторую добавить 5 капель 2 н. раствора HCl, в третью − 5 капель 2 н. раствора NaOH. В каждую пробирку внести несколько белых шерстяных ниток, оставить на 20 − 30 мин, после чего слить растворы и тщательно промыть нитки холодной водой.
Отметить окраску шерсти в разных пробирках.
36
Объяснить различное окрашивание шерсти в щелочных, нейтральных и кислых растворах. При этом следует учесть, что белок шерсти имеет в кислых растворах положительный заряд, а в щелочных растворах − отрицательный.
Сделать вывод по результатам проделанного опыта.
Лабораторная работа № 5
ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ПОВЕХНОСТИ АКТИВИРОВАННОГО УГЛЯ
План коллоквиума
1. Адсорбция на твердой поверхностии. Теор я мономолеку-
лярной адсорбции и уравнение Ленгмюра, определение удельной |
|||
поверхности адсорбента. |
|
д |
|
|
|
||
2. Уравнение Генри и уравнение Фрейн лиха для описания |
|||
изотерм адсорбции. |
б |
|
|
3. Теория полимолекулярной дсорбции БЭТ, ее основное |
|||
уравнение. |
и |
|
|
4. Адсорбция на пористыхателах. Теория объемного заполнения |
|||
микропор. |
С |
|
|
|
|
|
|
|
Теорет ческ е основы выполнения работы |
||
Адсорбция на твердой поверхности. Единой теории, которая достаточно корректно описывала бы все виды адсорбции, нет, поэтому рассмотрим наиболее распространенные теории, описывающие отдельные виды адсорбции на поверхности раздела «твердое тело – газ» или «твердое тело – раствор».
Теория мономолекулярной адсорбции Ленгмюра (1915 г.)
основывается на следующих положениях:
1.Адсорбция является локализованной и вызывается силами, близкими к химическим.
2.Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на
37

поверхности адсорбента. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других) и тождественными.
3.Каждый активный центр способен взаимодействовать только
содной молекулой адсорбата, в результате на поверхности может образоваться только один слой адсорбированных молекул.
4.Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; через некоторое время между процессами адсорбции и десорбции устанавливается
динамическое равновесие.
Количество адсорбированного веществаи(или величина адсорбции) на поверхности твердого тела зав с т от его исходной концентрации в фазе, контактирующейдс адсорбентом. Эта зависимость при постоянной температуре нос т название изотермы адсорбции. Для мономолекулярнойаа сорбции (адсорбции в один молекулярный слой на поверхности) изотерма описывается уравнением Ленгмюра би
адсорбция; С С– исходная концентрация адсорбата; К − константа адсорбционного равновесия.
Проанализируем уравнение. При малых концентрациях (1+К·С)→1, тогда выражение сводится к виду А = А∞·К·С (линейная зависимость адсорбции от концентрации адсорбата).
При больших концентрациях К·С ≈ 1+К·С, тогда А = А∞, что соответствует состоянию насыщения, когда вся поверхность адсорбента покрыта слоем молекул адсорбата.
Уравнение Ленгмюра применяют при определении удельной
поверхности адсорбента Sуд: |
|
Sуд = А∞·NA·Sо, |
(15) |
где NA − постоянная Авогадро; Sо − площадь, занимаемая одной молекулой в насыщенном адсорбционном слое.
38
|
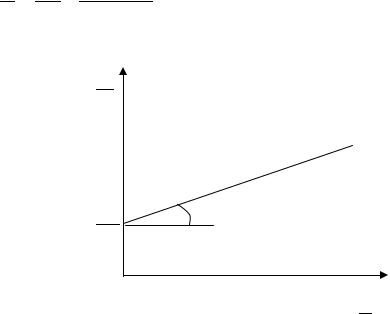
Величину А∞ |
находят из уравнения Ленгмюра. Для этого |
|||||||||||
уравнение переводят в линейную форму: |
|
|
|
||||||||||
|
|
|
|
1 = |
1 |
+ |
|
1 |
C |
. |
|
(16) |
|
|
|
|
|
A |
A∞ |
|
A∞ K |
|
|
|
|||
|
Далее из графика зависимости 1/А от 1/С находят А∞ и К (рис. 4). |
||||||||||||
|
При |
незначительном |
|
за- |
|
1 |
|
|
|
|
|
||
полнении |
адсорбента |
адсорба- |
|
А |
|
|
|
|
|
||||
том |
отношение |
концентрации |
|
|
|
|
|
|
|
||||
веществ в адсорбированном слое |
|
|
|
|
|
|
|
||||||
и в объёме стремится к |
|
|
|
|
|
|
|
||||||
постоянному значению, |
равному |
|
1 |
|
|
и |
tgα=1/K·A∞ |
||||||
k. Эта закономерность отражена |
|
А∞ |
|
|
|
||||||||
в уравнении Генри: |
|
|
|
|
|
|
|
|
|
||||
|
Г(А) =k C , |
|
|
(17) |
|
|
|
|
1 |
||||
где С – концентрация адсорбата, |
|
|
|
|
|||||||||
|
|
|
|
C o |
|||||||||
k – константа распределения, не |
|
|
|
|
|||||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|||||||
зависящая от концентрации. |
|
|
|
|
|
Рис. 4. Графическое опреде- |
|||||||
|
При малых концентрациях |
|
|
д |
|
предельной |
|||||||
|
|
|
|
ление величины |
|||||||||
уравнение |
Ленгмюра |
превра- |
|
|
|
адсорбции |
А∞ |
константы |
|||||
|
|
|
|
|
|
а |
|
|
|
||||
щается в уравнен е Генри. В |
|
|
|
|
|
|
|
||||||
более общем виде зав с мость адсорбции от концентрации адсорбата |
|||||||||||||
|
|
|
|
б |
|
|
|
|
|
||||
можно определить при помощи уравнения Фрейндлиха |
|
||||||||||||
|
|
|
иГ(А) =k C1/ n , |
|
|
(18) |
|||||||
где k, n – коэффициенты. |
|
|
|
|
|
|
|
|
|
||||
|
|
С |
уравнения |
|
|
Фрейндлиха |
определяются |
||||||
|
Коэффициенты |
|
|
||||||||||
графически. Для этого логарифмируют уравнение Фрейндлиха (18), |
|||||||||||||
получают |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
lg Г(А) =lgk +(1/ n)lgC . |
|
(19) |
||||||||
|
Зависимость между lgГ и lgС характеризуется прямой линией, |
||||||||||||
тангенс угла наклона которой равен 1/n, а отрезок, отсекаемый на оси |
|||||||||||||
ординат, – lgk. Изотерма адсорбции, которая соответствует |
|||||||||||||
уравнению Фрейндлиха, не позволяет определить величину |
|||||||||||||
предельной адсорбции. |
|
|
|
|
|
|
|
|
|
|
|||
39
Теория полимолекулярной адсорбции БЭТ. Теория развита Брунауэром, Эммером и Теллером в 1935 – 1940 гг. Во многих случаях мономолекулярная адсорбция не полностью компенсирует избыточную поверхностную энергию. При этом возможно образование нескольких адсорбционных слоев, это явление называется полимолекулярной адсорбцией. Современная теория полимолекулярной адсорбции является продолжением теории Ленгмюра и носит название теории полимолекулярной адсорбции БЭТ. Основное уравнение этой теории имеет вид
|
А = А∞ |
|
C′ p / pS |
|
, |
(20) |
|
(1 |
− p / pS ) [1+(C′−1) p / |
pS ] |
|||
где р |
|
|
и |
рS |
|
|
− давление пара адсорбата при адсорбц |
; |
− давление |
||||
телах необходимо учитывать р змерыдоткрытых пор. Для описания адсорбции на микропористыхбтел х (р змеры пор > 100−200 нм)
насыщенного пара адсорбата; С′ − константа адсорбции,
характеризующая энергию взаимодейств я а сорбата адсорбента.
Адсорбции на пористых ателах. При а сорбции на пористых
применяют те же уравнения, что и для описания адсорбции на гладкой поверхностии.
При адсорбц на кап ллярно-пористых телах (2−100 нм) при
высоких давленияхСв порах протекает капиллярная конденсация, которую можно описать при помощи уравнения Томсона − Кельвина. Из этого уравнения можно определить размеры пор в адсорбенте. Для описания адсорбции на микропористых (0,5−2,0 нм) телах применяют теорию объемного заполнения микропор. Стенки пор в таких телах расположены так близко, что поля поверхностных сил соседних стенок перекрываются и адсорбция происходит во всем объеме пор. Для описания процесса адсорбции в этом случае используют теорию объемного заполнения микропор, основное уравнение которой имеет вид
p = pS e |
− |
2σVM |
, |
|
|
rRT |
(21) |
где p – давление конденсации паров в капиллярных порах; рS – давление насыщенного пара над плоской поверхностью; σ –
40
