
625
.pdfдробление, молекулы конденсируются в коллоиды. Метод применяют для получения коллоидных растворов металлов (Au, Ag, Pt).
3. Ультразвуковое дробление осуществляется ультразвуком (колебания воздуха с большой частотой от 105 до 106 Гц) с помощью пьезоэлектрических осцилляторов. Метод применяют для получения коллоидных растворов смол, гипса, графита, красителей, крахмала.
Пептизацией называется процесс получения золей из студней или рыхлых осадков при действии на них веществ, способных адсорбироваться на поверхности коллоидных частиц и таким образом сообщать им способность перехода в золь. При пептизации происходит не изменение степени дисперсности частиц, образующих студень или осадок, а только их разъединение. Пептизаторы способствуют образованию двойного слоя ионов на поверхности частиц осадка, придавая золю агрегативную устойчивость.
Различают пептизацию непосредственную посредственную, в
зависимости от того, что адсорбируется на поверхности частиц перед их разделением: прибавленное вещество (стаб л затор) или продукт
его взаимодействия с веществом частиц. |
и |
|
|
Примером посредственной пептизации может служить |
|
получение золя Fе(ОН)3. Адсорбирующиеся на поверхности частиц |
|
д |
|
ионы образуются в результате химической реакции взаимодействия |
|
разбавленной соляной кислоты на студенистый осадок Fe(OH)3, |
||
предшествующей пепт зац . |
а |
|
При этом часть расположенных на |
||
поверхности молекул Fе(ОН)3 |
взаимодействует с НС1 и образует |
|
|
б |
|
молекулы FeOCI, которые пепт зируют осадок. |
||
Цель работы – получить дисперсные системы разного типа |
||
и |
|
|
методами конденсации и диспергирования. |
||
Выполнение лабораторной работы |
||
С |
|
|
Опыт № 1. Получение лиофобных коллоидных растворов серы и канифоли
Для получения коллоидных растворов очень часто применяется метод замены растворителя. Сера и канифоль растворяются в этиловом спирте, образуя истинный раствор. В воде они практически нерастворимы, поэтому при добавлении воды к их спиртовому раствору молекулы серы и канифоли конденсируются в крупные агрегаты.
11
1.1.Насыщенный раствор серы в абсолютном спирте влить по каплям в 100 см3 воды при взбалтывании.
1.2.Спиртовый раствор канифоли (5 – 10 см3) добавить по каплям при энергичном взбалтывании к 100 см3 воды.
Описать полученные золи. К какой группе способов получения
коллоидных систем относится метод, используемый в данном опыте?
Опыт № 2. Получение золя Fe(OH)3
2.1. Налить в колбу 100 см3 воды и нагреть до кипения. В кипящую воду по каплям добавить 5−10 см3 2%-ного раствора хлорида железа (III). Получается коллоидный раствор гидроксида железа (III) (для получения интенсивной окраски можно увеличить объём раствора FeCI3).
2.2. Описать полученный золь. Зап сать уравнение реакции гидролиза соли FeCI3. Составить формулу м целлы гидроксида
железа (III) и расписать составные |
части ее структуры. К какой |
||
|
|
|
и |
группе способов получения коллои ных систем относится метод, |
|||
используемый в данном опыте? |
|
д |
|
|
|
||
Полученный раствор сохр нить для л бораторной работы № 2. |
|||
|
а |
|
|
б |
|
|
|
3.1. В стакан на 100 см3 налить 5 см3 0,005 М раствора хлорида |
|||
железа (III) и добавитьик нему 5 |
см3 0,005 М раствора желтой |
||
кровяной солиСК4[Fe(CN)6]. Разбавить полученный раствор, добавив 50 см3 воды.
Описать полученный раствор. Записать химическую реакцию его получения.
3.2. Взять 0,1 М раствора хлорида железа (III) и желтой кровяной соли и выполнить то же, что и в предыдущем эксперименте. Из непрозрачного раствора выпадает осадок. Описать его.
3.3. В стакан налить 5 см3 насыщенного раствора хлорида железа (III) и 10 см3 насыщенного раствора желтой кровяной соли. Какой образуется осадок?
3.4. Часть полученного осадка перенести в стакан со 100 см3 дистиллированной воды и размешать, чтобы получить устойчивый золь берлинской лазури Fe4[Fe(CN)6]3 (сохранить полученный золь
12
для опыта № 5). Сделать вывод о влиянии концентрации исходных растворов на получение коллоидных систем.
Опыт № 4. Получение лиофильных коллоидных растворов ВМС
4.1. Взвесить 0,5 г крахмала. Тщательно растереть его в фарфоровой ступке и перенести в фарфоровую чашку. Добавить к нему 10 см3 воды и перемешать. Затем добавить еще 90 см3 воды. Полученную смесь крахмала в воде при постоянном помешивании довести до кипения. После нескольких закипаний получается 0,5%-ный раствор крахмала. Описать его.
4.2. Взвесить 0,5 г желатина. Внести его в химический стакан, залить 50 см3 воды и оставить на 6−8 ч для набухания. После набухания желатина добавить в стакан еще 50 см3 воды и нагреть смесь на водяной бане при температуре 40−50 °С до полного растворения желатина. Получается раствор желат на. Описать его.
4.3. В мерную колбу на 1 00 см3 |
внести 10 г предварительно |
растертого в ступке яичного альбуминаи(порошка) или белок |
|
куриного яйца. Залить белок 40−50 см3 |
холо ной воды и взболтать |
смесь до полного растворения. З тем добавить еще 50 см3 воды. |
||||
|
|
д |
||
Получается раствор белка. Опис ть его. |
|
|
||
Полученные растворы оставить для проведения опыта № 5. |
||||
|
а |
|
|
|
б |
|
|
|
|
и |
|
|
3 |
полученных в опыте № 4 |
5.1. В три пробирки налить по 5 см |
|
|||
растворов гидрофильныхС золей крахмала, желатина, альбумина и нагреть их до кипения. Отметить, какой из испытуемых золей является устойчивым к нагреванию, а какой нет.
5.2. В одну коническую колбу на 25 см3 налить 5 см3 золя берлинской лазури, полученного в опыте № 3, в три другие – по 5 см3 золей: крахмала, желатина, яичного альбумина. В каждую из четырех колб по каплям из бюретки добавить насыщенный раствор сульфата аммония до помутнения коллоидного раствора. Отметить количество электролита, необходимое для коагуляции каждого из коллоидных растворов. Полученные результаты записать в табл. 3.
13
|
Устойчивость золей к действию электролита |
Таблица 3 |
|||
|
|
||||
|
|
|
|
|
|
Золь |
|
V (NH4)2SO4 ,мл |
Золь |
|
V (NH4)2SO4 ,мл |
|
|
|
|
|
|
Берлинская лазурь |
|
Яичный альбумин |
|
|
|
|
|
|
|
|
|
Крахмал |
|
|
Желатин |
|
|
Сделать вывод об устойчивости исследуемых растворов к действию электролита.
Опыт № 6. Получение эмульсии подсолнечного масла в воде
6.1.В колбу налить 50 сма3 во ды и 5и– 10 см3 подсолнечного масла, закрыть пробкой и взболтбть. Д ть постоять.
Образуется ли эмульсия? Опис ть, что происходит при отстаивании эмульсиии.
6.2.Навеску буры массой 4 − 5 г растворить при нагревании в 95 см3 дистиллированной воды. В полученный раствор добавить подсолнечногоСмасла 2 − 3 см3 и сильно взболтать. Получается устойчивая эмульсия.
Какими условиями определяется устойчивость эмульсий? Какие типы дисперсных систем по классификации, основанной
на агрегатном состоянии дисперсной фазы и дисперсионной среды, получены в данной работе?
Какие типы дисперсных систем по классификации, основанной
на взаимодействии между дисперсной фазой и дисперсионной средой, получены в данной работе? бываетЭмульсии – это дисперсные системы, образованные двумя
14
Лабораторная работа № 2 ОПРЕДЕЛЕНИЕ ЗАРЯДА КОЛЛОИДНЫХ ЧАСТИЦ ЗОЛЯ
План коллоквиума
1.Двойной электрический слой (ДЭС), механизмы его образования.
2.Теория строения ДЭС Штерна.
3.Электрокинетический потенциал.
4.Электрокинетические явления. Уравнение Гельмгольца − Смолуховского.
Теоретические основы выполнения работ
-или в результате избирательнойада сорбциии(концентрирования на поверхности) одного из ионов электролита;
-или за счет ионизациибповерхностных молекул вещества. Примером образования ДЭС в результате избирательнойдостраивать кристаллическую решётку серебра, придаютиодида
частицам AgI отр цательный заряд, а ионы калия находятся в растворе вблизи межфазной поверхности.
С
{m[AgI] nI-(n-x) K+}x-xK+.
ДЭС
Пример возникновения ДЭС за счет ионизации поверхностных молекул вещества − образование ДЭС на кристалликах водного золя диоксида кремния SiO2. Молекулы SiO2 гидратируются и образуют кремниевую кислоту. ДЭС может образовываться за счет частичной диссоциации молекул кислоты:
H2SiO3 = HSiO3¯ + H+.
При этом гидросиликатные ионы HSiO3¯ остаются на поверхности частицы, обусловливая её отрицательный заряд, а ионы водорода находятся в растворе.
15

{m[aH2O·bSiO2] nHSiO3¯ (n – x)H+}¯X xH+.
ДЭС
Теория строения ДЭС Штерна. Существует несколько теорий, описывающих строение двойного электрического слоя, наиболее совершенной из которых является теория Штерна (1924 г.).
Штерн объединил схему строения ДЭС Гельмгольца − Перрена и Гуи − Чэпмена. Учёл размеры ионов и взаимодействие ионов с поверхностью твердой фазы, которое обусловлено наличием на малом расстоянии от поверхности (порядка нескольких ангстрем) поля молекулярных (адсорбционных) сил.
ДЭС состоит из двух частей: заряженной межфазной поверхности и противоположно заряженного слоя противоионов. Часть противоионов при этом находится в непосредственной близости от межфазной поверхности, образуя плотный адсорбц онный слой (слой Гельмгольца), а остальные противо оны под воздействием диффузии распределены в глубь исперс онной среды, образуя
слоя δ зависит от многих ф кторов (концентрации электролита,
диффузный слой (слой Гуи). Толщина а сорбционного слоя d не |
|
|
и |
превышает диаметра составляющих его ионов. Толщина диффузного |
|
д |
|
а |
|
температуры, заряда ионов и т.п.). Т ким образом, можно выделить
две тенденции: адсорбцию противоионов и диффузию противоионов. |
|||||
|
и |
|
|
||
Падение потенц ала φо складывается из |
φδ – падения потенциала в |
||||
диффузнном слое |
|
разности |
потенциалов между обкладками |
||
С |
б |
|
|||
конденсатора φо – φδ . |
|
|
|||
|
|
|
|
А |
|
|
|
φ0 - φδ |
|
|
|
|
φ0 |
|
|
|
|
|
|
φδ |
|
|
ξ |
|
|
|
|
В |
|
|
|
|
d |
δ |
|
Рис. 1. Схема ДЭС по Штерну и падение в нём потенциала
При большой концентрации электролита диффузный слой может уплотняться, пока толщина ДЭС не станет равна толщине
16
адсорбционного слоя. Состояние системы, в которой происходит нейтрализация поверхностного заряда, называется изоэлектрическим. При этом нарушается устойчивость коллоидной системы.
Влияние различных ионов на ДЭС определяется их адсорбционным потенциалом, растущим с увеличением заряда иона. Влияние ионов с одинаковым зарядом определяется радиусом иона. Последовательность ионов с одинаковым зарядом, расположенных в порядке увеличения адсорбционного потенциала, называется
лиотропным рядом.
Электрокинетический потенциал. При взаимном перемещении дисперсной фазы и дисперсионной среды происходит разрыв ДЭС в диффузной части (по плоскости скольжения перпендикулярной линии
АВ, рис. 1). Возникающий при этом на плоскости скольжения
скольжения, и величина ξ-потенциалаизав сят от скорости перемещения фаз, их природы, вязкости сре ы и некоторых других факторов.
потенциал получил название электрокинетического потенциала или
ξ-потенциала (дзета-потенциала) (см. р с. 1). Расстояние от
Электрокинетические явления. дН личие ДЭС обуславливает электрокинетические явления в дисперсных системах. Если
межфазной поверхности, на котором наход тся плоскость
дисперсную систему поместить в электрическое поле, начнется |
||||
|
|
|
а |
|
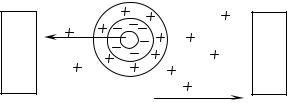
взаимное перемещен е фаз (р с. 2). |
|
|||
Анод |
|
б |
Катод |
|
и |
|
|||
+ |
|
_ |
||
|
|
|
||
С |
|
|
|
|
Рис. 2. Схема движения коллоидных частиц в электрическом поле
Электрокинетические свойства обусловлены наличием заряда у частиц дисперсной фазы и противоположного заряда у дисперсионной среды. К электрокинетическим явлениям относятся электрофорез и электроосмос.
Электрофорез − перемещение дисперсной фазы относительно дисперсионной среды в свободнодисперсных системах под воздействием электрического поля.
17

Электроосмос − перемещение под действием электрического поля дисперсионной среды относительно неподвижной дисперсной фазы в связнодисперсных системах.
Уравнение Гельмгольца – Смолуховского позволяет рассчитать значение ξ-потенциала, возникающего при электрофорезе и электроосмосе:
ξ = ηuo , εεo E
где η − вязкость среды; uо − линейная диэлектрическая проницаемость среды; εo
(2)
скорость движения; ε − − электрическая константа
(постоянная, зависящая от формы частиц); Е − напряжение
электрического поля. Величина uо /Е называется электрофоретической |
||||||||||||
подвижностью. |
|
|
|
|
|
|
|
|
|
|
|
|
Метод |
электрофореза широко |
|
пр меняют на |
практике для |
||||||||
нанесения покрытий, для очистки |
д |
друг х |
веществ |
от |
||||||||
|
воды |
|||||||||||
примесей, |
для |
формирования |
из ел й |
з |
тонк х |
взвесей |
с |
|||||
|
|
|
|
а |
|
|
|
|
|
|||
последующим |
их |
спеканием, |
ля |
разиеления, |
выделения |
и |
||||||
исследования биоколлоидов |
|
(особенно белков). |
Электрофорез |
|||||||||
|
|
|
б |
|
|
|
|
|
|
|
||
применяют в медицине как метод лечения. |
|
|
|
|
|
|||||||
Электроосмос обычно является более энергоемким процессом, |
||||||||||||
его используют |
и |
|
воды |
из |
различных |
сред (грунтов, |
||||||
для |
удаления |
|
||||||||||
строительных матер алов), пропитки материалов, очистки веществ от примесей. Возникновен е электрических полей при течении грунтовых водС– од н з «с гналов» в геологической разведке полезных ископаемых и водных источников.
Цель работы – определить знаки зарядов исследуемых золей, исследовать влияние условий получения золя на знак его заряда.
Выполнение лабораторной работы
Опыт № 1. Определение знака заряда окрашенного золя методом капиллярного поднятия
Знак заряда золя определяется по капиллярному поднятию его частиц на поверхности адсорбента − фильтровальной бумаги. Если частицы золя имеют тот же заряд, что и поверхность адсорбента, адсорбция затруднена. Наоборот, разноимённые заряды способствуют адсорбции. Если в воде находятся частицы, одноимённо заряженные с
18
бумагой, то они поднимутся вместе с водой и высоко окрасят подвешенные полоски бумаги или дадут широкое пятно на листе. Если в воде находятся частицы противоположного знака, они будут адсорбироваться и почти не переместятся от исходной точки, в отличие от воды, уходящей значительно дальше.
1.1. Налить в стаканы окрашенные золи гидроксида железа, берлинской лазури и 1%-ные растворы красителей (фуксина, метиленового синего, эозина, флюоресцеина и конго красного). Опустить в растворы узкие одинаковые полоски фильтровальной бумаги, приклеенные к планке, закрепленной в штативе так, чтобы они только касались поверхности жидкости. Через 30 мин измерить высоту поднятия окрашенной зоны.
1.2. Написать формулы мицелл золей гидроксида железа и |
||||
|
|
|
|
и |
берлинской лазури, в формулах выделить ДЭС, определить знак |
||||
заряда мицелл и сравнить его с результатами опыта. |
||||
|
|
|
д |
|
Сделать вывод о знаке заряда колло дных частиц всех |
||||
исследованных золей. |
|
а |
|
|
Опыт № 2. |
|
|
||
Влияние з ря а а сорбента |
||||
б |
|
|
||
на адсорбцию коллоидных частиц |
||||
и |
|
|
|
|
2.1. На фильтровальную умагу (адсорбент) стеклянной палочкой нанести ф кс рованное количество капель золя гидроксида железа, золя берл нской лазури и растворов красителей. Обратить внимание на размерСокраску получающихся при этом пятен.
2.2. Повторить опыт на фильтровальной бумаге, обработанной гидроксидом алюминия, для сообщения ей противоположного заряда.
2.3. Сделать вывод о влиянии заряда фильтровальной бумаги (адсорбента) на адсорбцию коллоидных частиц исследованных золей.
Опыт № 3. Изучение зависимости заряда коллоидных частиц от условий получения
В двух пробирках приготовить коллоидные растворы берлинской лазури с разным зарядом частиц. Для этого в первую пробирку налить 1 см3 раствора хлорида железа (III) и 3 см3 раствора К4[Fе(CN)6], во вторую – 3 см3 раствора хлорида железа (III) и 1 см3
раствора K4 [Fe(CN)6].
19
Определить заряды получившихся золей с помощью фильтровальной бумаги. Написать формулы мицелл полученных золей, в формулах выделить ДЭС, определить знак заряда мицелл и сравнить его с результатами опыта.
Объяснить причину различия в знаках зарядов коллоидных частиц полученных золей. Сделать вывод о зависимости знака заряда коллоидных частиц от условий получения золей.
Лабораторная работа № 3
ИЗУЧЕНИЕ КОАГУЛЯЦИИ КОЛОИДНЫХ РАСТВОРОВ
1.Агрегативная и кинетическая устойчивостии коллоидных систем, факторы устойчивости.
2.Коагуляция коллоидных системд, характер стика процесса,4. Правило Шульца – Гардиа.План коллоквиума
5. |
б |
Лиотропные ряды. |
|
6. |
и |
Явление вза мной коагуляции золей. |
|
7. |
Способы защ ты колло дных растворов от коагуляции. |
|
С |
|
Теоретические основы выполнения работы |
Устойчивость дисперсных систем разделяют на два вида: - устойчивость к осаждению дисперсной фазы; - устойчивость к агрегации ее частиц.
Под кинетической (или седиментационной) устойчивостью
понимают свойства частиц дисперсной фазы удерживаться во взвешенном состоянии, не осаждаясь (не седиментируясь).
Агрегативная устойчивость колодных систем − это способность частиц дисперсной фазы оказывать сопротивление их слипанию, не укрупняясь, и тем самым удерживать определенную степень дисперсности этой фазы в целом.
20
