
447
.pdf
dS |
Q |
|
T . |
(4.5) |
Здесь dS = const, а изменяется только правая часть уравнения, т.е. значение величины теплоты. Единицы измерения энтропии: [S] = Дж/моль·К.
Объединенное уравнение первого и второго закона термодинамики:
|
|
|
|
|
(4.6) |
|
||
TdS dU pdV A. |
|
|||||||
Расчет изменения энтропии идеального газа. |
|
|
|
|
||||
Выразим изменение внутренней энергии |
|
dU CvdT. |
|
|
|
|
||
Разделив уравнение (4.6) на Т , определим изменение энтропии: |
||||||||
dS |
CvdT |
|
p |
dV. |
(4.7) |
|
||
|
T |
|
||||||
|
T |
|
|
|||||
Из уравнения идеального газа: pV RT |
следует, что |
p |
|
R |
. |
|||
|
|
|||||||
|
|
|
|
|
T V |
|||
Тогда, после подстановки этого соотношения в (4.7):
|
|
|
|
dS |
CvdT |
|
|
R |
dV |
. |
|
|
(4.8) |
||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
V |
|
|
|
|
Проинтегрируем |
выражение (4.8) |
при Cv |
const и |
получим |
|||||||||||||||
уравнение для расчета изменения энтропии идеального газа: |
|
||||||||||||||||||
|
|
|
|
ΔS Cv |
ln |
T2 |
Rln |
V2 |
. |
(4.9) |
|||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
T1 |
V1 |
|
||||||||
Изотермический процесс, T const: |
V2 |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
ΔS Rln |
|
, |
|
|
|
|
|
|
(4.10) |
||||||
|
|
|
|
|
V |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|||
так как |
V2 |
|
p1 |
, то |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
p2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
ΔS Rln |
p1 |
. |
|
|
|
(4.11) |
|||||||||
|
|
|
|
|
|
|
|||||||||||||
Изохорический процесс, V const: |
p2 |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
T2 |
|
|
|
||||||||||
|
|
|
|
ΔS Cv Rln |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
. |
|
|
(4.12) |
|||||||||
|
|
|
|
|
|
T |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|||
21

Изобарический процесс, p const:
ΔS Cp Rln |
T2 |
|
|
|
. |
(4.13) |
|
T |
|||
Адиабатический процесс, Q 0: |
1 |
|
|
|
|
|
|
ΔS 0. |
|
|
(4.14) |
Постулат Планка имеет следующую формулировку: при абсолютном нуле энтропия правильно образованных кристаллов чистых веществ равна нулю. Постулат позволяет рассчитать абсолютное значение энтропии, если известны теплоты фазовых переходов, и если известны теплоёмкости вещества в различных агрегатных состояниях.
Рассмотрим вычисление изменения энтропии в различных процессах.
1. Изменение энтропии S при фазовых переходах (T = const)
определяется по формуле
S n H |
(4.15) |
T , |
где ∆H - теплота фазового перехода (кипение, испарение, возгонка, плавление); n – число моль вещества, переходящего из одной фазы в другую; n = g/M, где g – масса вещества, M – его молярная масса.
2. Изменение энтропии ∆S при нагревании. а) Пусть p = const, тогда Q CpdT ,
dS |
CpdT |
|
|
|
|||
T . |
(4.16) |
||||||
|
|||||||
Если Cр = const, тогда |
|
T2 |
|
|
|||
∆S = Cр |
ln |
, |
(4.17) |
||||
T |
|||||||
|
|
|
|
|
|||
|
|
1 |
|
|
|||
где Т1 и Т2 – температуры начала и окончания нагревания
вещества. |
|
|
||
Пусть Cр выражается в Дж/моль· К, тогда |
|
|||
∆S = n Cр ln |
T2 |
, |
(4.18) |
|
T |
||||
|
|
|
||
1 |
|
|
||
Пусть Cp выражается в Дж/г ·К, тогда
22

∆S = g Cр lnT2 .
T1
Если Cp зависит от температуры, т.е. Cр = f (T), тогда
dS T2 (a bT cT2 с Т 2) dT . T
T1
б) Пусть V = const, тогда
(4.19)
(4.20)
dS CV ln |
T2 |
|
|
|
. |
(4.21) |
|
T |
|||
|
1 |
|
|
Для расчёта абсолютного значения энтропии S вещество нагревается от абсолютного нуля до данной температуры ( p = const).
Для твёрдого тела при температуре T
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
dT |
|
|
|
|
|
||
|
|
|
|
S тв |
C p (тв ) |
. |
|
(4.22) |
|||||||||||||||
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
273 |
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
Для жидкости при температуре T |
|
|
|
T |
|
|
|
|
|
|
|
|
|||||||||||
|
|
Tпл |
|
|
|
dT |
|
H |
|
|
|
|
|
|
dT |
|
|
||||||
Sж Cp (тв) |
|
|
пл |
Cp (ж) |
|
|
|||||||||||||||||
|
|
|
|
|
|
. |
(4.23) |
||||||||||||||||
|
T |
|
T |
|
|
T |
|||||||||||||||||
|
|
273 |
|
|
|
|
|
|
пл |
T |
|
|
|
|
|
|
|
|
|||||
Для |
газа |
|
|
при |
|
|
|
пл |
температуре |
|
T |
||||||||||||
|
|
|
|
|
|
|
|
||||||||||||||||
Tпл |
dT |
|
|
H |
Tкип |
|
|
dT |
|
H |
|
|
T |
dT |
|||||||||
Sг Cp(тв) |
|
|
|
пл |
|
|
Cp(ж) |
|
|
|
|
исп |
Cp(г) |
|
(4.24) |
||||||||
T |
|
T |
|
|
T |
|
T |
T |
|||||||||||||||
273 |
|
|
|
пл |
|
Tпл |
|
|
|
|
|
|
|
кип |
|
Tкип |
|
|
|||||
Задача.
Найти изменение энтропии g кг воды (тв.) Н2О при нагревании (охлаждении) в интервале температур от Т1 до Т2, если известны температуры плавления и кипения, средние теплоемкости, теплоты плавления и испарения.
Таблица 3
Термодинамические величины веществ
g, |
Т1, |
Т2, |
Плавление |
|
|
|
Испарение |
|
|
Удельная теплоемкость, |
|
|||||||||||||||
кг |
К |
К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Дж/кг·К |
|
|
|
||
|
|
|
Т , |
|
Нпл |
|
10 |
3 |
, |
Т |
исп.. |
|
Нпл |
|
|
3 |
С |
тв |
10 |
3 |
ж |
10 |
3 |
г |
10 |
3 |
|
|
|
пл |
|
|
|
|
|
|
10, |
р |
|
Ср |
|
Ср |
|
||||||||||
|
|
|
К |
Дж/моль |
|
(Ткип.), |
Дж/моль |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2, |
25 |
37 |
273, |
6,138 |
|
|
|
373,2 |
45,069 |
|
0,570 |
|
4,187 |
|
1,919 |
|
||||||||||
7 |
3 |
9 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
23
Решение.
1) Представим процесс нагревания вещества от Т1 и Т2 по стадиям:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
от Т1 от Тпл |
|
|
|
|
|
||||
1 стадия. Твердое вещество (при Т1) |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
Tпл Ствр |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нагревание |
|
|
|
|
|
|||||||
|
|
|
dT |
|
g Ств |
|
|
|
|
|
|
|
|
|
|
|
|
T |
2,7 0,570 103 |
|
|
273,2 |
|
|||||||||||||||||||||||
S g |
|
|
|
|
|
|
|
|
|
2,303 lg |
|
пл |
2,303 |
lg |
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
1 |
Т1 |
|
T |
|
|
|
|
|
|
|
|
|
|
|
р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Т1 |
|
|
|
|
|
|
|
253 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
118,39( Дж К 1 ). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
2 стадия. Твердое вещество (при Т |
|
) |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пл. |
плавление |
|
|
|
|
|
|||||||
|
|
|
|
S2 |
g |
|
Нпл. |
|
|
|
|
2,7 |
|
|
|
|
6,138 |
|
3370(Дж К 1). |
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
Тпл. |
18 10 3 |
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
м |
|
|
|
273,2 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
от Тпл от Ткип |
|
|
|
|
|
|||||||||||||
3 стадия. Жидкость (при Тпл.) |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
TкипСрж dT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нагревание |
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
g Сжр |
|
|
|
|
|
|
|
|
|
|
|
|
T |
Т |
исп. |
|
|
|
|
|
|
|
|||||||||||||||||||||||
S3 g |
|
|
|
|
|
|
|
|
2,303 lg |
|
кип. |
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
|
Тпл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Тпл. |
|
|
|
|
|
|
|
|
|
||||||
2,7 4,187 103 |
2,303 lg |
273,2 |
3526,8( Дж К 1 ). |
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
273,2 |
|
|
|
|
испарение |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
4 стадия. Жидкость (при Ткип.) |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кипение |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
g |
|
|
|
Н |
исп. |
|
|
|
2,7 |
|
|
|
|
45,069 103 |
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
S |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18114,5(Дж К 1) |
|
|
|
|||||||||||||||
|
|
|
|
м |
|
|
|
|
|
|
|
|
|
|
|
|
|
273,2 |
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
Тисп. |
18 10 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
5 стадия. Пар (при Ткип.) |
|
|
|
отТкrип |
от Т2 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||
Пар (при Т2) |
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
нагревание |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
T2 С |
рг dT |
g Срг |
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
379 |
|
|
|
|
|||||||||||||||||
S5 g |
|
|
|
|
|
|
2,303 lg |
|
|
2 |
2,7 1,919 103 2,303 lg |
|
|
79,9(Дж К 1) |
||||||||||||||||||||||||||||||||
|
|
T |
|
|
Т |
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кип. |
|
|
|
|
|
|
|
|
|
|
373,2 |
|
|
|
|
||||||||||
|
Ткип. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Находим изменение энтропии при нагревании вещества от Т1 до Т2. |
|
|||||||||||||||||||||||||||||||||||||||||||||
S S1 S2 S3 S4 S5 |
25209,59 25,2(кДж/К). |
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
Изменение стандартной энтропии системы S 298 при протекании химической реакции определяется как разность суммы стандартных энтропий продуктов и суммы стандартных энтропий исходных веществ.
24

Sо298 S 298(продуктов.реакции) S 298(исходных.веществ) (4.25)
Значения величин стандартных энтропий (определенных для стандартных условий) веществ приведены в справочниках.
Энтропия, как критерий возможности протекания процесса в
изолированной системе (U,V = const). Изолированная система не обменивается с окружающей средой теплотой, т.е. Q 0. Поэтому,
согласно второго закона термодинамики |
|
(dS)U,V ≥ 0. |
(4.26) |
Необратимый процесс в изолированной системе возможен при |
|
(dS)U,V > 0. |
(4.27) |
При равновесном состоянии системы (или обратимом процессе) |
|
(dS)U,V = 0; |
(4.28) |
при этом энтропия принимает максимальное значение S = Smax. |
|
Если (dS)U,V < 0 |
(4.29) |
– необратимый процесс в изолированной системе неосуществим.
Л е к ц и я 5
ТЕРМОДИНАМИКА АГРЕГАТНЫХ ПРЕВРАЩЕНИЙ
План лекции: Уравнение Клайперона – Клаузиуса. Применение уравнения Клайперона – Клаузиуса к процессам испарения и возгонки. Зависимость давления насыщенного пара от температуры.
Фазовые переходы чистого вещества в двухфазной однокомпонентной системе представим следующим образом.
|
Фазовый переход: |
Процесс: |
|
При фазовом переходе: |
|
|
α→β |
|
|
значительно изменяется |
|
|
Жидкость |
Пар |
Испарение |
|
|
|
|
|
|
|
объем; |
|
Твердое |
Пар |
Возгонка |
|
объем практически не |
|
Твердое |
Жидкость |
Плавление |
|
|
|
|
|
|
|
изменяется; |
|
Твердое |
Твердое |
Полиморфное |
(конденсированное |
|
|
|
|
превращение |
состояние). |
|
При равновесии dG 0 или dG |
dG . |
||||
25
При этом
dG V dp S dT, |
(5.1) |
|
dG |
V dp S dT, |
(5.2) |
где V иV - это мольные объемы вещества в фазах α и β,
S иS - это энтропии вещества в фазах α и β.
Так как dG dG , получаем |
|
V |
dp S dT V |
dp S |
dT. |
|||||||||||||||||
Объединяем объемы и энтропии: |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
(S |
S )dT (V V )dp. |
|
(5.3) |
||||||||||||||
Отсюда |
|
|
|
dp |
|
|
|
S |
S |
|
, |
|
|
(5.4) |
||||||||
|
|
|
dT |
V |
|
V |
|
|
|
|||||||||||||
где S иS |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
S - это изменение энтропии при фазовом переходе; |
||||||||||||||||||||||
V и V |
V - это изменение объема при фазовом переходе. |
|
||||||||||||||||||||
Так как |
S |
H |
, получаем |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
T |
|
dp H |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
, |
|
|
(5.5) |
|||||||||
|
dp |
|
|
|
|
|
|
dT |
|
|
T V |
|
|
|||||||||
где |
- изменение давления насыщенного пара с температурой. |
|||||||||||||||||||||
dT |
|
|||||||||||||||||||||
Уравнение (5.5) - это уравнение Клаузиуса-Клайперона, |
|
|
||||||||||||||||||||
Применение уравнения Клаузиуса-Клайперона к процессам |
||||||||||||||||||||||
испарения и возгонки. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
переходит |
|
|
|
|
|
|
|
|
|
|
переходит |
|
|||||
|
«Жидкость пар» или |
«твердое пар». |
||||||||||||||||||||
|
|
|
V Vпар Vж |
|
|
|
|
или |
V Vпар Vтв . |
|||||||||||||
|
|
|
|
Vпар Vж |
|
|
|
|
|
|
или |
Vпар Vтв . |
||||||||||
Объемом конденсированного состояния (жидкости, твердого) можно пренебречь по сравнению с объемом пара и считать: Vпар Vж .
Предложим, что пар подчиняется законам идеального газа, тогда
V |
|
RT |
. |
Подставляем |
это |
выражение |
в уравнение (5.5): |
|||||
|
|
|||||||||||
|
|
|
p |
|
|
|
|
|
|
|
|
|
dp |
|
H |
, получаем: |
p |
|
H p |
. |
Так как |
dp |
d ln p , |
||
|
|
|
|
|
|
|||||||
dT T V |
|
T |
T R T |
|
p |
|||||||
получаем
26
dln p |
|
H |
. |
(5.6) |
|
2 |
|||
dT |
RT |
|
||
Это уравнение Клаузиуса-Клайперона для процессов испарения и выгонки. Физический смысл уравнения: с ростом температуры давление насыщенного пара в системе растет.
При Н const можно из уравнения Клаузиуса-Клайперона найти значение величины теплового эффекта и равновесного давления насыщенного пара. Преобразуем уравнение (5.6), получаем
d ln p |
H |
|
dT |
. |
(5.7) |
R |
2 |
||||
|
|
T |
|
||
Берем неопределенный интеграл выражения (5.7), после интегрирования:
ln p |
H |
|
1 |
const. |
(5.8) |
|
T |
||||
|
R |
|
|
||
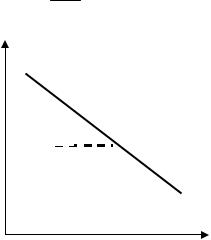
Уравнение (5.8) отвечает уравнению прямой линии. Построим графическую зависимость ln p f (1/T), рис. 2. Из графика находим
H
тангенс угла наклона α: tg R , тогда H Rtg .
lnp
α
1/Т
Рис. 2. Графическая зависимость
ln p f (1/T)
Возьмем определенный интеграл выражения (5.7), получаем:
|
p2 |
|
H |
|
1 |
|
1 |
|
|
|
|
|
|
|
|||||
ln |
p |
|
R |
|
T |
(5.9) |
|||
T |
. |
||||||||
|
1 |
|
|
|
2 |
1 |
|
|
|
27
Л е к ц и я 6
ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ
План лекции: Термодинамический потенциал. Изохорноизотермический потенциал или свободная энергия Гельмгольца. Применение энергии Гельмгольца в качестве критерия направления самопроизвольного процесса и равновесия в закрытых системах. Изобарно-изотермический потенциал или свободная энергия Гиббса. Применение энергии Гиббса в качестве критерия направления самопроизвольного процесса и равновесия в закрытых системах. Характеристические функции: внутренняя энергия, энтальпия, свободная энергия Гельмгольца, свободная энергия Гиббса. Уравнения Гиббса-Гельмгольца. Химический потенциал.
Термодинамический потенциал – это функция состояния системы,
убыль которой в процессе, протекающем при постоянстве двух параметров, равна максимальной полезной работе.
Энергия Гельмгольца как изохорно-изотермический потенциал.
Для изохорно-изотермических условий V = const, T = const. Вспомним, что объединенное уравнение, выражающее первый и второй законы термодинамики, имеет следующий вид:
TdS dU pdV A .
Так как при V = const, pdV = 0, получим
|
|
|
|
(6.1) |
|
|
|
A |
dU TdS . |
|
|
Проинтегрируем данное уравнение: |
|
|
|||
A (U2 U1) T(S2 S1), |
A (U2 TS2 ) (U1 TS1) . |
||||
Введем обозначение F – это энергия Гельмгольца. |
|
||||
|
|
F = U - TS |
|
(6.2) |
|
Тогда F2 = U2 - TS2 и F1 = U1 - TS1. |
|
||||
A |
|
F2 F1 , |
|
||
|
A (F2 F1) или |
A |
F. |
||
То есть энергия Гельмгольца – это термодинамический потенциал, так как его изменение равно полезной работе при протекании обратимого процесса в системе. Для необратимого процесса: A F. В общем случае для обратимого и необратимого процессов справедливо выражение
|
(6.3) |
A F. |
28
Энергия Гельмгольца равна F U TS , отсюда |
|
U = F+TS. |
(6.4) |
То есть F – это та часть внутренней энергии, которая может быть превращена в работу, поэтому она называется свободной энергией; произведение TS – это энергия, которая выделяется в виде тепла, поэтому она называется связанной энергией.
Энергия Гельмгольца как критерий возможности протекания процесса. Дифференцируя выражение F U TS получим dF = dU
– TdS - SdT . Подставляя вместо произведения TdS его выражение из
«объединенного» уравнения TdS ≥ dU+pdV |
получим |
dF ≤ - SdT - pdV. |
(6.5) |
Так как SdT = 0 и pdV= 0 (при Т = const |
и V= const), тогда для |
изохорно-изотермических условий |
|
(dF)v,T ≤ 0. |
(6.6) |
В закрытых (замкнутых) системах при изохорно-ихотермических условиях:
если dF < 0, то процесс протекает самопроизвольно;
если dF > 0, то процесс не протекает;
если dF = 0, то система находится в состоянии равновесия.
Энергия Гиббса как изобарно-изотермичесий потенциал. Для
изобарно-изотермических условий р = const , T = const. Преобразуем объединенное уравнение первого и второго законов термодинамики:
TdS dU pdV A как A dU pdV TdS. |
(6.7) |
|
Проинтегрируем это выражение: |
|
|
|
V1) T(S2 S1) или |
|
A (U2 U1) p(V2 |
|
|
A (U2 pV2 TS2 ) (U2 pV1 TS1).
Введем обозначение |
|
|
|
|
G U pV TS - это энергия Гиббса. |
(6.8) |
|||
Тогда G2 U2 pV2 |
TS2 , |
G1 U1 pV1 TS1. |
|
|
A G2 G1 , |
A (G2 G1), |
A G. |
|
|
Энергия Гиббса |
равна G U pV TS |
, но U pV H. |
||
Поэтому |
|
|
|
|
G H TS, отсюда |
H G TS . |
(6.10) |
||
Энергия Гиббса G |
– эта часть энтальпии, |
которая может быть |
||
превращена в работу; поэтому она называется свободной энергией. |
||||
В выражение для |
энергии Гиббса G U pV TS |
подставим |
||
энергию Гельмгольца, которая определяется как F= U - TS. Тогда |
||||
получим, что |
|
|
|
|
G F pV или |
dG dF pdV . |
(6.11) |
||
Энергия Гиббса, как критерии возможности протекания процесса.
Продифференцируем выражение G U pV TS , получим dG dU pdV Vdp TdS SdT.
Вместо TdS подставим его значение из объединенного уравнения первого и второго законов термодинамики TdS dU pdV. Тогда dG dU pdV dU pdV SdT Vdp или
dG Vdp SdT. |
(6.12) |
В изобарно-изотермических условиях Vdp 0,SdT 0 и |
|
(dG)p,T 0 . |
(6.13) |
То есть dG является критерием возможности протекания процесса в замкнутой (закрытой) системе в изобарно-изотермических условиях. При этом
если dG < 0, то процесс протекает самопроизвольно;
если dG > 0, то процесс самопроизвольно не протекает;
если dG = 0, то система находится в состоянии равновесия.
Характеристической функцией называется такая функция
состояния системы, посредством которой или ее производных могут быть выражены в явной форме термодинамические свойства системы. Характеристическими функциями являются:
1)внутренняя энергия U ,
2)энтальпия H,
3)изохорно-изотермический потенциал F,
4)изобарно-изотермический потенциал G,
5)энтропия S.
30
