
447
.pdf
|
Н 17,9 0,0509(2,026 1,013) 105 |
10 3 23,1 кДж. |
|
|
|
|
||||||||||||||||||||||||||||||||
г) Для адиабатного сжатия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
Q 0. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
nRT |
|
P2 |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
A - ΔU |
nCv (T2 T1) |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
. |
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
1 |
P |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
Сp |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Коэффициент |
|
|
|
|
|
|
|
37,1 |
1,29. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
Cv |
28,8 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
2,27 8,314 273 |
|
|
|
|
|
|
|
|
1,29 1 |
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
203 1,29 |
2970Дж. |
||||||||||||||||||||||||
|
|
|
|
|
|
A U |
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1,29 1 |
|
101 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Н U (PV) U (P2V2 P1V1). |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
Выражая конечный объем V2 из уравнения адиабаты |
|
|
P1V1 |
|
P2V2 |
, |
|
|||||||||||||||||||||||||||||||
получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,29 1 |
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
203 |
|
|
1,29 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
кДж. |
||
Н U Р1V1 |
|
|
|
1 2,97 1,013 10 |
|
0,0509 |
|
|
|
|
|
|
|
|
|
|
1 |
10 |
|
3,83 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
P1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
101 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Л е к ц и я 3
ТЕРМОХИМИЯ
План лекции: Термохимия. Закон Гесса. Основные следствия закона Гесса и использование их для расчета тепловых эффектов физико-химических процессов. Зависимость теплового эффекта от теплоемкости и температуры. Уравнение Кирхгофа. Развернутое уравнение Кирхгофа.
Термохимия – это раздел термодинамики, который изучает тепловые эффекты процессов. В термохимии под тепловым
эффектом Q понимают теплоту, которая выделяется или поглощается в результате процесса, протекающего при постоянном р или V, причём температура исходных веществ и продуктов реакции одинакова, а полезная работа равна нулю ( A = 0).
Закон Гесса – это основной закон термохимии. Формулировка закона: тепловой эффект процесса не зависит от числа и характера
11
промежуточных стадий, а определяется только начальным и конечным состоянием системы.
Пример. Рассмотрим реакцию протекающую при р = const.
C(графит) + O2(газ) → CO2(газ); тепловой эффект реакции равен
∆H1. |
|
|
Запишем реакцию через промежуточные стадии. |
|
|
C(графит) + 0,5O2(газ) = CO(газ) , |
∆H2 ; |
(3.1) |
CO(газ) + 0,5O2(газ) = CO2(газ) , |
∆H3 ; |
(3.2) |
Просуммируем реакции (3.1) и (3.2): |
|
|
C(графит) + O2(газ) → CO2(газ).
Получаем исходную реакцию; поэтому сумма тепловых эффектов реакций (3.1) и (3.2) равна тепловому эффекту исходной реакции: ∆H2
+ ∆H3 = ∆H1.
Условие применения закона Гесса: закон применим только к тепловым эффектам процесса , т.е. к условиям, когда процесс протекает при р = const или V = const. Закон применим не только к химическим реакциям, но и к любым другим физико-химическим процессам.
Пример: ∆Hвозгонки = ∆Hплав. + ∆Hиспар.
|
|
∆Hвозг. |
|
|
|
Твёрдое |
Пар |
||||
|
|
|
|||
вещество |
|
|
|
|
|
|
|
|
|
|
∆Hплав.
∆Hиспар.
Жидкость
Термодинамическое обоснование закона Гесса заключается в следующем. Установлено, что QV = ∆U, а QP = ∆Н. Так как внутренняя энергия U и энтальпия H являются функциями состояния системы, т. е. не зависят от пути процесса, то QV и QP не будут
12

зависеть от промежуточных стадий, а определяются только начальным и конечным состоянием системы.
Практическое значение закона Гесса заключается в следующем.
Закон позволяет рассчитывать тепловые эффекты процессов не проводя экспериментов; тепловые эффекты неосуществимых процессов и процессов, для которых тепловой эффект нельзя определить опытным путём.
Уравнение химической реакции с указанием теплового эффекта называется термохимическим уравнением. С термохимическими уравнениями можно обращаться так же, как и с алгебраическими уравнениями (складывать, умножать, делить).
Первое следствие из закона Гесса: тепловой эффект обратной реакции равен по величине и противоположен по знаку тепловому эффекту прямой реакции.
aA bB cC Q, cC aA bB Q .
Второе следствие из закона Гесса: тепловой эффект реакции равен сумме теплот (энтальпий) образования продуктов реакций за вычетом (минус) суммы теплот (энтальпий) образования исходных веществ.
H 298 H f ,298(продуктов.реакции) H f ,298(исходных.веществ) ,
(3.3) здесь индекс f от лат. foramentum – образование. Например, для реакции aA + bB→cC + dD,
∆Hº298 = (с∆Hºf,298 (C) + d∆Hºf,298 (D)) – (a∆Hºf,298(A) + b∆Hºf,298(B)).
При суммировании обязательно учитываются стехиометрические коэффициенты уравнения реакции.
Для расчета тепловых эффектов используются стандартные теплоты образования веществ. Стандартной теплотой (энтальпией)
образования вещества ( H или H 298 ) называется изменение энтальпии при образовании одного моль вещества из простых веществ, находящихся при стандартных условиях. Стандартная энтальпия простого вещества равна нулю.
Например, если вещество получено по реакции выраженной термохимическим уравнением
Ca(тв.) + C(графит) + 1,5O2(газ) = CaCO3(тв.) + 1207,7 Дж/моль,
его стандартная теплота образования равна
∆Hºf,298(CaCO3)= - 1207,7 Дж/моль.
13
Третье следствие из закона Гесса: тепловой эффект реакции равен сумме теплот сгорания исходных веществ за вычетом (минус) суммы теплот сгорания продуктов реакции.
H 298 H с,298(исходных.веществ) H с,298(продуктов.реакции), (3.4)
здесь индекс с от лат. combustum - сгорание. Например, для реакции aA + bB→cC + dD,
∆H298 = a∆Hºс,298(A) + b∆Hºс,298(B) - c∆Hºс,298(C) - d∆Hºс,298(D) .
Стандартная теплота сгорания вещества (∆Hºс,298 , ∆Hºсгор. ) –
это убыль энтальпии в реакции сгорания одного моль простого вещества или соединения до соответствующих окисленных форм элементов. В случае сгорания соединений, состоящих из углерода и водорода (например, топливо) до CO2 и H2O. Стандартные теплоты сгорания и образования приведены в справочных таблицах термодинамических величин.
Закон Кирхгофа устанавливает зависимость теплового эффекта реакции от температуры. Формулировка закона: температурный коэффициент теплового эффекта реакции равен изменению теплоемкости в результате процесса.
Уравнение Кирхгофа для изобарного процесса (р = const):
d H |
Cp , |
(3.5) |
|
||
dT |
|
|
где Cp Cp,(продуктов) Cp,(исходныхвеществ) .
В зависимости от знака ∆Cр тепловой эффект реакции (процесса)
сростом температуры может увеличиваться или уменьшаться.
1)Если ∆Cp > 0, то с ростом температуры ∆H увеличивается.
2)Если ∆Cp < 0, то с ростом температуры ∆H уменьшается.
3)Если ∆Cp = 0, то тепловой эффект не зависит от температуры. Проинтегрируем уравнение Кирхгоффа d∆H = ∆CрdT.
1.Пусть теплоемкость Ср не зависит от температуры, т.е.
∆Ср = const,
что допустимо в небольшом интервале температур.
H2 T2
d H Cp dT, H2 H1 Cp (T2 T1).
H1 T1
Отсюда выведем формулу для вычисления теплового эффекта:
∆H2 = ∆H1 + ∆Cр(T2 – T1) . (3.6) 2. Пусть теплоемкость ∆Cр – является функцией от температуры,
т.е.
14
∆Cp = f(T). Эта зависимость выражается уравнениями: |
|
. |
|||||||||
Cp = a + bT + cT² или |
Cp = a + bT + c T |
|
|||||||||
В общем виде изменение теплоемкости равно |
|
|
2 |
|
|||||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
2 |
. |
|
|
(3.7) |
∆Cp = ∆a + ∆bT + ∆cT² + c T |
|
|
|||||||||
Подставим это выражение в уравнение Кирхгофа, тогда |
|
||||||||||
|
|
|
|
|
|
|
|
2 |
)dT. |
|
|
d∆HТ = (∆a + ∆bT + ∆cT² +∆ c T |
|
|
|||||||||
Возьмем неопределённый интеграл и получим выражение |
|||||||||||
HT aT |
b |
T 2 |
|
c |
T3 |
c |
H0 . |
|
|
(3.8) |
|
|
|
|
|
|
|||||||
2 |
|
3 |
|
T |
|
|
|
|
|||
Уравнение (3.8) показывает зависимость теплового эффекта реакции от температуры. В нем ∆H0 – постоянная интегрирования, определяемая как значение теплового эффекта при одной из температур.
Уравнение Кирхгофа для изохорного процесса (V = const):
d U |
CV . |
(3.9) |
|
||
dT |
|
|
Задача.
Выразить зависимость теплового эффекта реакции от температуры, если известен тепловой эффект этой реакции при Т = 298 К и уравнение зависимости Ср f (Т). Данные термодинамических
величин приведены в справочнике. |
|
|
|
|
|
|
||
Реакция : 2СН4 + СО2 = СН3СОСН3(г) + Н2О(г) |
|
протекает при 500 |
||||||
К. |
|
|
|
|
|
|
||
Решение. В основе решения – развернутое уравнение Кирхгофа |
||||||||
(3.7): |
в |
|
с |
|
с |
|
||
HТ0 Н0 aT |
Т 2 |
Т3 |
. |
|||||
|
|
|
||||||
2 |
3 |
|
|
Т |
||||
Для определения a, в, с и с надо знать зависимость Ср f (Т) для каждого из исходных веществ и продуктов реакции:
Ср a вТ сТ2 или Ср a вТ с Т 2 .
Для нахождения постоянной интегрирования надо знать тепловой эффект реакции при температуре 298:
Н2980 |
Н f (продуктов.реакции) Н f (исходных.веществ) . |
Порядок расчета.
1. Данные из справочника заносим в таблицу.
15
|
|
|
|
|
|
|
Таблица 2 |
|
Термохимические величины веществ |
|
|
||||
|
|
|
|
|
|
|
|
|
Н0f ,298 10 6 , |
a 10 3 |
в |
с 10 6 |
|
с 103 |
Температурный |
|
Дж/кмоль |
|
|
|
|
|
интервал |
|
|
Дж/(кмоль·К) |
|
||||
|
|
|
|
||||
|
|
|
|
|
|
|
|
Н2О |
-242,000 |
30,146 |
11,305 |
- |
|
- |
273-2000 |
СН3СОСН3(г) |
-216,796 |
22,489 |
201,926 |
- |
|
-6,576 |
298-1500 |
СО2 |
-393,796 |
44,173 |
9,044 |
-8,541 |
|
- |
298-2500 |
СН4 |
-74,901 |
17,484 |
60,502 |
- |
|
-1,118 |
240-1500 |
2. Находим тепловой эффект реакции при Т = 298 К.
Н2980 Н2980 (Н2О) Н2980 (СН3СОСН3) Н2980 (СО2) 2 Н2980 (СН4)
( 242,000 216,796 393,796 2 74,901) 106 84,752106(Дж/кмоль).
3.Находим Н0 в общем виде.
0 |
|
|
|
в 2 |
|
2 |
|
|
|
с 3 |
|
|
3 |
|
1 |
|
|
|
1 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
. |
HТ |
Н298 |
a(T 298) (Т |
298 |
|
) |
|
|
|
(Т 298 |
|
|
|
|
|
|
||||||||||
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
|
Т |
298 |
|
||||||||
Принимает Т = 0. |
Ho |
Н298 a 298 |
в |
(298)2 |
|
с |
2983 |
|
с |
. |
|
|
|||||||||||||
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
3 |
|
298 |
|
|
|
|
||||||
4. Находим a, в, с и с .
a aпрод. aисх.в в (30,146 22,489 44,173 2 17,484) 103
26,512 103( Дж/ кмоль К )
|
в |
|
1 |
в |
прод. |
в |
исх.в в |
|
1 |
(11,305 201,926 9,044 2 60,502) |
||||||||||||||
2 |
|
|
|
|
||||||||||||||||||||
|
|
2 |
|
|
|
2 |
|
|
|
|
|
|
||||||||||||
41,591( Дж / кмоль К ). |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
с |
|
1 |
с |
прод. |
с |
|
|
1 |
( 63,576 2 1,118) 10 3 |
|
61,340 10 3 |
|
|
||||||||||
3 |
|
|
|
|
|
|||||||||||||||||||
|
|
3 |
|
|
|
исх.в в |
|
3 |
|
|
|
3 |
|
|
||||||||||
20,446 10 3.( Дж/ кмоль К ); |
|
|
|
|
|
|||||||||||||||||||
|
с ( 8,541) 108 8,541 108 (Дж/кмоль К). |
|
|
|
|
|
||||||||||||||||||
5. Вычисляем Н0. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
Н0 |
84752 103 |
26,512 103 298 41,591 2982 20,446 10 3 |
2983 |
8,541 108 |
|
|
|||||||||||||||||
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
298 |
|
|
||
97486,4 103(Дж/кмоль).
16

6. Находим теоретическую зависимость теплового эффекта реакции от температуры
НТ0 |
97486,4 103 26,512 103 Т 41,591 Т2 |
20,446 10 3 Т3 |
|
8,541 |
108 |
. |
T |
|
|||||
|
|
|
|
|
|
7. Определим тепловой эффект при Т = 500 К.
Н5000 97486,4 103 26,512 103 500 41,591 5002 20,446 10 3 5003 8,541 108 500
92179,4 103(Дж/кмоль).
8. Определим насколько при температуре Т отличается Qp отQv .
Qp Qv nRT 8,315 103 500 4157,5 103 (Дж/кмоль),
где n - число кмоль продуктов реакции минус число кмоль исходных веществ в газообразном состоянии; n 2 3 1(кмоль ).
Л е к ц и я 4
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
План лекции: Самопроизвольные (спонтанные) и несамопроизвольные процессы. Второй закон термодинамики, его формулировки. Аналитическое выражение второго закона термодинамики и его обоснование с использованием цикла Карно. Энтропия. Объединенное уравнение первого и второго законов термодинамики. Расчет изменения энтропии в простейших термодинамических процессах - изотермическом, изохорическом, изобарическом и адиабатическом. Постулат Планка. Изменение энтропии при фазовых переходах и при нагревании вещества. Абсолютное значение энтропии. Использование энтропии для определения направления протекания самопроизвольных процессов в изолированных системах.
Самопроизвольные (спонтанные) процессы описываются следующими характеристиками.
1.Все природные самопроизвольные процессы протекают в одном направлении, т. е. имеют одностороннее направление. Например, тепло от горячего тела переходит к холодному; газы стремятся занять наибольший объём.
2.Часть энергии переходит в теплоту, т. е. система из упорядоченного состояния переходит в состояние с беспорядочным тепловым движением частиц.
17
3.Самопроизвольные процессы можно использовать для получения полезной работы. По мере превращения система теряет способность производить работу. В конечном состоянии равновесия она имеет наименьший запас энергии.
4.Систему нельзя вернуть в исходное состояние, не производя каких-либо изменений в ней самой или в окружающей среде. Все самопроизвольные процессы термодинамически необратимы.
5.В самопроизвольном процессе начальное состояние является менее вероятным по сравнению с каждым последующим и наименее вероятным по сравнению с конечным.
Несамопроизвольные процессы протекают при затрате работы;
при этом система удаляется от состояния равновесия (например, сжатие газа, электролиз).
Второй закон термодинамики – это постулат. Он имеет статистический характер и применим к системам из большого числа частиц. Второй закон термодинамики имеет следующие формулировки.
1.Теплота не может переходить самопроизвольно от менее нагретого тела к более нагретому.
2.Невозможен процесс, единственным результатом которого является превращение теплоты в работу.
3.Вечный двигатель второго рода невозможен. Теплота, наиболее холодного из участвующих в процессе тел, не может служить источником работы.
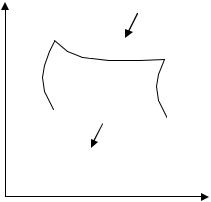
Аналитическое выражение второго закона термодинамики и его обоснование с использованием цикла Карно. Суть выражения второго закона термодинамики – связь самопроизвольности процесса с ростом энтропии. Это выражение вытекает из рассмотрения вопроса о теоретической полноте превращения теплоты в работу в обратимом цикле Карно. Цикл состоит из четырех процессов (рис.1):
АВ – изотермическое расширение за счет теплоты Q1, подведенной к газу при температуре Т1;
ВС – адиабатическое расширение; СД – изотермическое сжатие при температуре Т2, в этом процессе
газ теряет теплоту Q2;
ДА – адиабатическое сжатие до исходного состояния.
18
Р
Давление
(Теплоотдатчик)
А |
Т1 |
Q1 |
|
|
|
|
|
|
В
Т2 Д С
С
Q2
(Теплоприемник)
Мольный объем |
V |
Рис 1. Схема цикла Карно
Теплота, поглощаемая (или выделяемая) при изотермическом расширении (или сжатии) одного моль идеального газа, равна работе
Q A RT ln |
vкон. |
|
|
|
vнач. . |
(4.1) |
|||
|
||||
При адиабатическом расширении (или сжатии) |
|
|||
Q 0, А Сv (Tнач. Ткон. ). |
(4.2) |
|||
Применение этих уравнений к соответствующим процессам цикла приводит к выражению для термодинамического коэффициента полезного действия (к.п.д.):
|
|
А |
Q1 Q2 |
|
T1 T2 |
|
|
|
Q |
|
|
|
|
. |
(4.3) |
Q |
T |
||||||
|
|
|
1 |
|
1 |
|
|
Уравнение (4.3) является математическим выражением второго закона термодинамики.
Так как T1 ‹ T2, то η ‹ 1.
Согласно теории Карно замена идеального газа любым другим веществом не приведет к изменению к.п.д. цикла Карно. Замена цикла Карно любым другим циклом приведет к меньшему к.п.д. (теорема Клазиуса-Карно). Таким образом, даже в случае идеальной тепловой машины превращение теплоты в работу не может быть полным.
Выражение второго закона термодинамики позволяет ввести понятие энтропии, с помощью которой сущность закона раскрывается
в удобной и общей форме. Изменим выражение (4.3): |
|
|||||||||
1 |
Q2 |
1 |
T2 |
на |
Q1 |
|
Q2 |
0. |
(4.4) |
|
|
|
|||||||||
Q1 |
T1 |
Т1 |
T2 |
|||||||
|
|
|
|
|
|
|||||
19

Отношение Q называется приведенной теплотой. Уравнение
T
(4.4) показывает, что алгебраическая сумма приведенных теплот по обратимому циклу Карно равна нулю.
Для бесконечно малого обратимого цикла Карно Q1 Q2 0,
T1 T2
Q
где T - элементарная приведенная теплота.
Любой цикл может быть заменен совокупностью бесконечно
|
|
Q |
|
|
||
малых циклов Карно: |
i |
0. |
|
|
||
T |
Q |
|
||||
В пределе (i ) |
эта сумма превратится в |
0. |
||||
T |
||||||
В теории интегралов доказывается, что если интеграл по замкнутому контуру равен нулю, то подинтегральное выражение есть полный дифференциал некоторой функции от параметров, определяющих состояние системы.
Q dS , T
где S – это энтропия, такая функция состояния системы, полный дифференциал которой в обратимом процессе равен отношению бесконечно малого количества теплоты к температуре.
Понятие «энтропия» введено Клаузиусом (1850). Это выражение является математическим выражением второго закона термодинамики для обратимых процессов.
Изменение энтропии в обратимом процессе равно изменению энтропии в необратимом процессе, т.е. dSобрат. dSнеобрат. . Сравним теплоты обратимого и необратимого процессов. Согласно первому закону термодинамики Q U A. Внутренняя энергия U – это
функция состояния системы, поэтому dUобрат. dUнеобрат. . Максимальная работа совершается при обратимом процессе, поэтому
Aобрат . Aнеобрат .тогдаQ |
обрат . Qнеобрат .иdS |
|
Qнеобрат . |
. |
|
||||
|
|
|
T |
|
В общем случае для обратимого и необратимого процессов
второй закон термодинамики имеет следующее математическое выражение:
20
