- •Основные свойства катализаторов и факторы, влияющие на катализ.
- •3. Катализаторы снижают Eа.
- •6. Катализаторы увеличивают энтропию активации. Факторы, влияющие на катализ
- •Гомогенный катализ
- •Гетерогенный катализ
- •Основные стадии гетерогенного катализа
- •Теории активных центров гетерогенного катализа:
- •1. Мультиплетная теория: (а.А. Баландин)
- •2. Теория активных ансамблей (н. И. Кобозева)
- •3. Электронная теория (с.З. Рогинский)
- •Кислотно-основный катализ
- •Координационно-комплексный катализ
- •Ферментативный катализ
- •Ингибиторы
- •Для выяснения вопроса о типе ингибирования пользуются уравнением Михаэлиса-Ментена и Лайнуенвера-Берка.
- •Конкурентные ингибиторы
- •Неконкурентные ингибиторы
Ингибиторы
Ингибиторы – вещества, вызывающие частичное или полное торможение реакций, катализируемых ферментами.
Поскольку ферменты белки, то любые агенты, вызывающие денатурация белка (температура, кислоты, щелочи, соли тяжелых металлов), приводят к инактивации фермента. Однако, такое инактивирование не связано с механизмом действия ферментов. Гораздо большую группу составляют специфические ингибиторы, действующие на один фермент или группу ферментов. Исследование этих ингибиторов имеет важное значение по ряду причин :
1. Ингибиторы могут дать ценную информацию о природе активного центра фермента.
2. О природе функциональных групп фермента.
3. О природе химический связей, обеспечивающих образование ES.
Известные вещества, специфически связывающие ту или иную группу в ферменте, например :
R-SH + YCH₂COOH →HY + K-S-CH₂COOH, тем самым выключая его из акта катализа.
4. При помощи ингибиторов, избирательно выключающих отдельные стадии многоступенчатого метаболического процесса могут быть точно установлены последовательность реакций и природы ферментов. Таким образом, был установлен путь окислительно - восстановительных превращений глюкозы до молочной кислоты в тканях.
5. На ингибирование ферментов основан механизм действия многих токсинов и ядов. Известно, при отравлении HCN смерть наступает вследствие полного торможения дыхательных ферментов.
6. Метод лечения включает применение избирательных ингибиторов.
Если активные центры заняты ингибиторами, то на них каталитический процесс не происходит, наблюдается снижение активности фермента.
Это можно выразить следующей схемой:
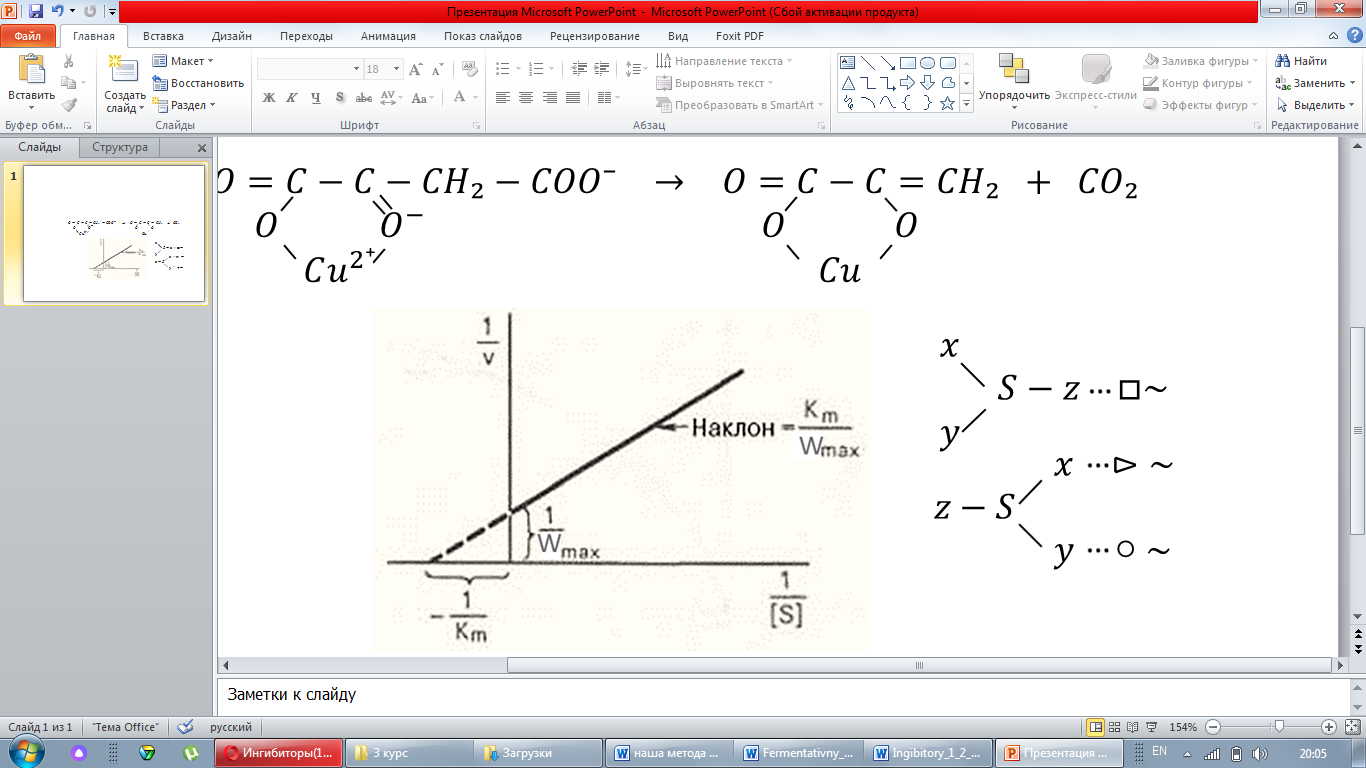
Для простейшей ферментативной реакций, когда активным является комплекс ES , а неактивным ESнеакт., зависимость скорости реакции от концентрации субстрата описывается уравнением :

где Ks - константа диссоциации ESнеакт.
Графически эта зависимость выражается кривой Cmax.
В кинетическом отношении ингибиторы ферментов подразделяются на:
обратимо и необратимо реагирующие, а также на конкурентные и неконкурентные.
1. Конкурентные ингибиторы обратимого действия реагируют, как правило, со свободными активными центрами, с которыми реагируют субстрат, и не реагирует с фермент-субстратным комплексом.
Стационарная кинетика системы фермент-субстрат - конкурентный ингибитор (Y) описывается уравнением:
 EY
EY

Ki - константа диссоциации EJ
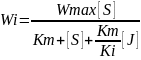
2. Неконкурентные ингибиторы реагируют вне активного центра, т.е. могут взаимодействовать с E и ES, снижая активность ферментов.
При действии необратимых ингибиторов (конкурентных и неконкурентных) в системе E-S-Y не возникает равновесия и реакционная способность таких ингибиторов оценивается величиной константы скорости Ki реакции
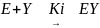
Для выяснения вопроса о типе ингибирования пользуются уравнением Михаэлиса-Ментена и Лайнуенвера-Берка.
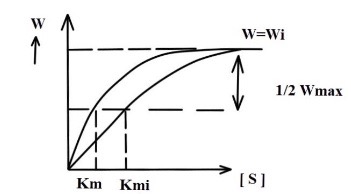
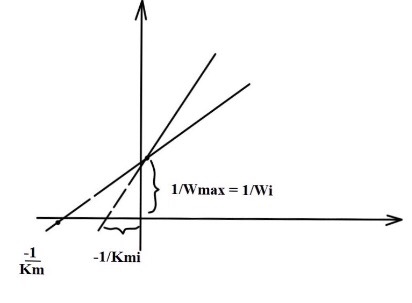
В приведенных ниже графиках, построенных в координатах W и [S], а также 1/w и 1/[S],
Wmax - максимальная скорость
Wi - максимальная скорость в присутсвие ингибитора
Ki - ингибиторная константа