
- •Основные свойства катализаторов и факторы, влияющие на катализ.
- •3. Катализаторы снижают Eа.
- •6. Катализаторы увеличивают энтропию активации. Факторы, влияющие на катализ
- •Гомогенный катализ
- •Гетерогенный катализ
- •Основные стадии гетерогенного катализа
- •Теории активных центров гетерогенного катализа:
- •1. Мультиплетная теория: (а.А. Баландин)
- •2. Теория активных ансамблей (н. И. Кобозева)
- •3. Электронная теория (с.З. Рогинский)
- •Кислотно-основный катализ
- •Координационно-комплексный катализ
- •Ферментативный катализ
- •Ингибиторы
- •Для выяснения вопроса о типе ингибирования пользуются уравнением Михаэлиса-Ментена и Лайнуенвера-Берка.
- •Конкурентные ингибиторы
- •Неконкурентные ингибиторы
Координационно-комплексный катализ
Сущность каталит. действия заключается в том, что ионы металлов выступают как доноры или акцепторы электронов
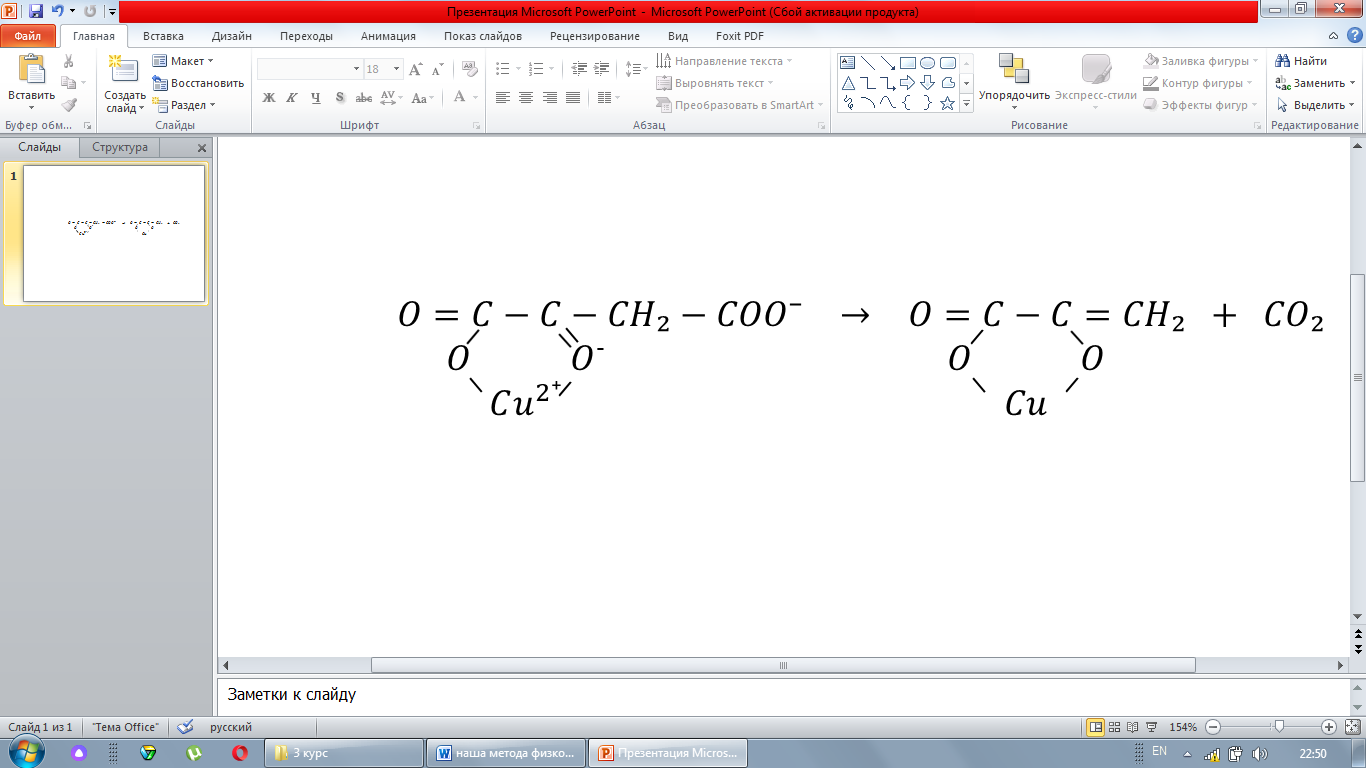
Пример 1: реакция декарбоксилирования щавелево-уксусной кислоты может ускориться ионом H⁺ или ионом металла, связывающем кислоту в комплекс:
Пример 2: реакция Кучерова
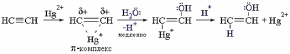
Ионы Н+ уменьшают отрицательный заряд и увеличивают легкость акцептирования остающейся молекулой пары электронов из отщепляющейся карбоксильной группы.
Однако еще лучше эту функцию выполнит многозарядный ион металла, связывающий анион дикетокислоты в прочный комплекс, как указано на схеме.
Для реакции декарбоксилирования найден порядок каталитической активности ионов: примерно соответствующий их способности к комплексообразованию.
Al 3+ > Fe 3+ > Cu 2+ >Fe 2+ > Zn 2+ > Mg 2+ > Mn2+ > Ca2+
В общем, ионы металлов будут катализировать реакции, ускоряемые кислотами, если при этом образуются промежуточные хелатные соединения.
!!! Каталитические свойства иона металла обусловлены его поляризующим действием, то есть отношением квадрата его заряда к радиусу (e2/r).
За счет поляризации снижается активационный барьер реакции.
Иногда бывает, что хорошие комплексообразователи с большим (e2/r) каталитически мало активны. Это относится к переходным металлам.
Для объяснения этого отклонения выдвинуто представление о том влиянии, которое оказывают изменение координации лигандов вокруг комплексного иона переходного элемента на его реакционную способность. Согласно этим взглядам, для каталитической реакции может быть существенна конфигурация орбит d-электронов иона-катализатора. В поле лигандов происходит расщепление d-уровней этого иона на подуровни, причем электроны стремятся занять низкие d-подуровни. Напротив, изменение координации вокруг переходных элементов, а также ионов со структурой d0 (Sc3+, Ti4+) и d5 (Fe3+, Mn2+ ) не вызывает изменений электронной конфигурации. Поэтому каталитические свойства ионов переходных и непереходных металлов должны отличаться. Кроме того, важное значение имеет просто геометрический размер иона. Известно, что ион Be2+ не способен катализировать бромирование ацетоуксусного эфира, так как кроме выше сказанного, он еще и просто мал, для того, чтобы разместить на себе два лиганда в активированном комплексе.
В живых организмах активаторами биокаитализаторов – ферментов также служат ионы- комплексооборазователей: марганец (2+), железо (2+; 3+), кобальт (2+), никель (2+), медь (2+), магний (2+). Комплексы этих ионов с органическими молекулами катализируют многие окислительно-восстановительные реакции и реакции гидролиза. Нпример, Mg2+ входит в состав хлорофилла, а Fe2+ в состав гемоглобина, а Fe3+ - в состав каталазы. В ряде случаев была обнаружена зависимость каталитической активности этих ионов от природы лиганда. Особенно сильно активируют азотосодержащие лиганды.
Увеличение константы скорости «k» при катализе комплексами одного и того же иона с различными лигандами, происходит засчет множителя k0 в уравнении Арениуса. В реакциях этого типа часто наблюдается постоянство энергии активации.
