
- •Основные свойства катализаторов и факторы, влияющие на катализ.
- •3. Катализаторы снижают Eа.
- •6. Катализаторы увеличивают энтропию активации. Факторы, влияющие на катализ
- •Гомогенный катализ
- •Гетерогенный катализ
- •Основные стадии гетерогенного катализа
- •Теории активных центров гетерогенного катализа:
- •1. Мультиплетная теория: (а.А. Баландин)
- •2. Теория активных ансамблей (н. И. Кобозева)
- •3. Электронная теория (с.З. Рогинский)
- •Кислотно-основный катализ
- •Координационно-комплексный катализ
- •Ферментативный катализ
- •Ингибиторы
- •Для выяснения вопроса о типе ингибирования пользуются уравнением Михаэлиса-Ментена и Лайнуенвера-Берка.
- •Конкурентные ингибиторы
- •Неконкурентные ингибиторы
Ферментативный катализ
Подавляющее большинство реакций, протекающих в организмах, осуществляется при помощи биологических катализаторов, которые имеют общее название "ферменты".
Ферменты – белки, входящие в состав клеток и тканей, катализирующие хим. реакции, протекающие в организме.
Характерная особенность ферментов - их специфичность
(свойство изменять скорость реакции одного типа и не влиять на многие другие реакции, протекающие в клетке)
Специфичность ферментов подразделяется на:
Абсолютная специфичность (химическая) – действие каждого фермента на вещества строго определенного состава. Например, уреаза катализирует гидролиз мочевины, пепсин - расщепление белков, каталаза действует только на пероксид водорода.
Стереохимическая специфичность заключается в том, что ферменты действуют только на определенные стереоизомеры органических соединений.
Причины высокой специфичности:
Теория Фишера "замок-ключ" – молекула субстрата (ключ) точно соответствует по своей форме некоторому участку на молекуле фермента. При этом не происходит нарушения формы обеих молекул.
Теория Кошланда (рука-перчатка) – он несколько видоизменил модель "ключ-замок". Согласно его гипотезе, субстрат присоединяется к активному центру, изменяет его форму, обеспечивая таким образом идеальное их соответствие.
Образование Ф-S комплекса может происходить за счет электрически заряженных группировок как на ферменте, так и на субстрате.
Такими группировками могут быть RCOO- или R-NH3+.
В результате такого взаимодействия в субстрате могут происходить определенные химические изменения, выражающиеся в образовании новых функциональных групп с совершенно иными полярными свойствами.
Т.о. специфичность фермента обусловлена его конфигурацией, строением и электрическими свойствами активной группы фермента.
Инактивация – явление разрушения фермента и утраты его активности в процессе протекания каталитической реакции.
Чем активнее фермент, тем он сильнее разрушается и значительная чувствительность к изменению внешних условий, температуры и рН среды.
Влияние рН на активность фермента объясняется изменением состояния ионизации не только фермента и субстрата в отдельности, но и фермент-субстратного комплекса.
Ферментативная реакция в целом протекает по схеме:

E - фермент, S - субстрат
ES - субстрат-ферментный комплекс,
P - продукт реакции
k1, k-1, k2 - константы скоростей W1, W-1 и W2.
Наиболее медленной стадией является распад фермент-субстратного комплекса на продукты реакции и фермент. Значит, эта стадия будет определять скорость ферментативной реакции
W2=K2[ES];
Эта скорость достигает max значения, когда весь фермент [E0] окажется связанным в виде фермент-субстратного комплекса:
Wmax=k2[E0]
Согласно закону действующих масс
- скорость образования субстрат-ферментного комплекса будет равна:
W1=k1[S][E]
- скорость распада субстрат-ферментного комплекса W-1 будет равна:
W-1=k-1[SE].
При достижении стационарного состояния скорость образования субстрат-ферментного комплекса W1 будет равна скорости его распада по обоим направлениям:
W1=W-1+W2
k1[S]{[E0+]-[ES]}=k-1[ES]+k2[ES].
Преобразуем:
k1[S][E0]=k1[S][ES]+k-1[ES]+k2[ES]
или
k1[S][E0]=[ES]{k1[S]+(k-1+k2)};
Разделим на k1
[S][E0]=[ES]{[S]+ (k-1+k2)/k1}.
(k-1+k2)/k1=Km
Выразим [ES]:
[ES]=[S][E0]/([S]+Km)
Т.к за образование продуктов р. отвечает W2, то для общей скорости реакции:
W2=k2[ES]=k2[S][E0]/(Km+[S])
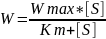
ур-е Михаэлеса-Мента
где Wmax = [E0]* k2 – это максимальная скорость, когда весь катализатор связан
При скорости ферментативной реакции
W2=1/2max
Km=[S].
Km – константа Михаэлеса
График зависимости скорости ферментативной реакции от концентрации субстрата выглядит следующим образом:

При небольших концентрациях [S] молекулы субстрата полностью располагаются на активных центрах и скорость ферментативной реакции прямо пропорциональна этой концентрации. Это участок ОА, отвечающий реакции 1-ого порядка. По мере занятости активных центров скорость падает и достигает постоянной величины.
В классическом виде уравнение Михаэлиса-Ментен выглядит следующим образом:
W=Wmax*[S]/(KS+[S])
Km=(k-1+k2)/k+1=KS+k2/k+1
k-1/k+1=KS – константа диссоциации субстрат-ферментного комплекса или субстратная константа.
KS зависит от природы субстрата и фермента и определяет степень их сродства. Чем меньше KS, тем больше их сродство.
Уравнение: W=Wmax*[S]/(Km+[S]) называется уравнением Бригса-Холдейна
Для более удобного графического представления экспериментальных данных Берк и Лайнуивер преобразовали уравнение Бригса-Холдейна, исходя из принципа: если существует равенство между двумя величинами, то равны и их обратные величины;


По этому графику Km и Wmax определяются более точно.
