
- •Основные свойства катализаторов и факторы, влияющие на катализ.
- •3. Катализаторы снижают Eа.
- •6. Катализаторы увеличивают энтропию активации. Факторы, влияющие на катализ
- •Гомогенный катализ
- •Гетерогенный катализ
- •Основные стадии гетерогенного катализа
- •Теории активных центров гетерогенного катализа:
- •1. Мультиплетная теория: (а.А. Баландин)
- •2. Теория активных ансамблей (н. И. Кобозева)
- •3. Электронная теория (с.З. Рогинский)
- •Кислотно-основный катализ
- •Координационно-комплексный катализ
- •Ферментативный катализ
- •Ингибиторы
- •Для выяснения вопроса о типе ингибирования пользуются уравнением Михаэлиса-Ментена и Лайнуенвера-Берка.
- •Конкурентные ингибиторы
- •Неконкурентные ингибиторы
Катализ – явление изменение скорости реакции в присутствии веществ-катализаторов
Катализатор – вещество, взаимодействующее с молекулами реагирующих в-в, изменяющее скорость хим. реакции и выделяющиеся на последующих стадиях в неизменном виде.
Если катализатор – один из продуктов реакции, то реакция – автокаталитическая
Основные свойства катализаторов и факторы, влияющие на катализ.
1. Катализаторы обладают избирательностью, т.е. способностью действовать ускоряюще только на определенную реакцию или группу реакций. Это особенно характерно для катализаторов-ферментов.



Ni
Cu
OH─

Избирательное действие катализаторов зависит от соответствия между расстояниями атомов в молекуле и активными центрами на поверхности катализатора.
2. Количество катализатора гораздо меньше по сравнению с количеством реагирующих веществ. В производстве HNO3 окислением NH3 на 1 массовую часть катализатора превращается 106 массовых частей исходного вещества.
3. Катализаторы снижают Eа.
Разложение H2O2 → H2 + O2 без катализатора идет с Eа = 75,312 кДж/моль; с катализатором «Pt коллоидная» Eа снижается до 48,953 кДж/моль, а с ферментом каталазой – до 23,012 кДж/моль.
4. Катализаторы увеличивают скорость прямой и обратной реакции, но K химического равновесия не изменяют. Т.е. - Kt не влияет на состояние ТД равновесия.
(Скорости р. увеличиваются в равной степени, быстрее устанавливается равновесие)
5. Катализаторы претерпевают изменения в процессе химического превращения, но в конце реакции выделяются в неизменном количестве и качестве.
6. Катализаторы увеличивают энтропию активации. Факторы, влияющие на катализ
0*. Природа катализатора и реагентов.
1. Температура повышает активность катализатора, а иногда меняет направление процесса.
Каждый катализатор имеет свою температуру, при которой его активность max. Отклонение от этой температуры снижает его активность. Вот почему при некоторых экзотермических каталитических процессах необходимо отводить тепло. Особенно чувствительны к изменениям температуры ферменты – биологические катализаторы.
2. Давление влияет особенно на те процессы, которые идут с изменением объема. Некоторые реакции, идущие без уменьшения объема, увеличивают свою скорость при повышении давления. Это, очевидно, связано с увеличением числа эффективных столкновений.
3. Влияние растворителя, при этом большое значение имеет полярность молекул растворителя, под влиянием которой молекулы реагирующих веществ переходят в более активную ионизированную форму.
4. Степень дисперсности катализатора увеличивает поверхность раздела, но до определённого предела, т.к. увеличение степени дисперсности может привести к гомогенности (сильное увеличение дисперсности может уничтожить границу поверхности раздела).
5. Влияние активаторов и ингибиторов
Активаторы стимулируют активность катализатор, ингибиторы – угнетают
Еще есть т.н. «каталитические яды» (мышьяк, синильная кислота) – которые полностью прекращают действие катализатора, взывая как бы отравление катализатора
Гомогенный катализ
В гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе.
Например: в растворах
Осн. механизм действия гомоген. катализатора – образование реакционноспособных промежуточных продуктов.
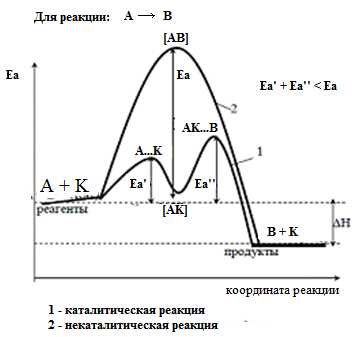
Снижение энергии активации с участием катализаторов по сравнению с некаталитической реакцией показана на рисунке.
k1
k2
 АК
АК
k3
АК
 В + К
В + К
1 реакция – реакция образования промежуточно-активного комплекса АК. Реакция может быть обратимой.
2 реакция – реакция разложения промежуточного вещества с образованием продукта реакции В и восстановлением катализатора.
– Если скорость второй реакции больше, то общая скорость реакции определяется скоростью первой реакции; концентрация промежуточного вещества мала. Скорость реакции пропорциональна концентрации исходного вещества и катализатора.
– Если скорость первой реакции больше скорости второй, то общая скорость реакции определяется скоростью второй реакции; концентрация промежуточного вещества велика (практически связан весь катализатор). Вторая реакция не изменяет равновесия, установившегося по первой реакции.
Второй случай наиболее интересен в кинетическом отношении. Рассмотрим его более подробно!
Запишем константу равновесия для первого процесса:
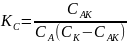
здесь пренебрегают изменением концентрации исходного вещества за счет образования промежуточного вещества.
Найдем
из этого отношения концентрацию
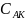 :
:
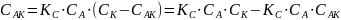
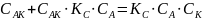
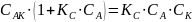
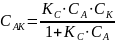
Общая скорость химической реакции запишется следующим образом:
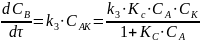
Из этого уравнения видно, что в одном случае скорость образования продукта реакции пропорциональна концентрации катализатора. В другом, должен наблюдаться в общем случае дробный порядок реакции.
Разберем предельные случаи:
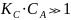 ,
тогда
,
тогда
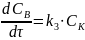
(сокращаем
в дроби
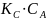 и остается только это)
и остается только это)
Наблюдается нулевой порядок по реагирующему веществу. Это значит, что весь катализатор связался в промежуточный комплекс и скорость реакции определяется его количеством.
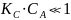 ,
тогда
,
тогда
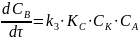 (весь числитель)
(весь числитель)
Наблюдается первый порядок по реагирующему веществу.
Могут встречаться и более сложные случаи. Например, если промежуточное вещество образуется из нескольких молекул реагирующего вещества и одной молекулы катализатора.
k2
k1

k3
KnA B + K
Скорость реакции в этом случае запишется так:
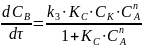
здесь порядок может меняться от 0 до n.
