
лаб 2
.docx

МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего образования
«МИРЭА – Российский технологический университет»
РТУ МИРЭА
|
Институт тонких химических технологий им. М.В. Ломоносова |
|
(наименование Института)
|
Кафедра общей химической технологии |
|
(наименование кафедры)
Лабораторная работа №2
Получение кинетических характеристик химической реакции на основе результатов эксперимента
Вариант 21
Работу выполнила
Студентка группы ХБМО-02-20
Иванова Елена Анатольевна
Руководитель работы
Кацман Евгений Александрович
Москва, 2020
Цель работы: получить кинетические характеристики химической реакции, сделав минимальное количество замеров.
Задача работы: по заданным начальным данным (максимальные и минимальные температуры и средние показатели времени пребывания в реакторе) рассчитать параметры уравнения Аррениуса для каждой из стадий сложной реакции.
Исходная область исследования:
Tmin = 323 K
Tmax = 373 K
tmin =10 с
tmax = 50 с
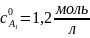
Теоретическая часть
В аппарате идеального смешения, работающем в стационарном изотермическом режиме, проходит сложная реакция, схема которой представлена ниже (все стадии первого порядка вне зависимости от стехиометрии стадий):
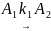
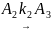
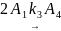
Целевым является продукт A2.
Уравнение Аррениуса связывает константу скорости реакции с температурой:
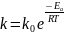 (2.1)
(2.1)
где k0 – предэкспоненциальный множитель (предэкспонента), Ea – энергия активации, R – универсальная газовая постоянная.
Математическое описание данных стадий реакции в случае идеального смешения при стационарном режиме можно представить в следующем виде:
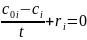 (2.2)
(2.2)
где i = 1…n – номер вещества, t – среднее время пребывания вещества в аппарате, coi и ci – концентрации i-го вещества на входе и выходе из реактора, ri – скорость реакции по i-му веществу.
Экспериментальная часть
Задаются значения температуры и среднего времени пребывания в реакторе. После этого выводятся концентрации веществ. Зависимость выводится в виде таблицы 1.
Таблица 1. Результаты эксперимента
N |
T |
t |
C1 |
C2 |
C3 |
C4 |
1 |
323 |
50 |
0,23991 |
0,67179 |
0,16837 |
0,05997 |
2 |
373 |
10 |
0,04055 |
0,24302 |
0,60846 |
0,15398 |
Обработка и обсуждение результатов
Схема реакции:
Все стадии первого порядка вне зависимости от стехиометрии стадий.
Математическое описание данных стадий реакции:
(2.2)
Для заданных стадий:
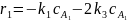 (2.3)
(2.3)
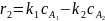 (2.4)
(2.4)
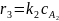 (2.5)
(2.5)
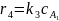 (2.6)
(2.6)
Число уравнений равно числу веществ, участвующих в реакции (четырем). Таким образом, подставив формулы 2.3-2.6 в 2.2, а также подставив в полученные уравнения значения среднего времени пребывания и концентрации веществ (начальных и полученных в ходе эксперимента), уравнения будут содержать всего три неизвестных (константы скорости трех стадий реакции). Для решения системы уравнения с тремя неизвестными достаточно три уравнения (при расчете одно исключаем).
Для заданных реакций запишем уравнения математического описания реакций:
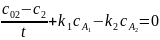 (2.7)
(2.7)
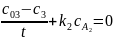 (2.8)
(2.8)
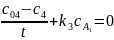 (2.9)
(2.9)
Выражаем в 2.7-2.9 неизвестные константы скорости реакции (в 2.7 k1 через k2 путем подстановки 2.8) и находим значения при разных значениях температуры и времени. Результаты расчетов представлены в таблице 2.
Таблица 2. Результаты расчетов констант скоростей реакций
T, K |
t |
k1 |
k2 |
k3 |
323 |
50 |
0,07004 |
0,005013 |
0,004999 |
373 |
10 |
2,099827 |
0,250374 |
0,379729 |
Для расчета параметров уравнения Аррениуса это уравнение приводится к линейному виду:
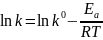 (2.10)
(2.10)
Уравнение записывается для двух температур:
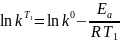
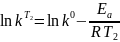
Вычитая из первого уравнения второе и выразив энергию активации, получаем:
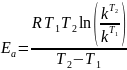
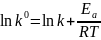
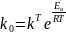
Подставляем экспериментальные данные, результаты оформляем в таблицу 3.
Таблица 3. Значения энергий активации и предэкспоненциальных множителей для каждой стадии реакции.
№ стадии |
Ea |
lnk0 |
k0 |
1 |
68124 |
22,7094 |
7,29E+09 |
2 |
78350 |
23,8803 |
2,35E+10 |
3 |
86747 |
27,0044 |
5,34E+11 |
По результатам таблицы 3 можно заметить, что значение энергии активации 2 стадии (побочной для заданной сложной реакции) больше аналогичного значения для 1 стадии. Отсюда следует, что при увеличении температуры в реакторе будет увеличиваться скорость 2 стадии, что приведет к уменьшению целевого продукта A2 (рис.1).
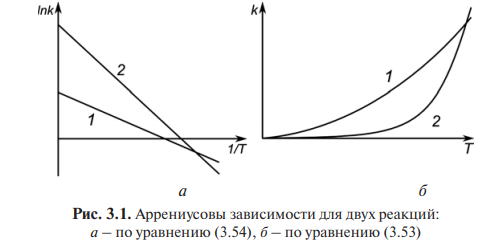
Рис. 1. Аррениусовы зависимости для двух стадий реакции при Ea1<Ea2: а – по уравнению (2.10), б – по уравнению (2.1)
Выводы
Для решения обратной задачи, т.е. при определении значений характеристических констант сложной реакции, выгодно брать минимальное время пребывания при максимальной температуре и наоборот. В этом случае будет обеспечена близкая глубина превращения в двух рассматриваемых опытах.
В ходе исследования было показано, что для заданной реакции проходящей в стационарном изотермическом процессе, наиболее выгодно брать низкие температуры с целью предотвращения увеличения скорости побочной реакции.
