
Примеры
Гемолитические анемии, развивающиеся в результате белковозависимой мембранопатии: наследственный сфероцитоз (болезнь Минковского‑Шоффара), наследуемый эллиптоцитоз, стоматоцитоз, пиропойкилоцитоз, синдром «Rh‑ноль».
Гемолитические анемии, развивающиеся вследствие липидозависимой мембранопатии наблюдаются при акантоцитозе.
• Ферментопатии. Гемолитические анемии, обусловленные ферментопатиями, характеризуются нарушением белково‑липидной структуры и физико‑химического состояния мембран эритроидных клеток и развиваются при генных мутациях ряда ферментов.
• Гемоглобинопатии. Описано большое число гемоглобинопатий, сопровождающихся проявлениями гемолитической анемии (см. далее «Талассемии», а также статью «Гемоглобинопатии» в приложении «Справочник терминов» на компакт диске).
Проявления гемолитических анемий
Проявления гемолитических анемий разнообразны и в значительной степени определяются конкретным заболеванием. Наиболее общие проявления представлены на рис. 21–8.
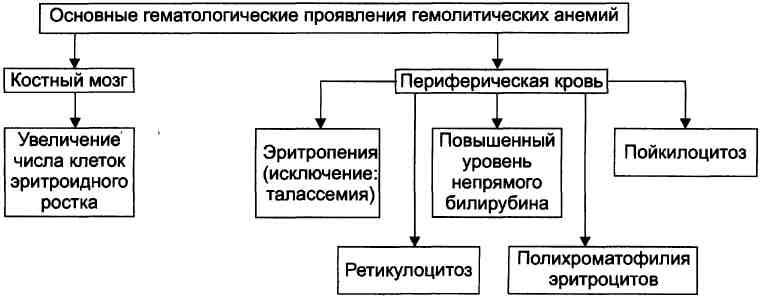
Рис. 21–8. Основные гематологические проявления гемолитических анемий.
Дизэритропоэтические анемии
Дизэритропоэтические анемии дифференцируют в зависимости от происхождения (рис. 21-9).
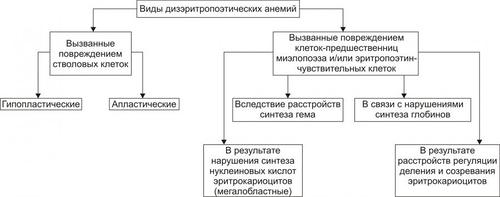
Рис. 21–9. Виды дизэритропоэтических анемий.
Гипопластическая и апластическая анемии
Гипо‑ и апластические анемии, развивающиеся в результате преимущественного повреждения стволовых клеток, являются результатом подавления функции костного мозга. По происхождению эти анемии подразделяют на первичные и вторичные.
• К первичным дизэритропоэтическим анемиям относится анемия Фанкони.
• Ко вторичным (приобретённым) — гипо- и апластические — дизэритропоэтические анемии. Они являются результатом действия одной или нескольких групп факторов: физической природы (например, ионизирующего облучения), химической (чаще всего ЛС, например, левомицетина, бутадиона, иммунодепресантов, мепробамата, аминазина, цитостатиков и др.) или биологической природы (главным образом — вирусов, например, вызывающих гепатит, инфекционный мононуклеоз и др., а также антиэритроцитарных АТ и T-цитотоксических лимфоцитов).
Патогенез
Высокие дозы ионизирующей радиации обусловливают гипоплазию костного мозга. Выраженность её зависит от дозы облучения. В основе гипоплазии кроветворной ткани лежат необратимое повреждение и гибель стволовых клеток, вплоть до их полного исчезновения, наблюдающегося при аплазии.
Химические и биологические факторы (например, вирусы и ЛС) тормозят синтез нуклеиновых кислот и белка в стволовых клетках, нарушают клеточное и/или физико‑химическое микроокружение стволовых клеток, что ведёт к расстройствам механизма их пролиферации, повреждают и вызывают гибель стволовых клеток в связи с образованием иммунных лимфоцитов и/или АТ.
Любой из указанных механизмов (или их комбинация) обусловливает нарушение пролиферации и/или гибель стволовых гемопоэтических клеток, включая эритропоэтические. Это и ведёт к развитию гипо‑ или апластическим анемиям.
Наследственная апластическая анемия (Фанкони)
Причина — наследуемый по рецессивно-аутосомному типу дефект гемопоэтических клеток.
Патогенез нарушение процессов репарации ДНК стволовых клеток.
Проявления. В костном мозге значительное ↓ числа ядросодержащих клеток миелоидного ряда. Нередко обнаруживается ↑ числа лимфоидных клеток различной степени зрелости.
В периферической крови панцитопения (↓ числа всех видов клеток крови). Исключение - лимфоциты. Содержание Нв в каждом эритроците в норме, однако общая концентрация его в крови резко ↓ (в связи с эритропенией), достигая нередко уровня 20–30 г/л. Количество ретикулоцитов ↓. Многие эритроциты превышают нормальный размер (макроцитоз, анизоцитоз) в связи с элиминацией незрелых клеток из костного мозга. Продолжительность жизни эритроцитов ↓.
Клинически ⇒ признаки гипоксии, тромбоцитопении (кровотечения), лейкопении (инфекции).
Проявления. Для гипо‑ и апластических анемий характерны следующие изменения в костном мозге и периферической крови (рис. 21–10).
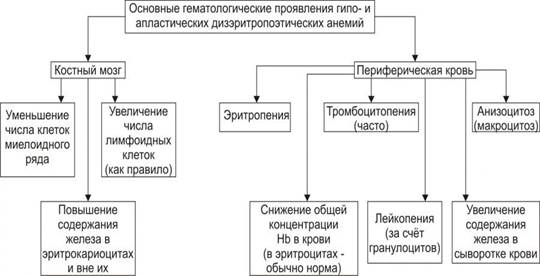
Рис. 21–10. Основные гематологические проявления гипо‑ и апластических дизэритропоэтических анемий.
Анемии, развивающиеся при нарушениях обмена железа
К анемиям, развивающимся при нарушениях обмена железа, относят железодефицитные (сидеропенические) и железорефрактерные (сидероахрестические) анемии.
• Обмен железа в организме
Железо участвует в функционировании всех биологических систем. Суточная потребность в железе составляет для мужчин 10 мг, для женщин 18 мг (в период беременности и лактации — 38 и 33 мг соответственно). Общее количество железа в организме составляет 4–4,5 г. Различают клеточное железо, внеклеточное железо и железо запасов (рис. 21–12).
Дефицит железа в организме развивается, когда потери его превышают 2 мг/сут. К этому могут привести:
Увеличение потерь железа при хронических, повторных кровопотерях (желудочных, кишечных, маточных и др.), а также массированных кровоизлияниях.
Возрастание расходования железа организмов при беременности и последующем вскармливании ребёнка (за этот период теряется в общей сложности более 800 мг железа), особенно на фоне ещё не проявляющегося клинического дефицита железа).
Снижение поступления железа в организм вследствие общего голодания, значительного уменьшения в рационе продуктов питания, содержащих железо, нарушения всасывания железа в ЖКТ (всасывается главным образом двухвалентное железо, входящее в состав гема; нарушение этого процесса развивается при хронических гастритах, энтеритах, резекциях желудка и особенно тонкой кишки).
• Железодефицитные анемии
Патогенез железодефицитных анемий приведён на рис. 21–13.
В Патогенезе железодефицитной анемии определяют три основных звена: нарушение синтеза гемоглобина в результате уменьшения запасов железа, генерализованные нарушения пролиферации клеток и укорочение продолжительности жизни эритроцитов (последнее наблюдают преимущественно при тяжёлом дефиците железа).
Проявления железодефицитных анемий приведены на рис. 21–14.

Рис. 21–14. Основные гематологические проявления железодефицитных анемий.
Костный мозг.
Сохраняется нормобластический тип кроветворения.
Часто (но не всегда) наблюдаются умеренная гиперплазия клеток красного ростка гемопоэза. Увеличено число базофильных и полихроматофильных эритробластов при уменьшении количества оксифильных (признак торможения эритропоэза).
Снижено содержание депонированного в костном мозге железа и числа сидеробластов — нормобластов с гранулами железа.
Периферическая кровь.
Снижено количество эритроцитов и значительно уменьшено содержание Hb (до 30–40 г/л). Это обусловливает развитие гемической гипоксии.
Цветовой показатель снижен до 0,6 и более.
Количество ретикулоцитов различно: от нормального до сниженного (при хроническом течении анемии) или повышенного (на начальных этапах анемии).
Пойкилоцитоз, анизоцитоз (много микроцитов), наличие «теней» эритроцитов (в связи со сниженным содержанием в них Hb).
Уровень железа (Fe2+) в плазме крови понижен (сидеропения) до 1,8–7,2 мкмоль/л (при норме 12–30 мкмоль/л).
Содержание лейкоцитов имеет тенденцию к снижению (за счёт нейтрофилов).
Число тромбоцитов обычно в пределах нормы.
Ткани и органы. В большинстве тканей организма развиваются различные дистрофии. Они вызваны дефектами структуры и функциональной активности железосодержащих ферментов и других соединений (например, глутатионпероксидаз, каталазы, пероксидаз, цитохромов, миоглобина). В связи с этим, а также вследствие развития тканевой гипоксии, выявляются мышечная слабость (миастения), шелушение, трещины кожи и слизистых оболочек, повышенная ломкость ногтей, выпадение волос, изменения стенки ЖКТ (сопровождающиеся гипотрофическим глосситом, гастритом, энтеритом).
