
- •2. Обмен белков
- •2.1. Пути распада белков
- •2. Переваривание белков.
- •Парентеральное белковое питание
- •2.2. Превращения аминокислот Превращения аминокислот под действием микрофлоры кишечника
- •Реакции по аминогруппе
- •Реакции по карбоксильной группе
- •2. Образование аминоациладенилатов.
- •2.3. Обезвреживание аммиака в организме
- •Пути связывания аммиака
- •Фумарат пируват аспартат
- •2.4. Нарушения азотистого обмена
- •2.5. Специфические пути обмена некоторых аминокислот
- •2. Обмен серосодержащих аминокислот.
- •3. Обмен аминокислот с разветвленной цепью.
- •Лей, Иле, Вал α-кетокислоты ацил-КоА-производные
- •4. Обмен дикарбоновых аминокислот
- •5. Обмен диаминомонокарбоновых кислот.
- •6. Обмен фенилаланина и тирозина.
- •7. Обмен триптофана.
- •2.6. Обмен сложных белков. Обмен хромопротеинов
- •Распад гемоглобина в тканях (образование желчных пигментов)
- •Биосинтез гемоглобина
- •2.7. Обмен нуклеопротеинов
- •Аденин гипоксантин; гуанин ксантин
- •Синтез пиримидиновых нуклеотидов у, ц, т
- •Биосинтез пуриновых оснований а, г
- •Синтез дезоксирибонуклеотидов
Парентеральное белковое питание
Введение белков парентерально приводит к развитию сенсибилизации, а повторное введение белков может вызвать анафилаксию. Для белкового питания используют гидролизаты белков (смесь аминокислот). Это не вызывает аллергической реакции. Однако возможны побочные реакции, например, нарушение нормальной психической деятельности.
2.2. Превращения аминокислот Превращения аминокислот под действием микрофлоры кишечника
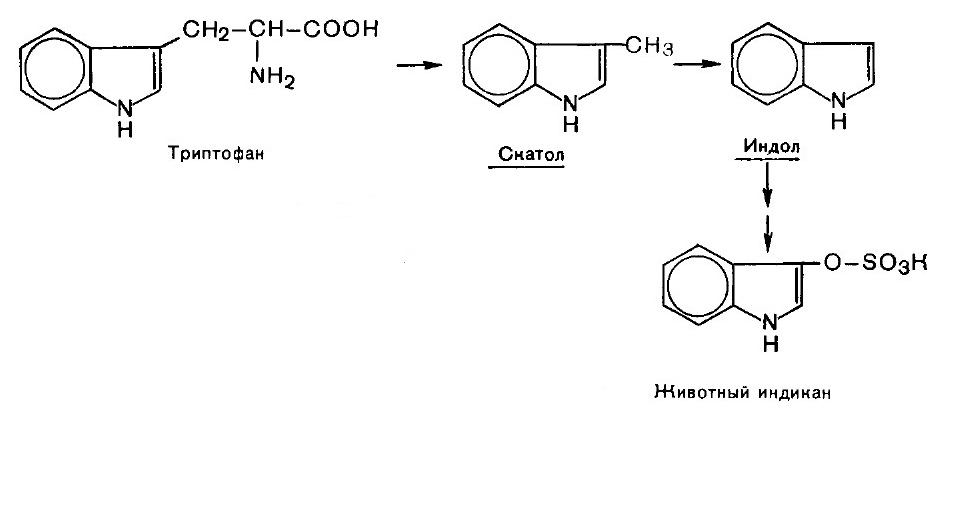
Все превращения аминокислот, вызванные деятельностью микроорганизмов кишечника, получили общее название «гниение белков в кишечнике». В кишечнике образуются ядовитые продукты обмена - сероводород H2S, метилмеркаптан CH3SH, амины, крезол, фенол, скатол и индол.
В печени они подвергаются обезвреживанию путем химического связывания с серной или глюкуроновой кислотой и выделяются с мочой.
Реакции по аминогруппе
1. Дезаминирование аминокислот. Во всех случаях NH2-rpyппa аминокислоты освобождается в виде аммиака.
Восстановительное дезаминирование
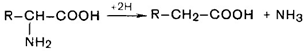
Гидролитическое дезаминирование
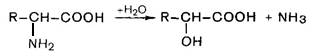
Преобладающим является окислительное дезаминирование.
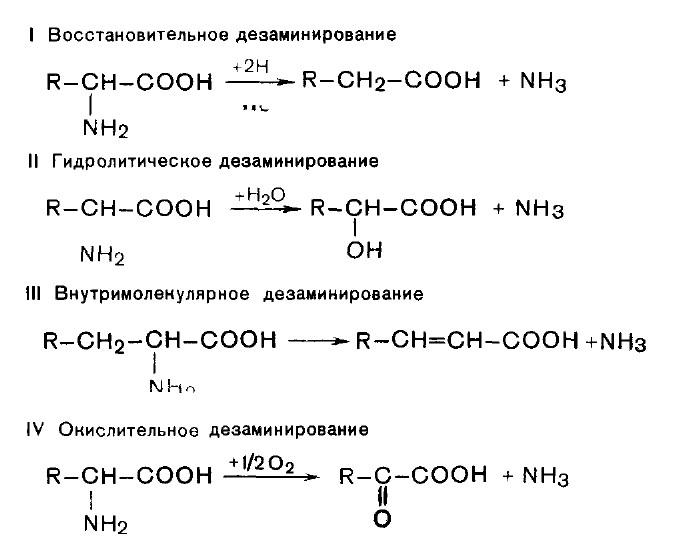
С наибольшей скоростью дезаминируется глутаминовая кислота. Глутаматдегидрогеназа - анаэробный фермент. Ее коферменты – НАД+ или НАДФ+. Сначала глутамат окисляется в иминоглутарат при участии глутаматдегидрогеназы, а затем иминокислота гидролизуется с образованием α-кетоглутарата и аммиака.

Гистидин подвергается внутримолекулярному дезаминированию.

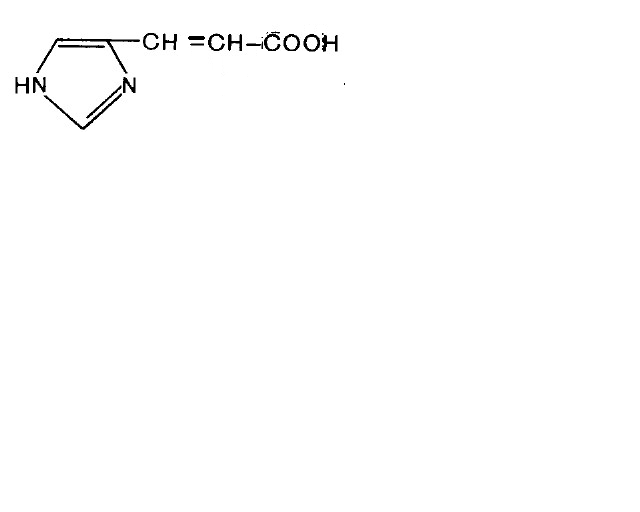
уроканиновая кислота
2. Трансаминирование аминокислот - реакции межмолекулярного переноса аминогруппы (NH2—) от аминокислоты на α-кетокислоту. Большинство L-аминокислот дезаминируется в организме путем трансаминирования (переаминирования) с α-кетоглутаровой кислотой:
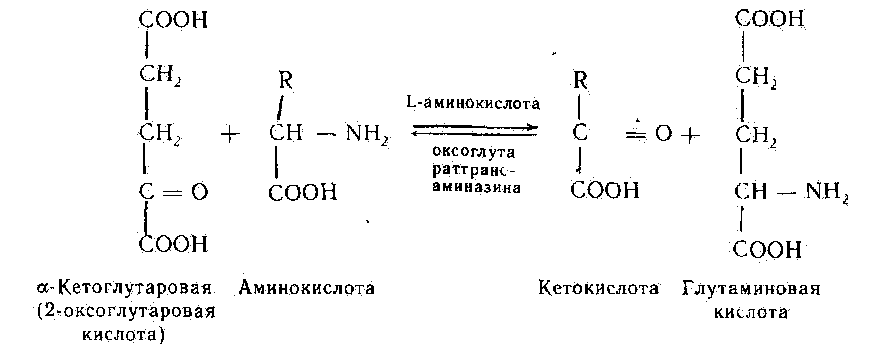
Ферменты - аминоферазы, или трансаминазы. Они содержатся практически во всех органах, но наиболее активно реакции трансаминирования протекают в печени. Их кофермент - пиридоксальфосфат (производное витамина В6). Образовавшаяся глутаминовая кислота подвергается окислительному дезаминированию. А. Е. Браунштейн для подобного непрямого пути дезаминирования аминокислот предложил термин трансдезаминирование.
Для клинических целей наибольшее значение имеют аспартат-аминотрансфераза (АсАТ) и аланин-аминотрансфераза (АлАТ), катализирующие перенос аминогруппы с аспартата и аланина на -кетоглутарат:
аспартат + α-кетоглутарат оксалоацетат + глутамат
аланин + α-кетоглутарат пируват + глутамат
В сыворотке крови здоровых людей активность этих трансаминаз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. Уже через 3- 5 ч после развития инфаркта миокарда уровень АсАТ в сыворотке крови резко повышается (в 20-30 раз). Уровень АлАТ в крови повышается при заболеваниях печени.
Реакции по карбоксильной группе
1. Декарбоксилирование аминокислот. Простетической группой декарбоксилаз L-аминокислот служит пиридоксальфосфат (активная форма витамина В1). Продуктами декарбоксилирования аминокислот являются амины. Так как они образуются в качестве продуктов жизнедеятельности и обладают высокой физиологической активностью, их называют биогенными аминами.
Открыты 4 типа декарбоксилирования аминокислот. Для тканей животных характерно α-декарбоксилирование.
![]()
При декарбоксилировании гистидина возникает гистамин. Он вызывает расширение сосудов в очаге воспаления, участвует в секреции соляной кислоты в желудке, что используется в клинике при изучении секреторной деятельности желудка (гистаминовая проба). При повышенной чувствительности к гистамину используют антигистаминные препараты.
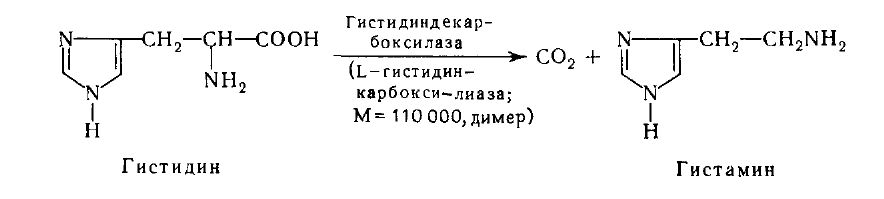
При декарбоксилировании глутаминовой кислоты образуется у-аминомасляная кислота:
НООСCH(NH2)CH2CH2COOH
 NH2CH2CH2CH2COOH
+ СО2
NH2CH2CH2CH2COOH
+ СО2
глутаминовая кислота -аминомасляная кислота
Она накапливается в мозговой ткани и представляет собой нейрогуморальный ингибитор. ГАМК используется в клинике как лекарственное средство при некоторых заболеваниях ЦНС.
Декарбоксилаза ароматических аминокислот катализирует декарбоксилирование 3,4-диоксифенилаланина (ДОФА), образуется дофамин. Он является предшественником норадреналина и адреналина.
Накопление биогенных аминов может вызывать нарушения ряда функций в организме. Существуют специальные механизмы обезвреживания биогенных аминов. Происходит их окислительное дезаминирование с образованием альдегидов и освобождением аммиака. Ферменты - моноамино-и диаминоксидазы. Процесс является необратимым и протекает в две стадии:
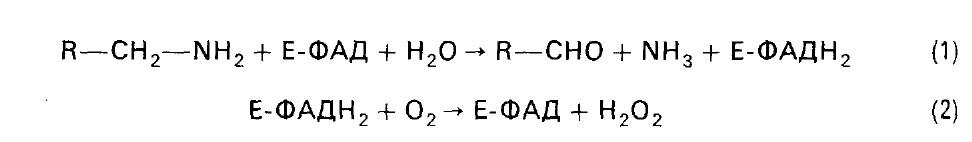
Пероксид водорода далее распадается на воду и кислород. Моноаминоксидаза (МАО), ФАД-содержащий фермент, преимущественно локализуется в митохондриях.
