- •Свойства растворов и гетерогенных систем
- •1.Общая характеристика. Концентрация растворов
- •Способы выражения концентрации растворов. Важной характеристикой растворов является концентрация.
- •2. Растворимость
- •3. Коллигативные свойства растворов
- •1) Повышение температуры кипения раствора пропорционально количеству молей растворенного вещества при условии, что количество молей растворителя постоянно:
- •Электрическая проводимость водных растворов. Электролиты
- •Теория сильных электролитов.
- •Роль рН в биологических жидкостях организма
- •Буферные растворы
- •Гидролиз солей
- •Закон действия масс в гетерогенных системах. Растворимость плохорастворимых электролитов.
Теория сильных электролитов.
Эта теория была создана в 1923 г Дебаем и Хюккелем. Поскольку в растворе сильные электролиты практически полностью диссоциируют на ионы, постольку в растворе резко увеличивается концентрация частиц (ионов), расстояние между ними резко снижается и усиливается кулоновское взаимодействие между ионами.
Согласно закону Кулона сила притяжения или отталкивания между ионами равна:
F = Z1Z2/(r2),
где Z1 , Z2 – заряды ионов, r – расстояние меж ними, - диэлектрическая проницаемость.
Кулоновским взаимодействием пренебречь нельзя, что делала теория Аррениуса. Поэтому законы, выведенные для слабых электролитов, оказались не действительны для сильных электролитов. Вследствие этого было введено понятие АКТИВНОСТИ. Активность – это действительная концентрация, которая может быть равна концентрации в разбавленных растворах, а в концентрированных - может изменяться в большую или меньшую сторону. Активность связана с концентрацией уравнением:
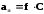 ,
,
где f – коэффициент активности изменяется в зависимости от концентрации.
При f = 1, а = С (в разб. Р-рах)..
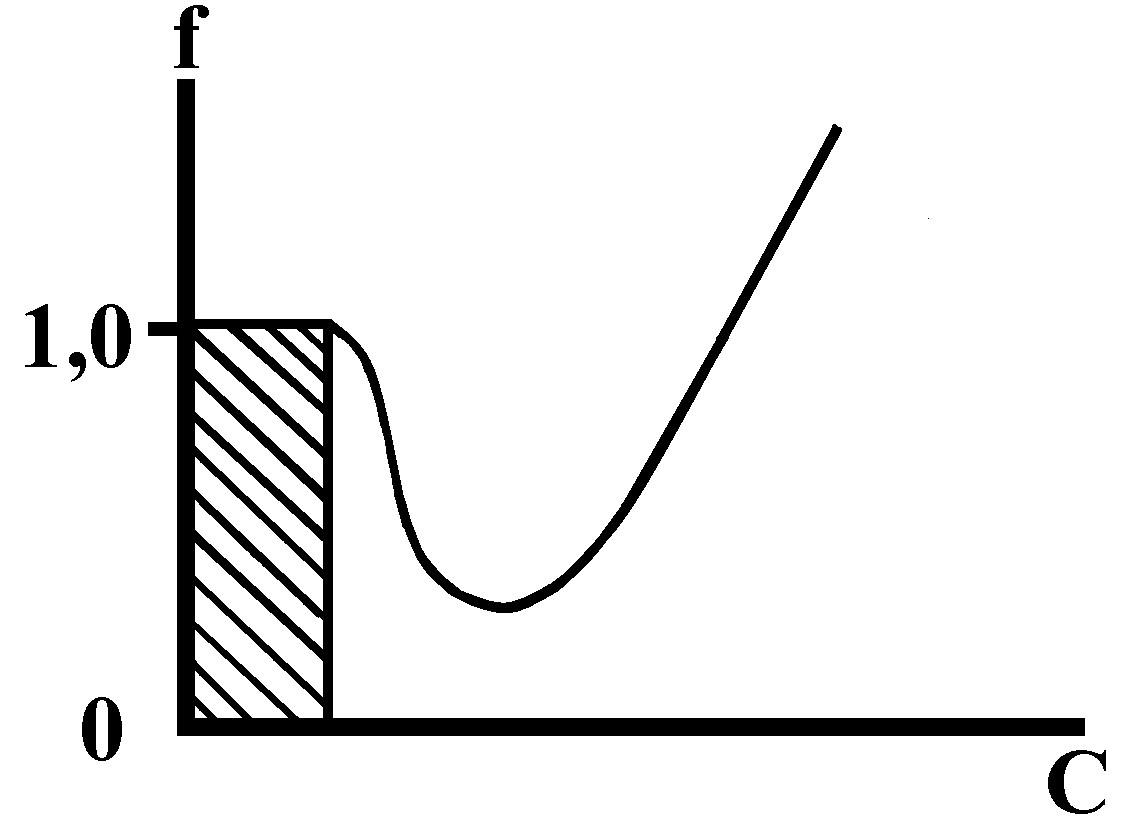
Причем оказалось, что коэффициент активности сам весьма сложно зависит от концентрации (рис. 1).
|
|
Рис. Зависимость коэффициента активности электролита от его концентрации |
В области низких концентраций (заштрихованная область) f = 1, а = С. На дальнейшем участке кривой f 1 (концентрированные растворы), а ход кривой зависит от природы электролита, ионов, природы растворителя и др.
|
С (NaCl), моль/кг |
f+ |
f- |
|
0,2 |
0,744 |
0,726 |
|
0,5 |
0,701 |
0,661 |
|
1,0 |
0,617 |
0,620 |
|
2,0 |
0,756 |
0,590 |
|
3,0 |
0,870 |
0,586 |
|
4,0 |
1,036 |
0,591 |
KAK+
+ A-,
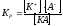 ,
то правильно записать
,
то правильно записать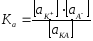 .
.
В этом уравнении принимает участие не концентрация вещества, а его активность.
В
1929 Хюккель показал, что определить
активность или коэффициент активности
в растворе отдельного иона нельзя, а
коэффициент активности можно определить
экспериментально в целом. Он равен
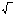 из
произведения коэффициентов активности
катиона и аниона.
из
произведения коэффициентов активности
катиона и аниона.
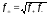 .
.
Существует
параметр, позволяющий определить
коэффициент активности, который называют
ионной силой раствора
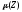 :
:
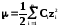 ,
,
Сi – молярная концентрация i-того иона, а zi– его заряд.
[] = мольл–1кул2
Физический смысл ионной силы раствора: она характеризует суммарную величину электрического поля, образованного всеми ионами раствора, на произвольно выбранный ион в этом растворе.
Задача:
Вычислить ионную силу раствора, в 1 литре которого находится 0,1 моль Ba(NO3)2 и 0,2 моль KCl.
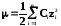 ,
,
Ba(NO3)2
Ba2++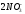 ;
KCl
K+
+ Cl-
;
KCl
K+
+ Cl-
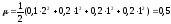 .
.
Если ионная сила находится в пределах 0,6 – 0,8 – это растворы средней концентрации, если менее 0,6 – разбавленные, если более 0,8 – концентрированные.
Ионная сила раствора позволяет определить коэффициент активности. В разбавленных растворах с концентрацией C 10-3 моль/л Дебай предложил уравнение:
В
общем виде:
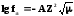 ,Z
– заряд иона, В – коэффициент (из
таблицы), при 250С
он равен 0,5. При более высоких или низких
температурах коэффициент может меняться.
,Z
– заряд иона, В – коэффициент (из
таблицы), при 250С
он равен 0,5. При более высоких или низких
температурах коэффициент может меняться.
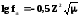 Первое
приближение Дебая для разб. растворов.
Первое
приближение Дебая для разб. растворов.
Для растворов средней силы им предложено второе приближение (концентрация более 10-2 моль/л.:
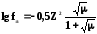 Второе
приближение Дебая.
Второе
приближение Дебая.
Для еще более концентрированных растворов (С510–2 моль/л) Дэвис вывел уравнение:
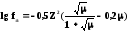 -
уравнение Дэвиса.
-
уравнение Дэвиса.
Задача. Рассчитать ионную силу и концентрацию ионов в 0,5 М растворе BaCl2.
BaCl2 Ba+ + 2Cl-
= ½ (0,5∙22 + 1∙12) = 1,5.
Рассчитать коэффициент активности и активность ионов.
С(Zn(NO3)2 = 0,05 M. Используя первое и второе приближение Дебая, получим:
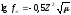 и
и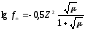 .
.
Zn(NO3)2
Zn 2+
+
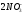
= ½ (0,05∙22
+
0,1∙12)
= 0,15.
= ½ (0,05∙22
+
0,1∙12)
= 0,15.
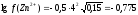
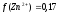
а (Zn2+) = 0,17∙0,05 = 0,0085.
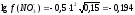 ;
;
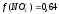 ;
;
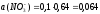 ;
;
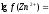
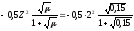 .
. 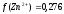 ;
;
а (Zn2+) = 0,276∙0,05 = 0,014.
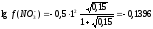 ;
; 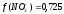 ;
;
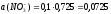 .
.
Исходя из методов Дебая, коэффициент активности не зависит от природы ионов, т.к. в этих уравнениях используется заряд ионов и ионная сила, связанная с концентрацией. Таким образом, эти уравнения не учитывают природу ионов.
Ионное произведение воды. Водородный показатель. Шкала рН и рОН.
Одним из наиболее часто используемых растворителей является вода, поэтому при различных расчетах используется ионное произведение воды.
Вода является очень слабым электролитом, но тем не менее ее молекулы также диссоциируют на ионы. Рассмотрим обратимую реакцию (реакция автопротолиза воды):
НОН Н+ + ОН- или НОН + НОН = Н3О+ + ОН-
Н3О+ - ион гидроксония.
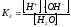 или
или
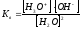 ; Кд
= 1,86∙10-16.
; Кд
= 1,86∙10-16.
Найдем ионное произведение воды.
[Н+][ОН-]= KW= Kд[НОН]; [HOH] = 1000/18 =55,5 моль/л.
[Н+][ОН-]= 1,86∙10-16 ∙55,5=10-14.
[Н+][ОН-]= 10-14
lg[H+] + lg[ОН] = -14
-lg[H+] - lg[ОН] = 14
Отрицательный логарифм некоторой величины М в химии принято обозначать рМ, где М – концентрация тех или иных ионов без указания их заряда, некая константа и т. д.
рН + рОН = 14.
В чистой воде, не содержащей растворенных веществ, [H+] = [ОН].
[Н+] = [ОН-] = 10-7; [H+]2 = 1014; [H+] = 107 и рН = 7.
рН – называют «водородным показателем». Зная рН раствора, легко найти его рОН и наоборот.
Тогда. Следовательно в водных растворах для нейтральной среды рН = 7. Тогда шкала рН в водных средах имеет вид
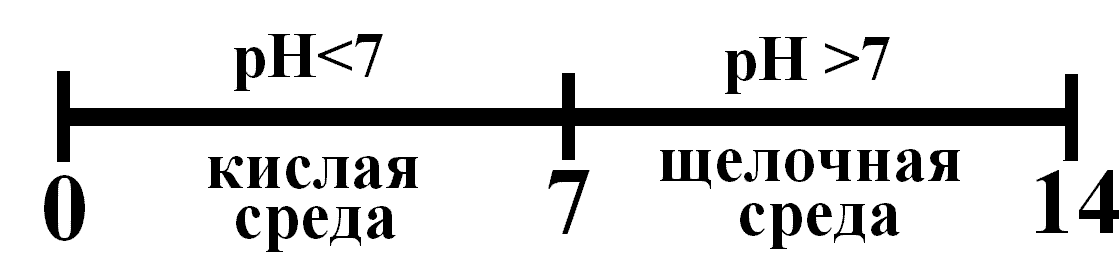
Рис. Шкала рН в водных растворах.
Это не значит, что рН кислых растворов не может быть меньше нуля, а щелочных – больше 14. Возможно и то, и другое. В сильнокислых средах рН < 0, в щелочных – рН > 14.
Если растворитель – этиловый спирт то
2 С2Н5ОН С2Н5ОН2+ + С2Н5О-
этаксоний-ион этаксил-ион
Кд
=
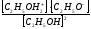 .
.
Ионное произведение сольвата [С2Н5ОН2+][С2Н5О-] = 10-19.
[С2Н5ОН2+]
= [С2Н5О-]
=
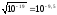
0______ _____9,5____ ______19.
Если в качестве растворителя используется аммиак, то
2
NH3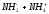 .
.
KS = 10-33
0______ _____16,5____ ______33.