
- •Свойства растворов и гетерогенных систем
- •1.Общая характеристика. Концентрация растворов
- •Способы выражения концентрации растворов. Важной характеристикой растворов является концентрация.
- •2. Растворимость
- •3. Коллигативные свойства растворов
- •1) Повышение температуры кипения раствора пропорционально количеству молей растворенного вещества при условии, что количество молей растворителя постоянно:
- •Электрическая проводимость водных растворов. Электролиты
- •Теория сильных электролитов.
- •Роль рН в биологических жидкостях организма
- •Буферные растворы
- •Гидролиз солей
- •Закон действия масс в гетерогенных системах. Растворимость плохорастворимых электролитов.
Лекция № 2
Свойства растворов и гетерогенных систем
1.Общая характеристика. Концентрация растворов
Растворы имеют огромное значение в медицине:
Химические превращения, протекающие в животных, растительных организмах, осуществляются в растворах
Внутренняя среда организма: кровь, лимфа, слюна, различные тканевые жидкости – растворы
Природная, минеральная, питьевая воды – растворы
Многие лекарственные формы, также – растворы (настойка йода, нашатырный спирт, растворы глюкозы, соляной кислоты и др).
Растворами называются фазы переменного состава.
Растворы – это однородные смеси молекул, атомов или ионов веществ, между которыми имеется физическое, а нередко и химическое взаимодействие.
На химическое взаимодействие указывает гидратная теория Д.И. Менделеева. Доказательством химического взаимодействия в растворах являются тепловые эффекты при растворении и образование гидратированных соединений.
Простые составные части, смешением которых образуются растворы любого возможного состава называют компонентами раствора.
Деление компонентов на растворитель и растворенное вещество является достаточно условным. Растворителем обычно называют компонент, находящийся в избытке по сравнению с другими компонентами, либо это жидкий компонент, если остальные компоненты – газы или твердые вещества. Растворитель обычно называют первым компонентом, а растворенное вещество – вторым, третьим и т.д.
Важнейшей характеристикой раствора является его состав. Состав раствора можно выразить через массовые, oбъeмные, молярные и другие количества компонентов.
Способы выражения концентрации растворов. Важной характеристикой растворов является концентрация.
Концентрацией раствора называется количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя.
Массовая доля компонента (i) - это отношение массы данного компонента к массе раствора, которая в процентах определяется соотношением:
 ,
,
где
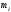 - масса растворенного вещества, а
- масса растворенного вещества, а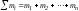 - суммарная масса всех компонентов
раствора.
- суммарная масса всех компонентов
раствора.
Мольность(Сi) определяется числом моль вещества в единице объема раствора. В системе СИ она выражается в моль/м3.
Молярная концентрация или молярность(СМ) равна числу моль растворенного вещества, содержащихся в 1 л раствора. Раствор, содержащий в 1 л 1 моль растворенного вещества, называется одномолярным или молярным; 0,1 моль—децимолярным (0,1 М раствор); 0,01 моль — сантимолярным и т. д.
Эквивалентная концентрация или нормальность (СН) равна числу моль-эквивалентов растворенного вещества, содержащихся в 1 л раствора. Раствор называется однонормальным, или нормальным, если в 1 л его содержится 1 моль-экв растворенного вещества (1 н раствор); полунормальным, если он содержит 0,5 моль-экв в 1 л (0,5 н раствор) и т. д.
Моляльная концентрация или моляльность (Сm) равна числу моль растворенного вещества в 1000 г растворителя. Если раствор состоит только из растворенного вещества и растворителя, моляльность растворенного вещества обозначают Сm,2. Ее можно рассчитать по формуле
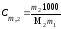 ,
,
где
m1
и m2
– массы растворителя и растворенного
вещества соответственно, М2-
молярная масса растворенного вещества.
Так как количество вещества в молях
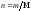 ,
то
,
то
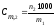 ,
,
где n2 – количество моль растворенного вещества в m1граммах растворителя.
Мольной
долей
(хi)
компонента называется число молей
компонента, приходящихся на один моль
раствора. Мольная доля i-го
компонента равна отношению числа молей
i-го
компонента
(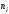 )
к сумме чисел молей всех компонентов в
растворе (
)
к сумме чисел молей всех компонентов в
растворе (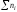 )
и определяется соотношением:
)
и определяется соотношением:
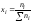 ,
,
где
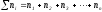
Если раствор состоит только из растворенного вещества и растворителя, мольную долю растворенного вещества обозначают х2, а растворителя – х1. При любом количестве компонентов раствора сумма мольных долей всех компонентов равна 1:
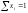 ,
,
тогда
для бинарного раствора

Растворы представляют собой дисперсные системы, в которых частицы одного вещества равномерно распределены в другом. Свойства дисперсных систем, в первую очередь их устойчивость, зависят от размеров распределенных частиц. В зависимости от степени дисперсности различают взвеси, коллоиды и истинные растворы.
Частицы взвесей имеют обычно размер 10-3 —10-5 см. Их характерной особенностью является неустойчивость во времени: взвешенные частицы (диспергированная фаза) либо оседают, либо всплывают на поверхность в зависимости от соотношения плотностей. Если распределенное вещество находится в виде отдельных молекул, система является устойчивой и не разделяется при длительном стоянии. Такие растворы называют истинными или молекулярными. Промежуточными между истинными растворами и взвесями являются коллоидные растворы. Размеры частиц коллоидных растворов лежат в интервале 10-5 – 10-7 см, а истинных — менее 10-7 см.
