- •6.2.2.3. Характеристика отдельных видов лейкоцитов
- •6.2.1.2. Цветовой показатель
- •6.2.2.1. Физиологические лейкоцитозы. Лейкопении
- •6.2.2.2. Лейкоцитарная формула
- •6.2.2.3. Характеристика отдельных видов лейкоцитов
- •6.4.1. Сосудисто-тромбоцитарный гемостаз
- •1. Условия образования отрицательного плеврального давления, его изменения во время вдоха и выдоха. Модель Дондерса.
- •2. Альвеолярный воздух, его объём, процентный состав, парциальное давление кислорода и углекислого газа. Механизм поддержания постоянства состава альвеолярного воздуха.
- •3.Легочные объемы и емкости. Методы определения. Минутный объем дыхания и легочной вентиляции в покое и при физической нагрузке.
- •4.Газообмен в легких. Процентное содержание и парциальное давление кислорода и углекислого газа в альвеолярном воздухе. Напряжение газов в артериальной и венозной крови.
- •Напряжение дыхательных газов в артериальной и венозной крови легочных капилляров
- •5.Транспорт кислорода кровью, кривая диссоциации оксигемоглобина, кислородная емкость крови.
- •6.Газообмен в тканях. Напряжение кислорода и углекислого газа в артериальной, венозной крови и тканевой жидкости.
- •Напряжение дыхательных газов в артериальной и венозной крови легочных капилляров
- •7. Транспорт угольной кислоты кровью.
- •8.Дыхательный центр: современные представления о его структуре и функции.
- •9.Рефлекторная саморегуляция дыхания. Механизмы, обеспечивающие дыхательный цикл.
- •10.Дыхание в условиях пониженного и повышенного атмосферного давления, механизмы адаптации.
- •Пищеварение
- •Жевание
- •Глотание
- •Эвакуация содержимого желудка в двенадцатиперстную кишку
- •1 Вопрос.?????? 2 вопрос.
- •3 Вопрос.
- •4 Вопрос.
- •5 Вопрос.
- •6 Вопрос и 7 вопрос.
- •8 Вопрос и 9 вопрос
- •10 Вопрос.
- •12 Вопрос
- •13 Вопрос.
- •Физиология сенсорных систем
- •2.Классификация и свойства рецепторов. Механизмы возбуждения первично- и вторичночувствующих рецепторов.
- •3.Вкусовая система: рецепторный, проводниковый и корковый отделы. Механизмы восприятия вкуса. Методы исследования вкусовой системы.
- •4.Обонятельная система: рецепторы, их локализация, механизм восприятия запахов, проводниковый и корковый отделы.
- •6.Соматосенсорная система: рецепторный, проводниковый и корковый отделы. Кожная чувствительность (тактильная, температурная). Проприорецепция.
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
6.4.1. Сосудисто-тромбоцитарный гемостаз
Сосудисто-тромбоцитарный гемостаз сводится к образованию тромбоцитарной пробки, или тромбоцитарного тромба. Условно его разделяют на три стадии: 1) временный (первичный) спазм сосудов; 2) образование тромбоцитарной пробки за счет адгезии (прикрепления к поврежденной поверхности) и агрегации (склеивания между собой) тромбоцитов; 3) ретракция (сокращение и уплотнение) тромбоцитарной пробки.
Сразу после травмы наблюдается первичный спазм кровеносных сосудов, благодаря чему кровотечение в первые секунды может не возникнуть или носит ограниченный характер. Первичный спазм сосудов обусловлен выбросом в кровь в ответ на болевое раздражение адреналина и норадреналина и длится не более 10—15 с. В дальнейшем наступает вторичный спазм, обусловленный активацией тромбоцитов и отдачей в кровь сосудосуживающих агентов — серотонина, ТхА2, адреналина и др.
Повреждение сосудов сопровождается немедленной активацией тромбоцитов, что обусловлено появлением высоких концентраций АДФ (из разрушающихся эритроцитов и травмированных сосудов), а также с обнажением субэндотелия, коллагеновых и фибриллярных структур. В результате «раскрываются» вторичные рецепторы и создаются оптимальные условия для адгезии, агрегации и образования тромбоцитарной пробки.
Адгезия обусловлена наличием в плазме и тромбоцитах особого белка — фактора Виллебранда (FW), имеющего три активных центра, два из которых связываются с экспрессированными рецепторами тромбоцитов, а один — с рецепторами субэндотелия и коллагеновых волокон. Таким образом, тромбоцит с помощью FW оказывается «подвешенным» к травмированной поверхности сосуда.
Одновременно с адгезией наступает агрегация тромбоцитов, осуществляемая с помощью фибриногена — белка, содержащегося в плазме и тромбоцитах и образующего между ними связующие мостики, что и приводит к появлению тромбоцитарной пробки.
Важную роль в адгезии и агрегации играет комплекс белков и полипептидов, получивших наименование «интегрины». Последние служат связующими агентами между отдельными тромбоцитами (при склеивании друг с другом) и структурами поврежденного сосуда. Агрегация тромбоцитов может носить обратимый характер (вслед за агрегацией наступает дезагрегация, т. е. распад агрегатов), что зависит от недостаточной дозы агрегирующего (активирующего) агента.
Из тромбоцитов, подвергшихся адгезии и агрегации, усиленно секретируются гранулы и содержащиеся в них биологически активные соединения — АДФ, адреналин, норадреналин, фактор Р4, ТхА2 и др. (этот процесс получил название реакции высвобождения), что приводит к вторичной, необратимой агрегации. Одновременно с высвобождением тромбоцитарных факторов происходит образованием тромбина, резко усиливающего агрегацию и приводящего к появлению сети фибрина, в которой застревают отдельные эритроциты и лейкоциты.
Благодаря контрактильному белку тромбостенину тромбоциты подтягиваются друг к другу, тромбоцитарная пробка сокращается и уплотняется, т. е. наступает ее ретракция.
В норме остановка кровотечения из мелких сосудов занимает 2—4 мин.
Важную роль для сосудисто-тромбоцитарного гемостаза играют производные арахидоновой кислоты — простагландин I2 (PgI2), или простациклин, и ТхА2. При сохранении целости эндотелиального покрова действие Pgl преобладает над ТхА2, благодаря чему в сосудистом русле не наблюдается адгезии и агрегации тромбоцитов. При повреждении эндотелия в месте травмы синтез Pgl не происходит, и тогда проявляется влияние ТхА2, приводящее к образованию тромбоцитарной пробки.
Гемостаз коагуляционный:
В процессе вторичного гемостаза на основе тромбоцитного агрегата формируется сгусток крови , который на завершающей стадии гемостаза подвергается самопроизвольному сжатию ( ретракция сгустка крови . Таким образом, первичная или временная гемостатическая пробка , представляющая собой рыхлый тромбоцитный агрегат, превращается во вторичную или окончательную гемостатическую пробку, в которой тромбоцитный агрегат консолидируется фибрином и подвергается дополнительному уплотнению в процессе спонтанного сокращения сгустка крови. Вторичный или окончательный гемостаз обеспечивает полную остановку кровотечения из вен, артериол и артерий. Коагуляционный (вторичный) гемостаз, или свертывание крови, протекает в течение нескольких минут и представляет собой каскад реакций между плазменными белками , заканчивающийся образованием нитей фибрина . Благодаря этому останавливается кровотечение из крупных сосудов и предотвращается их возобновление через несколько часов или суток. Одновременно с образованием тромбоцитарного тромба активируются факторы свертывания и запускается коагуляционный гемостаз .
Противосвёртывающая система крови. Первичные и вторичные антикоагулянты, фибринолитическая система. Метод определения скорости свёртывания крови.
Противосвертываюшая система принимает участие в регуляции системы свертывания крови, способствует сохранению жидкостного состояния крови при циркуляции и предупреждает переход локального тромбообразования в слишком распространенное или диффузное свертывание.
Все антикоагулянты, образующиеся в организме, разделяют на две группы:
Антикоагулянты прямого действия — самостоятельно синтезированные (гепарин, антитромбин III — AT-III, протеин С, протеин S, а2-макроглобулин):;
Антикоагулянты непрямого действия — образующиеся во время свертывания крови, фибринолиза и активации других протеолитических систем (фибрин-антитромбин I, антитромбин IV, ингибиторы факторов VIII, IX и др.)- Простациклин, который выделяется эндотелием сосудов, ингибирует адгезию и агрегацию эритроцитов и тромбоцитов.
Главный ингибитор свертывающей системы — AT-III, который инактивирует тромбин (фактор На) и другие факторы свертывания крови (1Ха, Ха, 1Ха).
Важнейший антикоагулянт — гепарин; он активирует AT-III, а также сдерживает образование кровяного тромбопластина, угнетает преобразование фибриногена в фибрин, блокирует воздействие серотонина на гистамин и др. .
При состояниях, сопровождающихся гиперкоагуляцией и нарушением гемостаза, могут быть применены следующие группы препаратов, отличающиеся по механизму влияния на отдельные звенья системы гомеостаза.
Фибринолитическая система
Эта система разрушает фибрин. Основным компонентом ее является плазмин (фибринолизин), который образуется из плазминогена под действием тканевого активатора плазминогена (ТАП).
Плазмин расщепляет фибрин на отдельные фрагменты - продукты деградации фибрина (ПДФ).
В дальнейшем тромб, остановивший кровотечение, подвергается ретракции (сжатию) и лизису (растворению).
Патологическое тромбообразование в сосудах мозга, коронарных артериях нередко приводит к инсульту, инфаркту миокарда.
Тромбоз вен нижних конечностей может осложниться отрывом тромба и занесением его током крови в сосудистую систему легких - тромбоэмболией легочной артерии (ТЭЛА).
Для распознавания нарушений в системе свертывания крови существует различные лабораторные методы исследования.
Факторы свертывания крови (плазменные)Фактор Название фактора Свойства и функции
I Фибриноген Белок. Под влиянием тромбина превращается в фибрин I
II Протромбин Белок. Синтезируется в печени при участии витамина К
III Тромбопластин (тромбокиназа) Протеолитический фермент. Превращает протромбин в тромбин
IV Ионы кальция Потенцируют большинство факторов свертывания крови
V Проакцелерин Потенцирует превращение протромбина в тромбин I
VI Акцелерин Потенцирует превращение протромбина в тромбин I
VII Проконвертин Синтезируется в печени при участии витамина К. Активирует тканевой тромбопластин
VIII Антигемофильный глобулин А Участвует в образовании тканевого тромбопластина
IX Фактор Кристмаса Участвует в образовании тканевого тромбопластина
X Фактор Стюарта -Прауэра (тромботропин) Участвует в образовании тромбина, кровяного и тканевого тромбопластина
XI Предшественник плазменного тромбопластина Участвует в образовании плазменного тромбопластина
XII Фактор Хагемана (фактор контакта) Начинает и локализует тромбообразование
XIII Фибринстабилизирующий фактор Переводит нестабильный фибрин в стабильный I
Определение времени свертывания цельной нестабилизированной крови проводится непосредственно у постели больного.
1.2 Метод Моравица
В клинике до сих пор используется еще один упрощенный метод определения времени свертывания крови. Он применяется, в основном, для динамического контроля за состоянием гемокоагуляции при лечении прямыми антикоагулянтами.
На предметное стекло наносят каплю крови, взятую из пальца или мочки уха. Включив секундомер, каждые 20–30 с в каплю крови опускают тонкий стеклянный капилляр. Время свертывания определяют в момент появления первой тонкой нити фибрина при вытягивании капилляра из капли крови.
В норме свертывание крови составляет около 5 мин.
Общие свойства возбудимых тканей
Вопрос №1
Сравнительная характеристика нервной и гуморальной регуляций физиологических функций.
Нервная регуляция, координирующее влияние нервной системы (НС) на клетки, ткани и органы, приводящее их деятельность в соответствие с потребностями организма и изменениями окружающей среды; один из основных механизмов саморегуляции функций. Многоклеточный организм в своих жизненных проявлениях (рост, развитие, реакции на внешние воздействия и т.п.) выступает как единое целое. Эта целостность обеспечивается рядом регуляторных механизмов, среди которых ведущее значение у животных приобрела Н. р. Вследствие Н. р. деятельность клеток и органов может инициироваться, прекращаться, усиливаться, ослабляться; могут меняться функциональное и биохимическое состояние клеток и органов, особенности их строения. У многоклеточных, не имеющих НС (растения, зародыши животных, губки), упорядоченность функций обеспечивается межклеточными взаимодействиями — ионными, метаболическими и др. Деятельность одних клеток может регулироваться продуктами обмена веществ др. клеток. Возникшее в какой-либо из клеток возбуждённое состояние поверхностной мембраны может иногда распространяться, охватывая клетку за клеткой (так называемое нейроидное проведение — процесс, по ионному механизму схожий с проведением импульса нервного). На этой основе в ходе эволюции животных развились 2 основных координирующих механизма — Н. р. и гормональная регуляция. Соответственно различают 2 рода веществ-посредников — медиаторы, и гормоны. Гормон разносится по организму, поступая в кровь; вследствие этого гормональная регуляция осуществляется медленно и широко адресована. В противоположность этому, Н. р. может быть быстрой и локальной. Это обеспечивается тем, что при Н. р. медиатор выделяется из нервных окончаний прямо на иннервированные клетки, а также тем, что выделение медиатора вызывается быстро распространяющимся сигналом — нервным импульсом. Между Н. р. и гормональной регуляцией нет резкой границы, некоторые нервные окончания выделяют активные вещества в кровь (см. Нейросекреция). Быстрота и адресованность Н. р. особенно важны при регуляции движений, поэтому НС хорошо развита у организмов с совершенной локомоцией. Становясь в процессе эволюции ведущим регуляторным механизмом, Н. р. у высших животных охватывает не только двигательную сферу, но и все др. системы организма. Под нервным контролем находятся как исполнительные (эффекторные), так и чувствительные (рецепторные) органы и клетки, а также все вегетативные функции. Н. р. распространяется и на ткани, обеспечивающие метаболические потребности организма (например, жировая ткань). Чтобы медиатор мог подействовать на клетку, она должна быть чувствительной к нему, т. е. иметь соответствующие рецепторы. Так, в скелетной мышце позвоночных на поверхности каждого мышечного волокна расположены так называемые холинорецепторы, которые вступают во взаимодействие с медиатором двигательных нервных окончаний — ацетилхолином (см. Двигательная бляшка). В результате реакции между медиатором и рецептором меняется ионная проницаемость поверхностной мембраны иннервированной клетки. При этом изменяются ионный состав цитоплазмы и мембранный потенциал, вследствие чего специфическая деятельность клетки усиливается или угнетается (см. Мембранная теория возбуждения). По-видимому, в некоторых случаях медиатор может оказывать прямое, не опосредованное ионами, влияние на процессы обмена веществ клетки (энзимо-химическая гипотеза нервного возбуждения, выдвинутая Х. С. Коштоянцем в 1950). Менее ясна роль медиаторов в осуществлении воздействий НС на рост и дифференцировку органов и тканей, процессы регенерации, поддержание определённого функционального и биохимического состояния иннервируемых клеток (трофическая функция НС; см. Трофика нервная). Возможно, при этих формах Н. р. имеют значение белки и др. вещества, которые выделяются из нервного окончания одновременно с медиатором
Гуморальная регуляция
Координация физиологических и биохимических процессов, осуществляемая через жидкие среды организма (кровь, лимфу, тканевую жидкость) с помощью биологически активных веществ (метаболиты, гормоны, гормоноиды ионы), выделяемых клетками, органами и тканями в процессе их жизнедеятельности. У высокоразвитых животных и человека Г. р. подчинена нервной регуляции и составляет совместно с ней единую систему нейрогуморальной регуляции. Продукты обмена веществ действуют не только непосредственно на эффекторные органы, но и на окончания чувствительных нервов (хеморецепторы) и нервные центры, вызывая гуморальным или рефлекторным путём те или иные реакции. Так, если в результате усиленной физической работы в крови увеличивается содержание CO2, то это вызывает возбуждение дыхательного центра, что ведёт к усилению дыхания и выведению из организма излишков CO2. Гуморальная передача нервных импульсов химическими веществами, т. н. медиаторами, осуществляется в центральной и периферической нервной системе. Наряду с гормонами важную роль в Г. р. играют продукты межуточного обмена. Биологическую активность жидких сред организма обусловлена соотношением содержания катехоламинов (адреналина и норадреналина, их предшественников и продуктов распада), ацетилхолина, гистамина, серотонина и др. аминов биогенных, некоторых полипептидов и аминокислот, состоянием ферментных систем, присутствием активаторов и ингибиторов, содержанием ионов, микроэлементов и т. д. Учение о Г. р. разработано рядом отечественных
Вопрос №2
Рефлекторный принцип регуляции функций. Его развитие в трудах Сеченова, Павлова, Анохина. Строение рефлектроной дуги соматического и вегетативного рефлексов.
Рефлекторный принцип регуляции функций
Основное положение рефлекторной теории заключается в утверждении, что деятельность организма есть закономерная рефлекторная реакция на стимул. Узловым моментом развития рефлекторной теории следует считать классический труд И. М. Сеченова (1863) «Рефлексы головного мозга», в котором впервые был провозглашен тезис о том, что все виды сознательной и бессознательной жизни человека представляют собой рефлекторные реакции. Рефлекс как универсальная форма взаимодействия организма и среды есть реакция организма, возникающая на раздражение рецепторов и осуществляемая с участием центральной нервной системы.
В естественных условиях рефлекторная реакция происходит при пороговом, надпороговом раздражении входа рефлекторной дуги — рецептивного поля данного рефлекса. Рецептивным полем называется определенный участок воспринимающей чувствительной поверхности организма с расположенными здесь рецепторными клетками, раздражение которых инициирует, запускает рефлекторную реакцию. Рецептивные поля разных рефлексов имеют определенную локализацию, рецепторные клетки — соответствующую специализацию для оптимального восприятия адекватных раздражителей (например, фоторецепторы располагаются в сетчатке; волосковые слуховые рецепторы — в спиральном (кортиевом) органе; проприорецепторы — в мышцах, в сухожилиях, в суставных полостях; вкусовые рецепторы на поверхности языка; обонятельные — в слизистой оболочке носовых ходов; болевые, температурные, тактильные рецепторы в коже и т. д.
Структурной основой рефлекса является рефлекторная дуга — последовательно соединенная цепочка нервных клеток, обеспечивающая осуществление реакции, или ответа, на раздражение. Рефлекторная дуга состоит из афферентного, центрального и эфферентного звеньев, связанных между собой синаптическими соединениями (рис. 4.1). Афферентная часть дуги начинается рецепторными образованиями, назначение которых заключается в трансформации энергии внешних раздражений в энергию нервного импульса, поступающего по афферентному звену дуги рефлекса в центральную нервную систему.
В зависимости от сложности структуры рефлекторной дуги различают моно- и полисинаптические рефлексы. В простейшем случае импульсы, поступающие в центральные нервные структуры по афферентным путям, переключаются непосредственно на эфферентную нервную клетку, т. е. в системе рефлекторной дуги имеется одно синаптическое соединение. Такая рефлекторная дуга называется моносинаптической (например, рефлекторная дуга сухожильного рефлекса в ответ на растяжение). Наличие в структуре рефлекторной дуги двух и более синаптических переключений (т. е. три и более нейронов), позволяет характеризовать ее как полисинаптическую.
Рефлекторная дуга - это путь, по которому раздражение (сигнал) от рецептора проходит к исполнительному органу. Структурную основу рефлекторной дуги образуют нейронные цепи, состоящие из рецепторных, вставочных и эффекторных нейронов. Именно эти нейроны и их отростки образуют путь, по которому нервные импульсы от рецептора передаются исполнительному органу при осуществлении любого рефлекса.
В периферической нервной системе различают рефлекторные дуги (нейронные цепи)
соматической нервной системы, иннервирующие скелетную иускулатуру
вегетативной нервной системы, иннервирующие внутренние органы: сердце, желудок, кишечник, почки, печень и т.д.
Рефлекторная дуга состоит из пяти отделов:
рецепторов, воспринимающих раздражение и отвечающих на него возбуждением. Рецепторами могут быть окончания длинных отростков центростремительных нервов или различной формы микроскопические тельца из эпителиальных клеток, на которых оканчиваются отростки нейронов. Рецепторы расположены в коже, во всех внутренних органах, скопления рецепторов образуют органы чувств (глаз, ухо и т. д.).
чувствительного (центростремительного, афферентного) нервного волокна, передающего возбуждение к центру; нейрон, имеющий данное волокно, также называется чувствительным. Тела чувствительных нейронов находятся за пределами центральной нервной системы - в нервных узлах вдоль спинного мозга и возле головного мозга.
нервного центра, где происходит переключение возбуждения с чувствительных нейронов на двигательные; Центры большинства двигательных рефлексов находятся в спинном мозге. В головном мозге расположены центры сложных рефлексов, таких, как защитный, пищевой, ориентировочный и т. д. В нервном центре происходит синаптическое соединение чувствительного и двигательного нейрона.
двигательного (центробежного, эфферентного) нервного волокна, несущего возбуждение от центральной нервной системы к рабочему органу; Центробежное волокно - длинный отросток двигательного нейрона. Двигательным называется нейрон, отросток которого подходит к рабочему органу и передает ему сигнал из центра.
эффектора - рабочего органа, который осуществляет эффект, реакцию в ответ на раздражение рецептора. Эффекторами могут быть мышцы, сокращающиеся при поступлении к ним возбуждения из центра, клетки железы, которые выделяют сок под влиянием нервного возбуждения, или другие органы.
Простейшую рефлекторную дугу можно схематически представить как образованную всего двумя нейронами: рецепторным и эффекторным, между которыми имеется один синапс. Такую рефлекторную дугу называют двунейронной и моносинаптической. Моносинаптические рефлекторные дуги встречаются весьма редко. Примером их может служить дуга миотатического рефлекса.
В большинстве случаев рефлекторные дуги включают не два, а большее число нейронов: рецепторный, один или несколько вставочных и эффекторный. Такие рефлекторные дуги называют многонейронными и полисинаптическими. Примером полисинаптической рефлекторной дуги является рефлекс отдергивания конечности в ответ на болевое раздражение.
Рефлекторная дуга соматической нервной системы на пути от ЦНС к скелетной мышце нигде не прерывается в отличии от рефлекторной дуги вегетативной нервной системы, которая на пути от ЦНС к иннервируемому органу обязательно прерывается с образованием синапса - вегетативного ганглия.
Вегетативные ганглии, в зависимости от локализации, могут быть разделены на три группы:
позвоночные (вертебральные) ганглии - относятся к симпатической нервной системе. Они расположены по обе стороны позвоночника, образуя два пограничных ствола (их еще называют симпатическими цепочками)
предпозвоночные (превертебральные) ганглии располагаются на большем расстояни от позвоночника, вместе с тем они находятся в некотором отдалении и от иннервируемых ими органов. К числу превертебральных ганглиев относят ресничный узел, верхний и средний шейный симпатические узлы, солнечное сплетение, верхний и нижний брыжеечные узлы.
внутриорганные ганглии расположены во внутренних органах: в мышечных стенках сердца, бронхов, средней и нижней трети пищевода, желудка, кишечника, желчного пузыря, мочевого пузыря, а также в железах внешней и внутренней секреции. На клетках этих ганглий прерываются парасимпатические волокна.
Такое различие соматической и вегетативной рефлекторной дуги обусловлено анатомическим строением нервных волокон, составляющих нейронную цепь, и скоростью проведения по ним нервного импульса.
Для осуществления любого рефлекса необходима целостность всех звеньев рефлекторной дуги. Нарушение хотя бы одного из них ведет к исчезновению рефлекса.
Вопрос №3
Современные представления о строении и функции клеточных мембран и процессах транспорта веществ через клеточные мембраны. Виды ионных каналов, их свойства; активный и пассивный транспорт.
Кле́точная мембра́на (или цитолемма, или плазмалемма, или плазматическая мембрана) отделяет содержимое любой клетки от внешней среды, обеспечивая ее целостность; регулируют обмен между клеткой и средой; внутриклеточные мембраны разделяют клетку на специализированные замкнутые отсеки — компартменты или органеллы, в которых поддерживаются определенные условия внутриклеточной среды.
Клеточная стенка, если таковая у клетки имеется (обычно есть у растительных клеток), покрывает клеточную мембрану.
Клеточная мембрана представляет собой двойной слой (бислой) молекул класса липидов, большинство из которых представляет собой так называемые сложные липиды — фосфолипиды. Молекулы липидов имеют гидрофильную («головка») и гидрофобную («хвост») часть. При образовании мембран гидрофобные участки молекул оказываются обращены внутрь, а гидрофильные — наружу. Мембраны — структуры инвариабельные, весьма сходные у разных организмов. Некоторое исключение составляют, пожалуй, археи, у которых мембраны образованы глицерином и терпеноидными спиртами. Толщина мембраны составляет 7-8 нм.
Биологическая мембрана включает и различные белки: интегральные (пронизывающие мембрану насквозь), полуинтегральные (погруженные одним концом во внешний или внутренний липидный слой), поверхностные (расположенные на внешней или прилегающие к внутренней сторонам мембраны). Некоторые белки являются точками контакта клеточной мембраны с цитоскелетом внутри клетки, и клеточной стенкой (если она есть) снаружи. Некоторые из интегральных белков выполняют функцию ионных каналов, различных транспортеров и рецепторов.
Функции биомембран
барьерная — обеспечивает регулируемый, избирательный, пассивный и активный обмен веществ с окружающей средой. Например, мембрана пероксисом защищает цитоплазму от опасных для клетки пероксидов. Избирательная проницаемость означает, что проницаемость мембраны для различных атомов или молекул зависит от их размеров, электрического заряда и химических свойств. Избирательная проницаемость обеспечивает отделение клетки и клеточных компартментов от окружающей среды и снабжение их необходимыми веществами.
транспортная — через мембрану происходит транспорт веществ в клетку и из клетки. Транспорт через мембраны обеспечивает: доставку питательных веществ, удаление конечных продуктов обмена, секрецию различных веществ, создание ионных градиентов, поддержание в клетке соответствующего pH и ионной концентрации, которые нужны для работы клеточных ферментов.
Частицы, по какой-либо причине не способные пересечь фосфолипидный бислой (например, из-за гидрофильных свойств, так как мембрана внутри гидрофобна и не пропускает гидрофильные вещества, или из-за крупных размеров), но необходимые для клетки, могут проникнуть сквозь мембрану через специальные белки-переносчики (транспортеры) и белки-каналы или путем эндоцитоза.
При пассивном транспорте вещества пересекают липидный бислой без затрат энергии, путем диффузии. Вариантом этого механизма является облегчённая диффузия, при которой веществу помогает пройти через мембрану какая-либо специфическая молекула. У этой молекулы может быть канал, пропускающий вещества только одного типа.
Типы ионных каналов
Наиболее часто встречаются два типа каналов: ионные каналы с лиганд-зависимыми воротами (находятся,в частности, в постсинаптической мембране нервно-мышечных соединений) и ионные каналы с потенциал-зависимыми воротами. Лиганд-зависимые каналы превращают химические сигналы, приходящие к клетке, в электрические; они необходимы, в частности, для работы химических синапсов. Потенциал-зависимые каналы нужны для распространения потенциала действия.
Работа ионных каналов
Лиганд-зависимые ионные каналы
Эти каналы открываются, когда медиатор, связываясь с их наружними сторонами, меняет их конформацию. Открываясь, они впускают ионы, изменяя этим мембранный потенциал. Лиганд-зависимые каналы почти нечувствительны к изменению мембранного потенциала. Они генерируют электрический сигнал, сила которого зависит от количества медиатора, поступающего в синаптическую щель и времени, которое он там находится.
Потенциал-зависимые ионные каналы
Эти каналы отвечают за распространение потенциала действия, они открываются и закрываются в ответ на изменение мембранного потенциала. Например, натриевые каналы. Если мембранный потенциал поддерживается на уроне потенциала покоя, натриевые каналы закрыты и натриевый ток отсутствует. Если мембранный потенциал сдвигается в положительную сторону, то натриевые каналы откроются и в клетку начнут входить ионы натрия по градиенту концентрации. Через 0,5 мс после установления нового значения мембранного потенциала, этот натриевый ток достигнет максимума. А еще через несколько миллисекунд падает почти до нуля. Это значит, что каналы через некоторое время закрываются, даже если клеточная мембрана остается деполяризованной. Но закрывшись, они отличаются от состояния, в котором находились до открытия, теперь они не могут открываться в ответ на деполяризацию мембраны то есть они инактивированны. В таком состоянии они останутся до тех пор, пока мембранный потенциал не вернется к исходному значению и не пройдет восстановительный период, занимающий несколько миллисекунд.
Вопрос №4
Электрические явления в возбудимых тканях, история их открытия (Гальвани, Дюбуа-Реймон, Бренштейн, Ходжкин). Мембранный потенциал покоя, его происхождение.
Основным свойством живых клеток является раздражимость, т. е. их способность реагировать изменением обмена веществ в ответ на действие раздражителей. Возбудимость — свойство клеток отвечать на раздражение возбуждением. К возбудимым относят нервные, мышечные и некоторые секреторные клетки. Возбуждение — ответ ткани на ее раздражение, проявляющийся в специфической для нее функции (проведение возбуждения нервной тканью, сокращение мышцы, секреция железы) и неспецифических реакциях (генерация потенциала действия, метаболические изменения).
Одним из важных свойств живых клеток является их электрическая возбудимость, т.е. способность возбуждаться в ответ на действие электрического тока. Высокая чувствительность возбудимых тканей к действию слабого электрического тока впервые была продемонстрирована Гальвани в опытах на нервно-мышечном препарате задних лапок лягушки. Если к нервно-мышечному препарату лягушки приложить две соединенные между собой пластинки из различных металлов, например медь—цинк, таким образом, что бы одна пластинка касалась мышцы, а другая — нерва, то мышца будет сокращаться (первый опыт Гальвани).
Детальный анализ результатов опытов Гальвани, проведенный А. Вольта, позволил сделать другое заключение: электрический ток возникает не в живых клетках, а в месте контакта разнородных металлов с электролитом, поскольку тканевые жидкости представляют собой раствор солей. В результате своих исследований А.Вольта создал устройство, получившее название «вольтов столб» — набор по следовательно чередующихся цинковых и серебряных пластинок, раз деленных бумагой, смоченной солевым раствором. В доказательство справедливости своей точки зрения Гальвани предложил другой опыт: набрасывать на мышцу дистальный отрезок нерва, который иннервирует эту мышцу, при этом мышца также сокращалась (второй опыт Гальвани, или опыт без металла). Отсутствие металлических про водников при проведении опыта позволило Гальвани подтвердить свою точку зрения и развить представления о «животном электричестве», т. е. электрических явлениях, возникающих в живых клетках. Окончательное доказательство существования электрических явлений в живых тканях было получено в опыте «вторичного тетануса» Маттеуччи, в котором один нервно-мышечный препарат возбуждался током, а биотоки сокращающейся мышцы раздражал нерв второго нервно-мышечного препарата.
В конце XIX века благодаря работам Л. Германа, Э. Дюбуа-Раймона, Ю. Бернштейна стало очевидно, что электрические явления, которые возникают в возбудимых тканях, обусловлены электрическими свойствами клеточных мембран.
Электрические явления в возбудимых тканях
Классификация:
Биопотенциалы - общее название всех видов электрических процессов в живых системах.
Потенциал повреждения - исторически первое понятие об электрической активности живого (демаркационный потенциал). Это разность потенциалов между неповрежденной и поврежденной поверхностями живых возбудимых тканей (мышцы, нервы). Разгадка его природы привела к созданию мембранной теории биопотенциалов.
Мембранный потенциал (МП) - это разность потенциалов между наружной и внутренней поверхностями клетки (мышечного волокна) в покое. Обычно МП, или потенциал покоя, составляет 50-80 мВ, со знаком «-» внутри клетки. При возбуждении клетки регистрируется потенциал действия (его фазы: пик, следовая негативность, следовая позитивность) - быстрое изменение мембранного потенциала во время возбуждения.
Внеклеточно-регистрируемый потенциал действия, внутриклеточно-регистрируемый потенциал действия - это варианты потенциалов действия, форма которых зависит от способа отведения (см. ниже).
Рецепторный (генераторный) потенциал - изменение МП рецепторных клеток во время их возбуждения.
Постсинаптические потенциалы (варианты: возбуждающий постсинаптический потенциал - ВПСП, тормозной постсинаптический потенциал - ТПСП, частный случай возбуждающего постсинаптического потенциала - ПКП - потенциал концевой пластинки).
Вызванный потенциал - это потенциал действия нейрона, возникающий в ответ на возбуждение рецептора, несущего информацию к этому нейрону.
История исследования физиологии возбуждения
Л. Гальвани был первым, кто убедился в существовании «живого электричества». Его первый (балконный) опыт состоял в том, что препарат задних лапок лягушек на медном крючке был подвешен к железному балкону. От ветра он задевал балконные перила, и это вызывало сокращение мышц. По Гальвани, это было результатом замыкания цепи тока, в результате чего «живое электричество» вызывало сокращение. Вольта (итальянский физик) опроверг такое объяснение. Он полагал, что сокращение обусловлено наличием «гальванической пары» - железо-медь. В ответ Гальвани поставил второй опыт (опыт без металла), который доказывал идею автора: набрасывался нерв между поврежденной и неповрежденной поверхностями мышцы и в ответ - сокращение интактной мышцы.
Дальнейшие исследования Ходжкина и Хаксли показали, что при возбуждении аксона кальмара возникает быстрое колебание мембранного потенциала, которое на экране осциллографа имело форму пика (spike). Они назвали это колебание потенциалом действия (ПД). Так как электрический ток для возбудимых мембран является адекватным раздражителем, ПД можно вызвать, поместив на наружную поверхность мембраны отрицательный электрод – катод, а внутреннюю положительный – анод. Это приведет к снижению величины заряда мембраны – ее деполяризации. При действии слабого допорогового тока происходит пассивная деполяризация, т.е. возникает катэлектротон (рис). Если силу тока увеличить до определенного предела, то в конце периода его воздействия на плато катэлектротона появится небольшой самопроизвольный подъём – местный или локальный ответ. Он является следствием открывания небольшой части натриевых каналов, находящихся под катодом. При токе пороговой силы МП снижается до критического уровня деполяризации (КУД), при котором начинается генерация потенциала действия. Он находится для нейронов примерно на уровне – 50 мВ.
Мембранный потенциал и его происхождение
МП, или потенциал покоя, - это разность потенциалов между наружной и внутренней поверхностями мембраны в условиях покоя. В среднем у клеток возбудимых тканей он достигает 50-80 мВ, со знаком «-» внутри клетки. Обусловлен преимущественно ионами калия. Как известно, в клетках возбудимых тканей концентрация ионов калия достигает 150 ммоль/л, в среде - 4-5 ммоль (ионов калия намного больше в клетке, чем в среде). Поэтому по градиенту концентрации калий может выходить из клетки, и это происходит с участием калиевых каналов, часть которых открыта в условиях покоя. В результате из-за того, что мембрана непроницаема для анионов клетки (глутамат, аспартат, органические фосфаты), на внутренней поверхности клетки образуется избыток отрицательно заряженных частиц, а на наружной - избыток положительно заряженных частиц. Возникает разность потенциалов. Чем выше концентрация калия в среде - тем меньше это отношение, тем меньше величина мембранного потенциала. Однако расчетная величина, как правило, ниже реальной. Например, по расчетам МП должен быть -90 мВ, а реально -70 мВ. Это расхождение обусловлено тем, что ионы натрия и хлора тоже вносят свой вклад в создание МП. В частности, известно, что натрия больше в среде (140 ммоль/л против 14 ммоль/л внутриклеточной). Поэтому натрий может войти в клетку. Но большая часть натриевых каналов в условиях покоя закрыта. Поэтому в клетку входит лишь небольшая часть ионов натрия. Но и этого достаточно, чтобы хотя бы частично компенсировать избыток анионов. Ионы хлора, наоборот, входят в клетку (частично) и вносят отрицательные заряды. В итоге величина мембранного потенциала определяется в основном калием, а также натрием и хлором.
Для того чтобы МП поддерживался на постоянном уровне, необходимо поддержание ионного гетсрогенитета - ионной асимметрии. Для этого, в частности, служит калий-натриевый насос (и хлорный), который восстанавливает ионную асимметрию, особенно после акта возбуждения. Доказательством калиевой природы МП является наличие зависимости: чем выше концентрация калия в среде, тем меньше величина МП. Для дальнейшего изложения важно понятие: деполяризация (уменьшение МП, например, от минус 90 мВ до минус 70 мВ) и гиперполяризация - противоположное явление.
Вопрос №5
Локальный ответ. Критический Уровень деполяризации. Сравнительная характеристика локального ответа и потенциала действия.
Критический уровень деполяризации
Величина мембранного потенциала, при достижении которой возникает потенциал действия.
Возникновению потенциала действия предшествует в точке раздражения мышцы или нерва активные под пороговые изменения мембранного потенциала. Они проявляются в форме локального (местного) ответа.
Для локального ответа характерны:
1) зависимость от силы раздражения
2) нарастание постепенно величины ответа.
3) нераспространение по нервному волокну.
Первые признаки локального ответа обнаруживаются при действии стимулов составляющих 50-70% пороговой величины. Локальный ответ как и потенциал действия обусловлен повышением натриевой проницаемости. Однако это повышение было недостаточно, чтобы вызвать потенциал действия.
Потенциал действия возникает когда деполяризация мембраны достигнет критического уровня. Но локальный ответ важен. Он подготавливает ткани к последующим воздействиям.
Амплитуда и характер временных изменений потенциала действия (пд) мало зависит от силы раз-ля. Важно чтобы это сила была определенной критической величины, которая называется раздражения или реобазой. Возникнув в месте раздражения потенциал действия распространяется по нервному или мышечному волокну, не изменяя своей амплитуды. Наличие порога раздражения и независимость амплитуды потенциала действия от силы стимула называется законом «все» или «ничего». Кроме силы раздражения важно и время действия его. Слишком короткое время действия раз-ля не приводит к возбуждению. Методически ее трудно определить. Поэтому исследователем Лапина введен термин «хронопсия». Это минимальное время необходимое для того, чтобы вызвать возбуждение ткани при силе раз-ля равной двум реобазам.
Вопрос №6
Возбуждение. Потенциал действия, его фазы, ионный механизм возникновения. Изменение возбудимости нервного волокна в различные фазы потенциала действия.
Потенциал покоя.
Когда клетка или волокно находится в состоянии покоя, ее внутренний потенциал (мембранный потенциал) варьирует от -50 до -90 милливольт и условно принимается за ноль. Наличие этого потенциала обусловлено неравенством концентраций ионов Na+,K+,Cl-,Ca2+ внутри и вне клетки, а также различной проницаемостью мембран для этих ионов. Внутри клетки калия в 30-50 раз больше, чем снаружи. При этом проницаемость мембраны невозбужденной клетки для ионов калия в 25 раз выше, чем для ионов натрия. Поэтому калий выходит из клетки наружу. В этаже время анионы цитоплазмы клетки особенно наружные хуже проходят через мембрану, концентрируются у ее поверхности, создавая «―» потенциал. Вышедшие из клетки ионы калия удерживаются у наружной поверхности мембраны электростатическим противоположным зарядом.
Это разность потенциала называется мембранным потенциалом или потенциалом покоя. Со временем при такой ситуации большинство ионов калия могли бы выйти за пределы клетки и разность концентраций их снаружи и внутри выровнялась бы, но этого не происходит, т. к. в клетке сущ-ет натрий калиевый насос. Благодаря которому осуществляется обратное поступление калия из тканевой жидкости в клетку и выделение ионов натрия против градиента концентрации (а натрия больше снаружи клетки)
Потенциал действия
Если на нервное или мышечное волокно действует раз-ль, то проницаемость мембраны тут же изменяется. Она увеличивается для ионов натрия, т. к. концентрация натрия в тканевой жидкости выше, то ионы устремляются в кислоту, уменьшая до нуля мембранный потенциал. На некоторое время возникает разность потенциалов с обратным знаком (реверсия мембранного потенциала).
а) фаза деполяризации
б) фаза реполяризации
в) фаза следовой реполяризации (потенциал)
Изменение проницаемости мембраны для Na+ продолжается недолго. Она начинает повышаться для K+ и снижается для Na+. Это соответствует фазе реполяризации. Нисходящая часть кривой соответствует следовому потенциалу и отражает восстановительные процессы наступающие после раздражения.
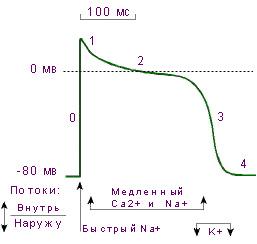
На кривой потенциала действия выделяют следующие фазы:
1.Локальный ответ (местная деполяризация), предшествующий развитию ПД.
2.Фаза деполяризации. Во время этой фазы МП быстро уменьшается и достигает нулевого уровня. Уровень деполяризации растет выше 0. Поэтому мембрана приобретает противоположный заряд – внутри она становится положительной, а снаружи отрицательной. Явление смены заряда мембраны называется реверсией мембранного потенциала. Продолжительность этой фазы у нервных и мышечных клеток 1-2 мсек.
3.Фаза реполяризации. Она начинается при достижении определенного уровня МП (примерно +20 мВ). Мембранный потенциал начинает быстро возвращаться к потенциалу покоя. Длительность фазы 3-5 мсек.
4.Фаза следовой деполяризации или следового отрицательного потенциала. Период, когда возвращение МП к потенциалу покоя временно задерживается. Он длится 15-30 мсек.
5.Фаза следовой гиперполяризации или следового положительного потенциала. В эту фазу, МП на некоторое время становится выше исходного уровня ПП. Ее длительность 250-300 мсек.
Амплитуда потенциала действия скелетных мышц в среднем 120-130 мВ, нейронов 80-90 мВ, гладкомышечных клеток 40-50 мВ. При возбуждении нейронов ПД возникает в начальном сегменте аксона – аксонном холмике.
Возникновение ПД обусловлено изменением ионной проницаемости мембраны при возбуждении. В период локального ответа открываются медленные натриевые каналы, а быстрые остаются закрытыми, возникает временная самопроизвольная деполяризация. Когда МП достигает критического уровня, закрытые активационные ворота натриевых каналов открываются и ионы натрия лавинообразно устремляются в клетку, вызывая нарастающую деполяризацию. В эту фазу открываются и быстрые и медленные натриевые каналы. Т.е. натриевая проницаемость мембраны резко возрастает. Причем от чувствительности активационных зависит величина критического уровня деполяризации: чем она выше, тем ниже КУД и наоборот.
Когда величина деполяризация приближается к равновесному потенциалу для ионов натрия (+20 мВ), сила концентрационного градиента натрия значительно уменьшается. Одновременно начинается процесс инактивации быстрых натриевых каналов и снижения натриевой проводимости мембраны. Деполяризация прекращается. Резко усиливается выход ионов калия, т.е. калиевый выходящий ток. В некоторых клетках это происходит из-за активации специальных каналов калиевого выходящего тока. Этот ток, направленный из клетки, служит для быстрого смещения МП к уровню потенциала покоя. Т.е. начинается фаза реполяризации. Возрастание МП приводит к закрыванию и активационных ворот натриевых каналов, что еще больше снижает натриевую проницаемость мембраны и ускоряет реполяризацию.
Возникновение фазы следовой деполяризации объясняется тем, что небольшая часть медленных натриевых каналов остается открытой.
Следовая гиперполяризация связана с повышенной, после ПД, калиевой проводимостью мембраны и тем, что более активно работает натрий-калиевый насос, выносящий вошедшие в клетку во время ПД ионы натрия.
Изменяя проводимость быстрых натриевых и калиевых каналов можно влиять на генерацию ПД, а следовательно на возбуждение клеток. При полной блокаде натриевых каналов, например ядом рыбы тетродонта – тетродотоксином, клетка становится невозбудимой. Это используется в клинике. Такие местные анестетики, как новокаин, дикаин, лидокаин тормозят переход натриевых каналов нервных волокон в открытое состояние. Поэтому проведение нервных импульсов по чувствительным нервам прекращается, наступает обезболивание (анестезия) органа. При блокаде калиевых каналов затрудняется выход ионов калия из цитоплазмы на наружную поверхность мембраны, т.е. восстановление МП. Поэтому удлиняется фаза реполяризации. Этот эффект блокаторов калиевых каналов также используется в клинической практике. Например, один из них хинидин, удлиняя фазу реполяризации кардиомиоцитов, урежает сердечные сокращения и нормализует сердечный ритм.
Также следует отметить, что чем выше скорость распространения ПД по мембране клетки, ткани, тем выше ее проводимость.
Вопрос №7
Механизм распространения возбуждения по немиелинизированным и миелинизированным волокнам. Скорость проведения возбуждения по волокнам типа А, В, С.
Распространение потенциала действия по немиелинизированным волокнам
По немиелинизированному волокну ПД распространяется непрерывно. Проведение нервного импульса начинается с распространением электрического поля. Возникший ПД за счет электрического поля способен деполяризовать мембрану соседнего участка до критического уровня, в результате чего на соседнем участке генерируются новые ПД. Сами ПД не перемещаются, они исчезают там же, где возникают. Главную роль в возникновении нового ПД играет предыдущий.
Если внутриклеточным электродом раздражать аксон посередине, то ПД будет распространяться в обоих направлениях. Обычно же ПД распространяется по аксону в одном направлении (от тела нейрона к нервным окончаниям), хотя деполяризация мембраны происходит по обе стороны от участка, где в данный момент возник ПД. Одностороннее проведение ПД обеспечивается свойствами натриевых каналов — после открывания они на некоторое время инактивируются и не могут открыться ни при каких значениях мембранного потенциала (свойство рефрактерности). Поэтому на ближнем к телу клетки участке, где до этого уже «прошел» ПД, он не возникает.
При прочих равных условиях распространение ПД по аксону происходит тем быстрее, чем больше диаметр волокна. По гигантским аксонам кальмара ПД может распространяться почти с такой же скоростью, как и по миелинизированным волокнам позвоночных (около 100 м/c).
Распространение потенциала действия по миелинизированным волокнам
По миелинизированному волокну ПД распространяется скачкообразно (сальтаторное проведение). Для миелинизированных волокон характерна концентрация потенциалзависимых ионных каналов только в областях перехватов Ранвье; здесь их плотность в 100 раз больше, чем в мембранах безмиелиновых волокон. В области миелиновых муфт потенциалзависимых каналов почти нет. ПД, возникший в одном перехвате Ранвье, за счет электрического поля деполяризует мембрану соседних перехватов до критического уровня, что приводит к возникновению в них новых ПД, то есть возбуждение переходит скачкообразно, от одного перехвата к другому. В случае повреждения одного перехвата Ранвье ПД возбуждает 2-ой, 3-ий, 4-ый и даже 5-ый, поскольку электроизоляция, создаваемая миелиновыми муфтами, уменьшает рассеивание электрического поля. Это увеличивает скорость распространения ПД по миелинизированным волокнам по сравнению с немиелинизированными. Кроме того, миелинизированные волокна толще, а электрическое сопротивление более толстых волокон меньше, что тоже увеличивает скорость проведения импульса по миелинизированным волокнам. Другим преимуществом сальтаторного проведения является его экономичность в энергетическом плане, так как возбуждаются только перехваты Ранвье, площадь которых меньше 1 % мембраны, и, следовательно, необходимо значительно меньше энергии для восстановления трансмембранных градиентов Na+ и K+, расходующихся в результате возникновения ПД, что может иметь значение при высокой частоте разрядов, идущих по нервному волокну.
Чтобы представить, насколько эффективно может быть увеличена скорость проведения за счёт миелиновой оболочки, достаточно сравнить скорость распространения импульса по немиелинизированным и миелинизированным участкам нервной системы человека. При диаметре волокна около 2 µм и отсутствии миелиновой оболочки скорость проведения будет составлять ~1 м/с, а при наличии даже слабой миелинизации при том же диаметре волокна — 15-20 м/с. В волокнах большего диаметра, обладающих толстой миелинововой оболочкой, скорость проведения может достигать 120 м/с.
Скорость распространения потенциала действия по мембране отдельно взятого нервного волокна отнюдь не является постоянной величиной — в зависимости от различных условий, эта скорость может очень значительно уменьшаться и, соответственно, увеличиваться, возвращаясь к некоему исходному уровню.
Наибольшей скорость проведения возбуждения обладают волокна типа А, скорость проведения возбуждения которых достигает 120 м/с, В имеет скорость от 3 до 14 м/с, С – от 0,5 до 2 м/с.
Не следует смешивать понятия «нервное волокно» и «нерв». Нерв – комплексное образование, состоящее из нервного волокна (миелинового или безми-елинового), рыхлой волокнистой соединительной ткани, образующей оболочку нерва.
Вопрос №8
Строение химических синапсов: медиаторы и модуляторы, их секреция, свойства постсинаптической мембраны. Постсинаптические потенциалы. Особенности проведения возбуждения в нервно-мышечных синапсах.
Синапс – это структурно-функциональное образование, обеспечивающее переход возбуждения или торможения с окончания нервного волокна на иннер-вирующую клетку.
Структура синапса:
1) пресинаптическая мембрана (электрогенная мембрана в терминале аксона, образует синапс на мышечной клетке);
2) постсинаптическая мембрана (электрогенная мембрана иннервируемой клетки, на которой образован синапс);
3) синаптическая щель (пространство между преси-наптической и постсинаптической мембраной, заполнена жидкостью, которая по составу напоминает плазму крови).
Существует несколько классификаций синапсов.
1. По локализации:
1) центральные синапсы;
2) периферические синапсы.
Центральные синапсы лежат в пределах центральной нервной системы, а также находятся в ганглиях вегетативной нервной системы.
Различают несколько видов периферических синапсов:
1) мионевральный;
2) нервно-эпителиальный.
2. Функциональная классификация синапсов:
1) возбуждающие синапсы;
2) тормозящие синапсы.
3. По механизмам передачи возбуждения в синапсах:
1) химические;
2) электрические.
Передача возбуждения осуществляется при помощи медиаторов. Различают несколько видов химических синапсов:
1) холинэргические. В них происходит передача возбуждения при помощи ацетилхолина;
2) адренэргические. В них происходит передача возбуждения при помощи трех катехоламинов;
3) дофаминэргические. В них происходит передача возбуждения при помощи дофамина;
4) гистаминэргические. В них происходит передача возбуждения при помощи гистамина;
5) ГАМКэргические. В них происходит передача возбуждения при помощи гаммааминомасляной кислоты, т. е. развивается процесс торможения.
Синапсы имеют ряд физиологических свойств:
1) клапанное свойство синапсов, т. е. способность передавать возбуждение только в одном направлении с пресинаптической мембраны на постсинап-тическую;
2) свойство синаптической задержки, связанное с тем, что скорость передачи возбуждения снижается;
3) свойство потенциации (каждый последующий импульс будет проводиться с меньшей постсинапти-ческой задержкой);
4) низкая лабильность синапса (100–150 имульсов в секунду).
10. Механизмы передачи возбуждения в синапсах на примере мионеврального синапса и его структура
Мионевральный (нервно-мышечный) синапс – образован аксоном мотонейрона и мышечной клеткой.
Нервный импульс возникает в тригерной зоне нейрона, по аксону направляется к иннервируемой мышце, достигает терминали аксона и при этом деполяризует пресинаптическую мембрану.
После этого открываются натриевые и кальциевые каналы, и ионы Ca из среды, окружающей синапс, входят внутрь терминали аксона. При этом процессе броуновское движение везикул упорядочивается по направления к пресинаптической мембране. Ионы Ca стимулируют движение везикул. Достигая пресинап-тическую мембрану, везикулы разрываются, и освобождается ацетилхолин (4 иона Ca высвобождают 1 квант ацетилхолина). Синаптическая щель заполнена жидкостью, которая по составу напоминает плазму крови, через нее происходит диффузия АХ с преси-наптической мембраны на постсинаптическую, но ее скорость очень мала. Кроме того, диффузия возможна еще и по фиброзным нитям, которые находятся в синаптической щели. После диффузии АХ начинает взаимодействовать с хеморецепторами (ХР) и холи-нэстеразой (ХЭ), которые находятся на постсинапти-ческой мембране.
Холинорецептор выполняет рецепторную функцию, а холинэстераза выполняет ферментативную функцию. На постсинаптической мембране они расположены следующим образом:
ХР—ХЭ—ХР—ХЭ—ХР—ХЭ.
ХР + АХ = МПКП – миниатюрные потенциалы концевой пластины.
Затем происходит суммация МПКП. В результате сум-мации образуется ВПСП – возбуждающий постсинап-тический потенциал. Постсинаптическая мембрана за счет ВПСП заряжается отрицательно, а на участке, где нет синапса (мышечного волокна), заряд положительный. Возникает разность потенциалов, образуется потенциал действия, который перемещается по проводящей системе мышечного волокна.
ХЭ + АХ = разрушение АХ до холина и уксусной кислоты.
В состоянии относительного физиологического покоя синапс находятся в фоновой биоэлектрической активности. Ее значение заключается в том, что она повышает готовность синапса к проведению нервного импульса тем самым значительно облегчает передачу нервного возбуждения по синапсу. В состоянии покоя 1–2 пузырька в терминале аксона могут случайно подойти к пресинаптической мембране, в результате чего вступят с ней в контакт. Везикула при контакте с пресинап-тической мембраной лопается, и ее содержимое в виде 1 кванта АХ поступает в синаптическую щель, попадая при этом на постсинаптическую мембрану, где будет образовываться МПКН.
Потенциалы постсинаптические (физиологические), относительно кратковременные колебания мембранного потенциала (чаще десятки миллисекунд, реже секунды), возникающие в результате местного воздействия медиатора на постсинаптическую мембрану нервной, мышечной, железистой клетки (см. Синапсы). Амплитуда П. п. зависит от количества выделенного медиатора. Взаимодействуя со специфическими рецепторами постсинаптические мембраны, медиаторы увеличивают её проницаемость для определённых ионов, которые входят в клетку или выходят из неё в соответствии с электрохимическим градиентом. Если этот процесс приводит к уменьшению трансмембранной разности потенциалов (деполяризации), П. п. являются возбуждающими (ВПСП). Тормозные П. п. (ТПСП) выражаются в гиперполяризации клетки, обусловленной действием тормозного медиатора. Как правило, нервная клетка имеет большое число синаптических входов; приходящие к ней сигналы алгебраически суммируются. В клетках, спонтанно генерирующих потенциалы действия, ВПСП увеличивает, а ТПСП уменьшает частоту разрядов. В "молчащих" клетках ВПСП может вызвать одиночный или групповой разряд, а одновременно возникший ТПСП блокировать этот эффект. Т. о., с помощью П. п. осуществляется управление возбудимостью нервных клеток.
Нервно-мышечный синапс (мионевральный синапс) — эффекторное нервное окончание на скелетном мышечном волокне.
Нервный отросток проходя через сарколемму мышечного волокна утрачивает миелиновую оболочку и образует сложный аппарат с плазматической мембраной мышечного волокна, образующийся из выпячиваний аксона и цитолеммы мышечного волокна, создавая глубокие «карманы». Синаптическая мембрана аксона и постсинаптическая мембрана мышечного волокна разделены синаптической щелью. В этой области мышечное волокно не имеет поперечной исчерченности, характерно скопление митохондрий и ядер. Терминали аксонов содержат большое количество митохондрий и синаптических пузырьков с медиатором (ацетилхолином).
Электронная микрофотография среза нервномышечного синапса. Т - окончание аксона, М - мышечное волокно. Стрелка указывает на складки базальной мембраны. Шкала 0.3 мкм[1]
Двигательные нервные окончания в гладкой мышечной ткани построены проще — безмиелиновые пучки аксонов проникают между глиоцитами к пласту гладких мышц и образуют булавовидные расширения, которые содержат холинергические и адренергические пузырьки.
Когда нервный импульс достигает окончания аксона, на деполяризованной пресинаптической мембране открываются потенциалзависимые Са2+ каналы. Вход Са2+ в аксональное расширение (пресинаптическую мембрану) способствует высвобождению химических нейромедиаторов, находящихся в виде везикул (пузырьков) из окончания аксона. Медиаторы (в нервно-мышечном синапсе это всегда ацетилхолин) синтезируются в соме нервной клетки и путем аксонального транспорта транспортируются к окончанию аксона, где и выполняют свою роль. Медиатор диффундирует через синаптическую щель и связывается со специфическими рецепторами на постсинаптической мембране. Так как медиатором в нервно-мышечном синапсе является ацетилхолин, то рецепторы постсинаптической мембраны называют холинорецепторами. В результате этого процесса на постсинаптической мембране открываются хемочувствительные Nа+-каналы, возникает деполяризация, величина которой различна, и зависит от количества выделенного медиатора. Чаще всего возникает локальный процесс, который называют потенциалом концевой пластинки (ПКП). При повышении частоты стимуляции нервного волокна, усиливается деполяризация пресинаптической мембраны, а, следовательно, возрастает количество выделяемого медиатора и число активированных хемочувствительных Nа+каналов на постсинаптической мембране. Таким образом, возникают ПКП, которые по амплитуде деполяризации суммируются до порогового уровня, после чего, на мембране мышечного волокна, окружающей синапс, возникает ПД, который обладает способностью к распространению вдоль мембраны мышечного волокна.
Чувствительность постсинаптической мембраны регулируется активностью фермента – ацетилхолинэстеразы (АЦХ-Э), который гидролизует медиатор АЦХ на составные компоненты (ацетил и холин) и возвращает назад – в пресинаптическую бляшку для ресинтеза. Без удаления медиатора на постсинаптической мембране развивается длительная деполяризация, которая ведет к нарушению проведения возбуждения в синапсе – синаптической депрессии. Таким образом, синаптическая связь обеспечивает одностороннее проведение возбуждения с нерва на мышцу, однако на все эти процессы расходуется время (синаптичекая задержка), что приводит к низкой лабильности синапса по сравнению с нервным волокном.
Таким образом, нервно-мышечный синапс является «выгодным» местом, куда можно воздействовать фармакологическими препаратами, изменяя чувствительность рецептора, активность фермента. Эти явления будут часто встречаться в практике врача: например, при отравлении токсином ботулизма – блокируется высвобождение медиатора АЦХ (разглаживание морщин в косметической медицине),
Вопрос №9
Теория мышечного сокращения и расслабления. Сократительные и регуляторные белки. Роль ионов кальция и АТФ в механизме сокращения.
Сокращение — это изменение механического состояния миофибриллярного аппарата мышечных волокон под влиянием нервных импульсов.
В 1939 г В.А. Энгельгардтом и М.Н. Любимовой было установлено, что миозин обладает свойствами фермента аденозинтрифосфатазы, расщепляющей АТФ. Вскоре было установлено, что при взаимодействии актина с миозином образуется комплекс — актомиозин, ферментативная активность которого почти в 10 раз выше активности миозина (А. С. Уент - Дьорди, 1940). В этот период и начинается разработка современной теории мышечного сокращения, которая получила название теории скользящих нитей. Согласно этой теории «скольжения» в основе сокращения лежит взаимодействие между актиновыми и миозиновыми нитями миофибрилл вследствие образования поперечных мостиков между ними.
Во время скольжения сами актиновые и миозиновые нити не укорачиваются, но длина саркомера изменяется. В расслабленной, а тем более растянутой мышце активные нити располагаются дальше от центра саркомера, и длина саркомера больше. При изотоническом сокращении мышцы актиновые нити скользят по направлению к центру саркомера вдоль миозиновых нитей. Нити актина прикреплены к Z-мембране, тянут ее за собой, и саркомер укорачивается. Суммарное укорочение всех саркомеров вызывает укорочение миофибрилл, и мышца сокращается.
В настоящее время принята следующая модель скольжения нитей актина.
Импульс возбуждения по двигательному нейрону достигает нервно-мышечного синапса — концевой пластинки, где освобождается ацетилхолин, который взаимодействует с постсинаптической мембраной, и в мышечном волокне возникает потенциал действия, т.е. наступает возбуждение мышечного волокна.
При связывании ионов Са++ с тропонином (сферические молекулы которого «сидят» на цепях актина) последний деформируется, толкая тропомиозин в желобки между двумя цепями актина. При этом становится возможным взаимодействие актина с головками миозина и возникает сила сокращения. Головки миозина совершают «гребковые» движения и продвигают актиновую нить по направлению к центру саркомера.
Головок у миозиновых нитей множество, они тянут актиновую нить с объединенной, суммарной силой. При одинаковом гребковом движении головок саркомер укорачивается примерно на 1 % его длины (а при изотоническом сокращении саркомер мышцы может укорачиваться на 50 % длины за десятые доли секунды), следовательно, поперечные мостики должны совершать примерно 50 «гребковых» движений за тот же промежуток времени.
Совокупное укорочение последовательно расположенных саркомеров миофибрилл приводит к заметному сокращению мышцы. Одновременно происходит гидролиз АТФ. После окончания пика потенциала действия активируется кальциевый насос (Са — зависимая АТФ-аза) мембраны саркоплазматического ретикулума. За счет энергии, выделяющейся при расщеплении АТФ, кальциевый насос перекачивает ионы Са++ обратно в цистерны саркоплазматического ретикулума, где Са++ связывается белком кальсеквестрином.
Концентрация ионов Са++ в цитоплазме мышц снижается до 10-8 м, а в саркоплазматическом ретикулуме повышается до 10-3 м.
Снижение уровня Са++ в саркоплазме подавляет АТФ-азную активность актомиозина; при этом поперечные мостики миозина отсоединяются от актина. Происходит расслабление, удлинение мышц в результате пассивного движения (без затрат энергии).
Таким образом, сокращение и расслабление мышцы представляет собой серию процессов, развертывающихся в следующей последовательности: нервный импульс --> выделение ацетилхолина пресинаптической мембраной нервно-мышечного синапса --> взаимодействие ацетилхолина с постсинаптической мембраной синапса --> возникновение потенциала действия --> электромеханическое сопряжение (проведение возбуждения по Т-канальцам, высвобождение Са++ и воздействие его на систему тропонин-тропомиозин-актин) --> образование поперечных мостиков и «скольжение» актиновых нитей вдоль миозиновых --> снижение концентрации ионов Са++ вследствие работы кальциевого насоса --> пространственное изменение белков сократительной системы --> расслабление миофибрилл.
После смерти мышцы остаются напряженными, наступает так называемое трупное окоченение, так как поперечные связи между филаментами актина и миозина не могут разорваться из-за отсутствия энергии АТФ и невозможности работы кальциевого насоса.
Вопрос № 10
Типы мышечных сокращений. Одиночное сокращение, его фазы. Виды тетануса и механизм их получегния. Оптимум и пессимум раздражения.
Различают два типа мышечных сокращений. Если оба конца мышцы неподвижно закреплены, происходит изометрическое сокращение, и при неизменной длине напряжение увеличивается. Если один конец мышцы свободен, то в процессе сокращения длина мышцы уменьшится, а напряжение не изменяется — такое сокращение называют изотоническим; в организме такие сокращения имеют большее значение для выполнения любых движений.
Аутоническое сокращение-это сокращения ,в которых изменяется напряжение и длинна мышечного волокна. Поперечно полосатая мускулатура обладает тремя физиологическими свойствами:
Одиночное сокращение. Когда мышца получает единичный стимул (например, единичный электрический импульс), она отвечает быстрым одиночным сокращением, продолжительность которого для мышцы лягушки составляет примерно 0,1 сек, а для мышцы человека - примерно 0,05 сек. Лабораторная запись одиночно-го сокращения показывает, что оно состоит из трех отдельных фаз: 1) латентного периода продолжительностью около 0,01 сек - промежутка времени между воздействием стимула и началом видимого укорочения мышцы; 2) периода сокращения продолжительностью около 0,04 сек, в течение которого мышца укорачивается и производит работу; 3) периода расслабления, самого продолжительного из трех (0,05 сек), во время которого мышца возвращается к своей первоначальной длине.
4.фаза остаточных колебаний.
Мышечные волокна обладают различной возбудимостью ,а величина одиночного сокращения зависит от силы раздражения. На максимальное (пороговое )одиночное мышечное раздражение каждое мышечное волокно возбуждается и сокращается максимально .Скелетная мышца состоит из большого количества мышечных волокон и амплитуда ее одиночного сокращения - это сумма амплитуд сократительных ответов волокон. Мышечные волокна обладают различной возбудимостью -отсюда сила одиночного сокращения всей скелетной мышцы будет зависеть от силы раздражение ,чем сильнее раздражение тем сильнее одиночное сокращение. На максимальное (пороговое) раздражение возбуждаться будут только самые возбудимые волокна, в таких условиях сила раздражения будет низкой. Если сила раздражения увеличивается, то амплитуда сокращения мышечных волокон так же будет увеличиваться до того момента пока не станет пороговой. Когда сила раздражения достигла пороговой, после этого амплитуда сокращений уже не будет изменяться.
Тетанусы :в физиологии, длительное сокращение мышц, возникающее при последовательном воздействии на них ряда нервных импульсов, разделённых малыми интервалами, и основанное на временной суммации (См. Суммация) следующих друг за другом одиночных волн сокращения. Т. наступает при достаточно высокой частоте возбуждения (См. Возбуждение) мышцы, когда каждое новое сокращение возникает до окончания предыдущего; при этом сократительные волны как бы накладываются друг на друга (слитное сокращение); в результате мышца остаётся укороченной в течение всего периода раздражения. Различают зубчатый и гладкий Т. Зубчатый Т. наблюдается в тех случаях, когда в ответ на последующее (второе, третье и т. д.) раздражение мышца начинает сокращаться, не успев полностью расслабиться после предыдущего сокращения. Гладкий Т. образуется при более высокой частоте раздражения, когда каждый последующий стимул приходит в фазу укорочения мышцы. Суммационная природа Т. подтверждается тем, что во время Т. в мышце ритмически возникают электрические потенциалы действия, сопровождающие каждую вспышку возбуждения. Тетаническое сокращение по амплитуде и длительности значительно превосходит одиночное сокращение. Характер Т. определяется тем, в какую фазу возбудимости мышцы (например, фазы экзальтации (См. Экзальтация), рефрактерности (См. Рефрактерность)) приходит очередное раздражение. На зависимость величины Т. от уровня возбудимости мышцы впервые указал Н. Е. Введенский, который отметил, что при повышении частоты раздражения Т. вначале достигает максимальной амплитуды (Оптимум), а затем амплитуда Т. резко снижается (Пессимум). Для тетанически сократившихся мышечных волокон характерна относительно быстрая утомляемость, так как Т. сопровождается значительным расходованием энергетических ресурсов мышцы. Электрофизиологическими методами установлено, что частота нервных импульсов, направляющихся к скелетным мышцам по аксонам двигательных нейронов (мотонейронов) спинного мозга, в несколько раз меньше частоты импульсов, вызывающих Т. Плавный характер движений, типичный для человека и животных, ранее объяснявшийся гладким Т., как полагают, вызван тонкой координацией деятельности мотонейронов, обеспечивающей попеременные фазические сокращения отдельных волокон, входящих в состав мышцы.
Пессимум (от лат. pessimum — наихудшее) -(физиологическое), угнетение деятельности органа или ткани, вызываемое чрезмерной частотой или силой наносимых раздражений; описано в 1886 Н. Е. Введенским (См. Введенский). Исследуя особенности проведения нервного импульса в нервно-мышечном препарате лягушки, он обнаружил, что усиление слитного сокращения мышцы — так называемое Тетануса, вызываемое постепенным возрастанием частоты или силы раздражений (см. Оптимум), при дальнейшем их учащении или усилении, внезапно сменяется расслаблением мышцы и полным торможением её активности. Введенский трактовал это явление с позиций разработанной им теории Парабиоза. Согласно этой теории, работоспособность нервных окончаний, передающих импульсы мышце, после прохождения волны возбуждения резко падает, и для восстановления их работоспособности требуется некоторое время (в нервно-мышечном препарате икроножной мышцы лягушки — 0,02—0,03 сек). Это время определяет функциональные возможности нервных окончаний — их Лабильность. Если интервал между раздражениями меньше этого необходимого периода, то есть если он превышает лабильность нервных окончаний, в них развивается своеобразное стойкое нераспространяющееся возбуждение — парабиоз, блокирующее проведение нервных импульсов к мышце и тормозящее тем самым её активность, предохраняя от переутомления. Описываемое явление носит обратимый характер: снижение интенсивности раздражения восстанавливает мышечное сокращение. Явление П. обнаружено в ряде органов и тканей; многие исследователи полагают, что оно лежит в основе рефлекторной регуляции деятельности организма со стороны нервной системы.
Оптимум (от лат. optimum — наилучшее) - уровень силы или частоты раздражений, при котором осуществляется максимальная деятельность органа или ткани. Явление О. описано в 1886 Н. Е. Введенским (См. Введенский), который на нервно-мышечном препарате лягушки установил, что нарастание до некоторого предела частоты или силы раздражений усиливает длительное, слитное сокращение мышцы — Тетанус. О. объясняют тем, что в этих случаях каждое последующее раздражение падает на мышцу в период повышенной её возбудимости, вызванной предыдущим раздражением.
Вопрос № 11
Торможение в ЦНС (И.М. Сеченов, Г.Гольц). Современные представления об основных видах и механизмах центрального торможения.
Проявление и осуществление рефлекса возможно только при ограничении распространения возбуждения с одних нервных центров на другие. Это достигается взаимодействием возбуждения с другим нервным процессом, противоположным по эффекту процессом торможения.
Почти до середины XIX века физиологи изучали и знали только один нервный процесс - возбуждение.
Явления торможения в нервных центрах, т.е. в центральной нервной системе были впервые открыты в 1862 году И.М.Сеченовым ("сеченовское торможение”). Это открытие сыграло в физиологии не меньшую роль, чем сама формулировка понятия рефлекса, так как торможение обязательно участвует во всех без исключения нервных актах. И.М.Сеченов обнаружил явление центрального торможения при раздражении промежуточного мозга теплокровных. В 1880 году немецкий физиолог Ф.Гольц установил торможение спинальных рефлексов. Н.Е. Введенский в результате серий опытов по парабиозу вскрыл интимную связь процессов возбуждения и торможения и доказал, что природа этих процессов едина.
Торможение - местный нервный процесс, приводящий к угнетению или предупреждению возбуждения. Торможение является активным нервным процессом, результатом которого служит ограничение или задержка возбуждения. Одна из характерных черт тормозного процесса- отсутствие способности к активному распространению по нервным структурам.
В настоящее время в центральной нервной системе выделяют два вида торможения: торможение центральное (первичное), являющееся результатом возбуждения (активации) специальных тормозных нейронов и торможение вторичное, которое осуществляется без участия специальных тормозных структур в тех самых нейронах в которых происходит возбуждение.
Торможение — в физиологии — активный нервный процесс, вызываемый возбуждением и проявляющийся в угнетении или предупреждении другой волны возбуждения. Обеспечивает (вместе с возбуждением) нормальную деятельность всех органов и организма в целом. Имеет охранительное значение (в первую очередь для нервных клеток коры головного мозга), защищая нервную систему от перевозбуждения.
И. П. Павлов называл иррадиацию торможения по коре больших полушарий головного мозга «проклятым вопросом физиологии».
Центральное торможение
Центральное торможение открыто в 1863 г. И.М. Сеченовым. В процессе опыта он удалил у лягушки головной мозг на уровне зрительных бугров и определял время сгибательного рефлекса. Затем на зрительные бугры помещался кристалл соли в результате чего наблюдалось увеличение продолжительности времени рефлекса. Это наблюдение позволило И.М. Сеченову высказать мнение о явлении торможения в ЦНС. Данный тип торможения называют сеченовским или центральным.
Ухтомский объяснил результаты с позиции доминанты. В зрительных буграх — доминанта возбуждения, которая подавляет действие спинного мозга.
Введенский объяснил результаты с позиции отрицательной индукции. Если в центральной нервной системе возникает возбуждение в определенном нервном центре, то вокруг очага возбуждения индуцируется торможение. Современное объяснение: при раздражении зрительных бугров возбуждается каудальный отдел ретикулярной формации. Эти нейроны возбуждают тормозные клетки спинного мозга (клетки Реншоу), которые тормозят активность альфа-мотонейронов спинного мозг
Первичное торможение
Первичное торможение возникает в специальных тормозных клетках, примыкающих к тормозному нейрону. При этом тормозные нейроны выделяют соответствующие нейромедиаторы.
Виды первичного торможения
Постсинаптическое — основной вид первичного торможения, вызывается возбуждением клеток Рейншоу и вставочных нейронов. При этом типе торможения происходит гиперполяризация постсинаптической мембраны, что и обуславливает торможение. Примеры первичного торможения:
Возвратное — нейрон воздействует на клетку Реншоу, которая в ответ тормозит этот же нейрон.
Реципрокное — явление торможения нейронов мышц-сгибателей при возбуждении эффекторных нейронов мышц-разгибателей через вставочный тормозной нейрон.
Латеральное — тормозная клетка тормозит расположенные рядом нейроны. Подобные явления развиваются между биполярными и ганглиозными клетками сетчатки, что создает условия для более четкого видения предмета.
Возвратное облегчение — нейтрализация торможения нейрона при торможении тормозных клеток другими тормозными клетками.
Пресинаптическое — возникает в обычных нейронах, связано с процессом возбуждения.
Вторичное торможение
Вторичное торможение возникает в тех же нейронах, которые генерируют возбуждение.
Виды вторичного торможения
Пессимальное торможение — это вторичное торможение, которое развивается в возбуждающих синапсах в результате сильной деполяризации постсинаптической мембраны под действием множественной импульсации.
Торможение вслед за возбуждением возникает в обычных нейронах и также связано с процессом возбуждения. В конце акта возбуждения нейрона в нем может развиваться сильная следовая гиперполяризация. В то же время возбуждающий постсинаптический потенциал не может довести деполяризацию мембраны до критического уровня деполяризации, потенциалзависимые натриевые каналы не открываются и потенциал действия не возникает
Периферическое торможение
Открыто братьями Вебер в 1845 г. В качестве примера можно привести торможение деятельности сердца (снижение ЧСС) при раздражении блуждающего нерва.
Кровообращение
1.Гемодинамическая функция сердца. Изменение давления в полостях сердца, положение клапанного аппарата в различные фазы сердечного цикла.
Сердце нагнетает кровь в сосудистую систему благодаря периодическому синхронному сокращению мышечных клеток, составляющих миокард предсердий и желудочков. Сокращение миокарда вызывает повышение давления крови и изгнание ее из камер сердца. Вследствие наличия общих слоев миокарда у обоих предсердии и у обоих желудочков и одновременного прихода возбуждения к клеткам миокарда по сердечным проводящим миоцитам (волокнам Пуркинье) сокращение обоих предсердий, а затем и обоих желудочков осуществляется одновременно.
Сокращение предсердий начинается в области устьев полых вен, вследствие чего устья сжимаются, поэтому кровь может двигаться только в одном направлении — в желудочки через предсердно-желудочковые отверстия. В этих отверстиях расположены клапаны. В момент диастолы предсердий створки клапанов расходятся, клапаны раскрываются и пропускают кровь из предсердий в желудочки. В левом желудочке находится левый предсердно-желудочковый (двустворчатый, или митральный) клапан, в правом — правый предсердно-желудочковый (трехстворчатый). При сокращении желудочков кровь устремляется в сторону предсердий и захлопывает створки клапанов. Открыванию створок в сторону предсердий препятствуют сухожильные нити, при помощи которых края створок прикрепляются к сосочковым мышцам. Последние представляют собой выросты внутреннего мышечного слоя стенки желудочков. Являясь частью миокарда желудочков, сосочковые мышцы сокращаются вместе с ними, натягивая сухожильные нити, которые, подобно вантам парусов, удерживают створки клапанов.
Повышение давления в желудочках при их сокращении приводит к изгнанию крови: из правого желудочка в легочную артерию, а из левого желудочка — в аорту. В устьях аорты и легочной артерии имеются полулунные клапаны — клапан аорты и клапан легочного ствола соответственно. Каждый из них состоит из трех лепестков, прикрепленных наподобие клапанных карманов к внутренней поверхности указанных артериальных сосудов. При систоле желудочков выбрасываемая ими кровь прижимает эти лепестки к внутренним стенкам сосудов. Во время диастолы кровь устремляется из аорты и легочной артерии обратно в желудочки и при этом захлопывает лепестки клапанов. Эти клапаны могут выдерживать большое давление, они не пропускают кровь из аорты и легочной артерии в желудочки.
Во время диастолы предсердий и желудочков давление в камерах сердца падает, вследствие чего кровь начинает притекать из вен в предсердия и далее через предсердно-желудочковые (атриовентрикулярные) отверстия — в желудочки, в которых давление снижается до нуля и ниже.
Наполнение сердца кровью. Поступление крови в сердце обусловлено рядом причин. Первой из них является остаток движущей силы, вызванной предыдущим сокращением сердца. О наличии этой остаточной силы свидетельствует то, что из периферического конца нижней полой вены, перерезанной вблизи сердца, течет кровь, что было бы невозможно в случае, если бы сила предыдущего сердечного сокращения была полностью израсходована.
Среднее давление крови в венах большого круга кровообращения равно 7 мм рт.ст. В полостях сердца во время диастолы оно близко к нулю. Градиент давления, обеспечивающий приток венозной крови к сердцу, около 7 мм рт. ст. Это величина очень небольшая, и поэтому любые препятствия току венозной крови (например, легкое случайное сдавливание полых вен во время хирургической операции) могут полностью прекратить доступ крови к сердцу. Сердце выбрасывает в артерии лишь ту кровь, которая притекает к нему из вен, поэтому прекращение венозного притока немедленно приводит к прекращению выброса крови в артериальную систему, падению артериального давления.
Вторая причина притока крови к сердцу — сокращение скелетных мышц и наблюдающееся при этом сдавливание вен конечностей и туловища. В венах имеются клапаны, пропускающие кровь только в одном направлении — к сердцу. Периодическое сдавливание вен вызывает систематическую подкачку крови к сердцу. Эта так называемая венозная помпа обеспечивает значительное увеличение притока венозной крови к сердцу, а значит, и сердечного выброса при физической работе.
Третья причина поступления крови в сердце — присасывание ее грудной клеткой, особенно во время вдоха. Грудная клетка представляет собой герметически закрытую полость, в которой вследствие эластической тяги легких существует отрицательное давление. В момент вдоха сокращение наружных межреберных мышц и диафрагмы увеличивает эту полость: органы грудной полости, в частности полые вены, подвергаются растяжению и давление в полых венах и предсердиях становится отрицательным. Именно поэтому к ним сильнее притекает кровь с периферии.
Имеются данные о существовании механизма, непосредственно присасывающего кровь в сердце. Этот механизм состоит в том, что во время систолы желудочков, когда укорачивается их продольный размер, предсердно-желудочковая перегородка оттягивается книзу, что вызывает расширение предсердий и приток в них крови из полых вен. Предполагают наличие и других механизмов, активно доставляющих кровь в сердце. Наконец, определенное значение имеет присасывающая сила расслабляющихся желудочков, которые, подобно отпущенной резиновой груше, восстанавливая свою форму во время диастолы, создают разрежение в полостях.
Во время диастолы в желудочки притекает около 70% общего объема крови. При систоле предсердий в желудочки подкачивается еще около 30% этого объема. Таким образом, значение нагнетательной функции миокарда предсердий для кровообращения сравнительно невелико. Предсердия являются резервуаром для притекающей крови, легко изменяющим свою вместимость благодаря небольшой толщине стенок. Объем этого резервуара может возрастать за счет наличия дополнительных емкостей — ушек предсердий, напоминающих кисеты, способные при расправлении вместить значительные объемы крови.
2.Сердечный цикл, его фазы и их продолжительность. Изменение продолжительности фаз при изменении ритма сердечных сокращений.
Под сердечным циклом понимают период, охватывающий одно сокращение — систола, и одно расслабление — диастола предсердий и желудочков. Пример синхронной регистрации ряда процессов при деятельности сердца представлен на рис. 7.8. Кривые записаны при частоте сердечных сокращений 75 в минуту. В этом случае общая длительность сердечного цикла равна 0,8 с. Сокращение сердца начинается с систолы предсердий, длящейся 0,1 с. Давление в предсердиях при этом поднимается до 5—8 мм рт.ст. Систола предсердии сменяется систолой желудочков продолжительностью 0,33 с. Систола желудочков разделяется на несколько периодов и фаз.
Период напряжения длится 0,08 с. и состоит из двух фаз.
Фаза асинхронного сокращения миокарда желудочков длится 0,05 с. Точкой отсчета начала этой фазы служит зубец Q ЭКГ, свидетельствующий о начале возбуждения желудочков. В течение этой фазы процесс возбуждения и следующий за ним процесс сокращения распространяются по миокарду желудочков. Давление в желудочках еще близко к нулю. К концу фазы сокращение охватывает все волокна миокарда, а давление в желудочках начинает быстро нарастать.
Фаза изометрического сокращения (0,03 с.) начинается с захлопывания створок предсердно-желудочковых (атриовентрикулярных) клапанов. При этом возникает I, или систолический, тон сердца. Смещение створок и крови в сторону предсердий вызывает подъем давления в предсердиях. На кривой регистрации давления в предсердиях виден небольшой зубец. Давление в желудочках быстро нарастает: до 70—80 мм рт.ст. в левом и до 15—20 мм рт.ст. в правом.
Створчатые и полулунные клапаны («вход» и «выход» из желудочков) еще закрыты, объем крови в желудочках остается постоянным. Вследствие того, что жидкость практически несжимаема, длина волокон' миокарда не изменяется, увеличивается только их напряжение. Стремительно растет давление крови в желудочках. Левый желудочек быстро приобраетает круглую форму и с силой ударяется о внутреннюю поверхность грудной стенки. В пятом межреберье на 1 см слева от среднеключичной линии в этот момент определяется верхушечный толчок.
К концу периода напряжения быстро нарастающее давление в левом и правом желудочках становится выше давления в аорте и легочной артерии. Кровь из желудочков устремляется в эти сосуды.
Период изгнания крови из желудочков длится 0,25 с и состоит из фазы быстрого (0,12 с) и фазы медленного изгнания (0,13 с). Давление в желудочках при этом нарастает: в левом до 120—130 мм рт.ст., а в правом до 25 мм рт.ст. В конце фазы медленного изгнания миокард желудочков начинает расслабляться, наступает его диастола (0,47 с). Давление в желудочках падает, кровь из аорты и легочной артерии устремляется обратно в полости желудочков и захлопывает полулунные клапаны, при этом возникает II, или диастолический, тон сердца.
Время от начала расслабления желудочков до захлопывания полулунных клапанов называется протодиастолическим периодом (0,04 с). После захлопывания полулунных клапанов давление в желудочках падает. Створчатые клапаны в это время еще закрыты, объем крови, оставшейся в желудочках, а следовательно, и длина волокон миокарда не изменяются, поэтому данный период назван периодом изометрического расслабления (0,08 с). К концу его давление в желудочках становится ниже, чем в предсердиях, открываются предсердно-желудочковые клапаны и кровь из предсердий поступает в желудочки. Начинается период наполнения желудочков кровью, который длится 0,25 с. и делится на фазы быстрого (0,08 с) и медленного (0,17 с) наполнения.
Колебания стенок желудочков вследствие быстрого притока крови к ним вызывают появление III тона сердца. К концу фазы медленного наполнения возникает систола предсердий. Предсердия нагнетают в желудочки дополнительное количество крови (пресистолический период, равный 0,1 с), после чего начинается новый цикл деятельности желудочков.
Колебание стенок сердца, вызванное сокращением предсердий и дополнительным поступлением крови в желудочки, ведет к появлению IV тона сердца.
При обычном прослушивании сердца хорошо слышны громкие I и II тоны, а тихие III и IV тоны выявляются лишь при графической регистрации тонов сердца.
3.Проводящая система сердца, ее строение и функции. Градиент автоматии. Ионный механизм потенциала действия (ПД) клеток водителя ритма.
Возбуждение в сердце возникает периодически под влиянием процессов, протекающих в нем самом. Это явление получило название автоматии. Способностью к автоматии обладают определенные участки миокарда, состоящие из специфической (атипической) мышечной ткани, бедной миофибриллами, богатой саркоплазмой и напоминающей эмбриональную мышечную ткань. Специфическая мускулатура образует в сердце проводящую систему, состоящую из синусно-предсердного (синоатриального) узла — водителя ритма сердца, расположенного в стенке предсердия у устьев полых вен и предсердно-желудочкового (атриовентрикулярного) узла, расположенного в нижней трети правого предсердия и межжелудочковой перегородке. От этого узла берет начало предсердно-желудочковый пучок (пучок Гиса), прободающий предсердно-желудочковую перегородку и делящийся на правую и левую ножки, следующие в межжелудочковой перегородке. В области верхушки сердца ножки предсердно-желудочкового пучка загибаются вверх и переходят в сеть сердечных проводящих миоцитов (волокна Пуркинье), погруженных в рабочий (сократительный) миокард желудочков.
Особенностью проводящей системы сердца является способность каждой клетки самостоятельно генерировать возбуждение. Существует так называемый градиент автоматии, выражающийся в убывающей способности к автоматии различных участков проводящей системы по мере их удаления от синусно-предсердного узла, генерирующего импульса с частотой до 60—80 в минуту.
Электрическая активность клеток миокарда
В естественных условиях клетки миокарда находятся в состоянии ритмической активности (возбуждения), поэтому об их потенциале покоя можно говорить лишь условно. У большинства клеток он составляет около 90 мВ и определяется почти целиком концентрационным градиентом ионов К+.
Потенциалы действия (ПД), зарегистрированные в разных отделах сердца при помощи внутриклеточных микроэлектродов, существенно различаются по форме, амплитуде и длительности (рис. 7.3, А). На рис. 7.3, Б схематически показан ПД одиночной клетки миокарда желудочка. Для возникновения этого потенциала потребовалось деполяризовать мембрану на 30 мВ. В ПД различают следующие фазы: быструю начальную деполяризацию — фаза 1; медленную реполяризацию, так называемое плато — фаза 2; быструю реполяризацию — фаза 3; фазу покоя — фаза 4.
Фаза 1 в клетках миокарда предсердий, сердечных проводящих миоцитов (волокна Пуркинье) и миокарда желудочков имеет ту же природу, что и восходящая фаза ПД нервных и скелетных мышечных волокон — она обусловлена повышением натриевой проницаемости, т. е. активацией быстрых натриевых каналов клеточной мембраны. Во время пика ПД происходит изменение знака мембранного потенциала (с —90 до +30 мВ).
Деполяризация мембраны вызывает активацию медленных натрий-кальциевых каналов. Поток ионов Са2+ внутрь клетки по этим каналам приводит к развитию плато ПД (фаза 2). В период плато натриевые каналы инактивируются и клетка переходит в состояние абсолютной рефрактерности. Одновременно происходит активация калиевых каналов. Выходящий из клетки поток ионов К+ обеспечивает быструю реполяризацию мембраны (фаза 3), во время которой кальциевые каналы закрываются, что ускоряет процесс реполяризации (поскольку падает входящий кальциевый ток, деполяризующий мембрану).
Реполяризация мембраны вызывает постепенное закрывание калиевых и реактивацию натриевых каналов. В результате возбудимость миокардиальной клетки восстанавливается — это период так называемой относительной рефрактерности.
В клетках рабочего миокарда (предсердия, желудочки) мембранный потенциал (в интервалах между следующими друг за другом ПД) поддерживается на более или менее постоянном уровне. Однако в клетках синусно-предсердного узла, выполняющего роль водителя ритма сердца, наблюдается спонтанная диастолическая деполяризация (фаза 4), при достижении критического уровня которой (примерно —50 мВ) возникает новый ПД (см. рис. 7.3, Б). На этом механизме основана авторитмическая активность указанных сердечных клеток. Биологическая активность этих клеток имеет и другие важные особенности: 1) малую крутизну подъема ПД; 2) медленную реполяризацию (фаза 2), плавно переходящую в фазу быстрой реполяризации (фаза 3), во время которой мембранный потенциал достигает уровня —60 мВ (вместо —90 мВ в рабочем миокарде), после чего вновь начинается фаза медленной диастолической деполяризации. Сходные черты имеет электрическая активность клеток предсердно-желудочкового узла, однако скорость спонтанной диастолической деполяризации у них значительно ниже, чем у клеток синусно-предсердного узла, соответственно ритм их потенциальной автоматической активности меньше.
Ионные механизмы генерации электрических потенциалов в клетках водителя ритма полностью не расшифрованы. Установлено, что в развитии медленной диастолической деполяризации и медленной восходящей фазы ПД клеток синусно-предсердного узла ведущую роль играют кальциевые каналы. Они проницаемы не только для ионов Са2+, но и для ионов Na+. Быстрые натриевые каналы не принимают участия в генерации ПД этих клеток.
Способность клеток миокарда в течение жизни человека находиться в состоянии непрерывной ритмической активности обеспечивается эффективной работой ионных насосов этих клеток. В период диастолы из клетки выводятся ионы Na+, а в клетку возвращаются ионы К+. Ионы Са2+, проникшие в цитоплазму, поглощаются эндоплазматической сетью. Ухудшение кровоснабжения миокарда (ишемия) ведет к обеднению запасов АТФ и креатинфосфата в миокардиальных клетках; работа насосов нарушается, вследствие чего уменьшается электрическая и механическая активность миокардиальных клеток.
4.Скорость проведения возбуждения по различным отделам проводящей системы сердца. Механизм и физиологическое значение атрио-вентрикулярной задержки. Полный и неполный сердечный блок.
Особенностью проводящей системы сердца является способность каждой клетки самостоятельно генерировать возбуждение. Существует так называемый градиент автоматии, выражающийся в убывающей способности к автоматии различных участков проводящей системы по мере их удаления от синусно-предсердного узла, генерирующего импульса с частотой до 60—80 в минуту.
В обычных условиях автоматия всех нижерасположенных участков проводящей системы подавляется более частыми импульсами, поступающими из синусно-предсердного узла. В случае поражения и выхода из строя этого узла водителем ритма может стать предсердно-желудочковый узел. Импульсы при этом будут возникать с частотой 40—50 в минуту. Если окажется выключенным и этот узел, водителем ритма могут стать волокна предсердно-желудочкового пучка (пучок Гиса). Частота сердечных сокращений в этом случае не превысит 30—40 в минуту. Если выйдут из строя и эти водители ритма, то процесс возбуждения спонтанно может возникнуть в клетках волокон Пуркинье. Ритм сердца при этом будет очень редким — примерно 20 в минуту.
Отличительной особенностью проводящей системы сердца является наличие в ее клетках большого количества межклеточных контактов — нексусов. Эти контакты являются местом перехода возбуждения с одной клетки на другую. Такие же контакты имеются и между клетками проводящей системы и рабочего миокарда. Благодаря наличию контактов миокард, состоящий из отдельных клеток, работает как единой целое. Существование большого количества межклеточных контактов увеличивает надежность проведения возбуждения в миокарде.
Возникнув в синусно-предсердном узле, возбуждение распространяется по предсердиям, достигая предсердно-желудочкового (атриовентрикулярного) узла. В сердце теплокровных животных существуют специальные проводящие пути между синусно-предсердным и предсердно-желудочковым узлами, а также между правым и левым предсердиями. Скорость распространения возбуждения в этих проводящих путях ненамного превосходит скорость распространения возбуждения по рабочему миокарду. В предсердно-желудочковом узле благодаря небольшой толщине его мышечных волокон и особому способу их соединения возникает некоторая задержка проведения возбуждения. Вследствие задержки возбуждение доходит до предсердно-желудочкового пучка и сердечных проводящих миоцитов (волокна Пуркинье) лишь после того, как мускулатура предсердий успевает сократиться и перекачать кровь из предсердий в желудочки.
Следовательно, атриовентрикулярная задержка обеспечивает необходимую последовательность (координацию) сокращений предсердий и желудочков.
Скорость распространения возбуждения в предсердно-желудочковом пучке и в диффузно расположенных сердечных проводящих миоцитах достигает 4,5—5 м/с, что в 5 раз больше скорости распространения возбуждения по рабочему миокарду. Благодаря этому клетки миокарда желудочков вовлекаются в сокращение почти одновременно, т. е. синхронно (см. рис. 7.2). Синхронность сокращения клеток повышает мощность миокарда и эффективность нагнетательной функции желудочков. Если бы возбуждение проводилось не через предсердно-желудочковый пучок, а по клеткам рабочего миокарда, т. е. диффузно, то период асинхронного сокращения продолжался бы значительно дольше, клетки миокарда вовлекались в сокращение не одновременно, а постепенно и желудочки потеряли бы до 50% своей мощности.
Различают неполный сердечный блок и полный сердечный блок. При пониженной возбудимости атриовентрикулярного узла (не все импульсы от синусного узла проходят через атриовентрикулярный) развивается неполный сердечный блок. В таком случае к желудочкам проходит каждый второй или третий импульс и желудочки сокращаются в 2-3 раза медленнее предсердий. При поражении пучка Гиса развивается полный сердечный блок - импульсы от синусного узла не поступают в желудочки. В таком случае работает собственный автоматизм желудочков, которые начинают сокращаться в более медленном собственном ритме независимо от ритма сокращений предсердий, т.е. между ритмами сокращений предсердий и желудочков наступает полная разбалансировка.
6.Свойства сердечной мышцы: возбудимость, сократимость, закон “все или ничего”, закон сердца Старлинга, особенности потенциала действия кардиомиоцитов желудочков.
Свойства сердечной мышцы:
Возбудимость сердечной мышцы заключается в том, что под действием различных раздражителей (химических, механических, электрических и др.) сердце способно приходить в состояние возбуждения. В основе процесса возбуждения лежит появление отрицательного электрического потенциала на наружной поверхности мембран клеток, подвергшихся действию раздражителя. Как и в любой возбудимой ткани, мембрана мышечных клеток (миоцитов) поляризована. В покое она снаружи заряжена положительно, изнутри - отрицательно. Разность потенциалов определяется различной концентрацией ионов N а + и К + по обе стороны мембраны. Действие раздражителя увеличивает проницаемость мембраны для ионов К + и Nа + , происходит перестройка мембранного потенциала(калий - натриевый насос), в результате возникает потенциал действия, распространяющийся и на другие клетки. Таким образом происходит распространение возбуждения по всему сердцу.
Импульсы, возникшие в синусном узле, распространяются по мускулатуре предсердий. Дойдя до атриовентрикулярного узла, волна возбуждения распространяется по пучку Гиса, а затем по волокнам Пуркинье. Благодаря проводящей системе сердца наблюдается последовательное сокращение частей сердца: сначала сокращаются предсердия, затем желудочки (начиная с верхушки сердца волна сокращения распространяется к их основанию). Особенность атриовентрикулярного узла - проведение волны возбуждения только в одном направлении: от предсердий к желудочкам.
Сократимость - это способность миокарда сокращаться. Оно основано на способности самих клеток миокарда отвечать на возбуждение сокращением. Это свойство сердечной мышцы определяет способность сердца выполнять механическую работу. Работа сердечной мышцы подчиняется закону "все или ничего".Суть этого закона состоит в следующем: если на сердечную мышцу наносить раздражающее действие различной силы, мышца отвечает каждый раз максимальным сокращением ("все"). Если сила раздражителя не достигает порогового значения, то сердечная мышца не отвечает сокращением ("ничего").
Закон сердца Старлинга: при увеличении кровенаполнения сердца в диастолу и, следовательно, при увеличении растяжения мышцы сердца сила сердечных сокращений возрастает. В условиях целостного организма действие закона Франка — Старлинга ограничено влиянием других механизмов регуляции деятельности сердца.
Особенности потенциала действия кардиомиоцитов желудочков
В состоянии покоя внутренняя поверхность мембран кардиомиоцитов заряжена отрицательно. Потенциал покоя определяется в основном трансмембранным градиентом концентрации ионов К+ и у большинства кардиомиоцитов (кроме синусового узла и АВ-узла) составляет от минус 80 до минус 90 мВ. При возбуждении в кардиомиоциты входят катионы, и возникает их временная деполяризация - потенциал действия.
Ионные механизмы потенциала действия в рабочих кардиомиоцитах и в клетках синусового узла и АВ-узла разные, поэтому и форма потенциала действия также различается.
У потенциала действия кардиомиоцитов системы Гиса-Пуркинье и рабочего миокарда желудочков выделяют пять фаз. Фаза быстрой деполяризации (фаза 0) обусловлена входом ионов Na+ по так называемым быстрым натриевым каналам . Затем, после кратковременной фазы ранней быстрой реполяризации (фаза 1), наступает фаза медленной деполяризации, или плато (фаза 2). Она обусловлена одновременным входом ионов Са2+ по медленным кальциевым каналам и выходом ионов К+. Фаза поздней быстрой реполяризации (фаза 3) обусловлена преобладающим выходом ионов К+. Наконец, фаза 4 - это потенциал покоя.
7.Потенциал действия кардиомиоцитов желудочков, его фазы, ионный механизм, графическое изображение.
Потенциал действия кардиомиоцитажелудочка- этонеспецифический эффектеговозбуждения.
|
| |
|
Схема. Потенциал действия сократительного кардиомиоцита. В нижней части схемы показаны потокиразличныхионовчерезсарколемму. См.: рис.управление сокращением и расслаблением кардиомиоцита. | |
|
|
|
|
| |
Как и в любых возбудимыхклетках, возбуждение кардиомиоцитов начинается быстройдеполяризациейегомембраныдо нулевогоуровня, которая продолжается быстрой сменой знака полярности с отрицательной на положительную (реверсияпотенциала), фаза 0 на схеме. Этим быстрым изменением полярности мембраны кардиомиоцита с уровняпотенциала покоя~(-80 мВ) до ~(+30 мВ) начинается потенциал действия кардиомиоцита. Длительностьфазыдеполяризации и реверсии знака потенциала мембраны составляет ~1 ÷ 2 мс. За этой фазой следует фазареполяризации. В отличие от фазы реполяризации других возбудимых клеток фаза реполяризации кардиомиоцита имеет специфическую особенность. Сначала реполяризация осуществляется быстро (фаза 1 на схеме), затем медленно, так что на кривой записи потенциала действия кардиомиоцита видно плато (фаза 2 на схеме). Затем осуществляется плавный переход к быстрой реполяризации мембраны (фаза 3 на схеме) до потенциала покоя (фаза 4 на схеме). Длительность потенциала действия кардиомиоцитов составляет ~200 ÷ 400 мс, что более чем в 100 раз превышает длительность потенциала действия клетокскелетных мышцинервных волокон. Эта особенность неспецифического эффекта возбуждения кардиомиоцита обусловливает определенные особенностиспецифического эффекта возбуждениякардиомиоцита - егосокращение. По современнымпредставлениямученых (ионные механизмы возбуждения) потенциал действия является следствием изменения проницаемостицитоплазматической мембраныдля различныхионов. Это ведет к особым разнонаправленнымпотокамионовчерезсарколемму.Динамикапотоков определяет электрическиепроцессына сарколемме и особенностипотенциалов действия различных клеток сердца.
9. Миогенная регуляция сердечной деятельности. Гетеро- и гомеометрическая саморегуляция.
Внутриклеточные механизмы регуляции. Электронная микроскопия позволила установить, что миокард не является синцитием, а состоит из отдельных клеток — миоцитов, соединяющихся между собой вставочными дисками. В каждой клетке действуют механизмы регуляции синтеза белков, обеспечивающих сохранение ее структуры и функций. Скорость синтеза каждого из белков регулируется собственным ауторегуляторным механизмом, поддерживающим уровень воспроизводства данного белка в соответствии с интенсивностью его расходования.
При увеличении нагрузки на сердце (например, при регулярной мышечной деятельности) синтез сократительных белков миокарда и структур, обеспечивающих их деятельность, усиливается. Появляется так называемая рабочая (физиологическая) гипертрофия миокарда, наблюдающаяся у спортсменов.
Внутриклеточные механизмы регуляции обеспечивают и изменение интенсивности деятельности миокарда в соответствии с количеством притекающей к сердцу крови. Этот механизм получил название «закон сердца» (закон Франка—Старлинга): сила сокращения сердца (миокарда) пропорциональна степени его кровенаполнения в диастолу (степени растяжения), т. е. исходной длине его мышечных волокон. Более сильное растяжение миокарда в момент диастолы соответствует усиленному притоку крови к сердцу. При этом внутри каждой миофибриллы актиновые нити в большей степени выдвигаются из промежутков между миозиновыми иитями, а значит, растет количество резервных мостиков, т. е. тех актиновых точек, которые соединяют актиновые и миозиновые нити в момент сокращения. Следовательно, чем больше растянута каждая клетка миокарда во время диастолы, тем больше она сможет укоротиться во время систолы. По этой причине сердце перекачивает в артериальную систему то количество крови, которое притекает к нему из вен. Такой тип миогенной регуляции сократимости миокарда получил название гетерометрической (т. е. зависимой от переменной величины — исходной длины волокон миокарда) регуляции. Под гомеометрической регуляцией принято понимать изменения силы сокращений при неменяющейся исходной длине волокон миокарда. Это прежде всего ритмозависимые изменения силы сокращений. Если стимулировать полоску миокарда при равном растяжении с все увеличивающейся частотой, то можно наблюдать увеличение силы каждого последующего сокращения («лестница» Боудича). В качестве теста на гомеометрическую регуляцию используют также пробу Анрепа — резкое увеличение сопротивления выбросу крови из левого желудочка в аорту. Это приводит к увеличению в определенных границах силы сокращений миокарда. При проведении пробы выделяют две фазы. Вначале при увеличении сопротивления выбросу крови растет конечный диастолический объем и увеличение силы сокращений реализуется по гетерометрическому механизму. На втором этапе конечный диастолический объем стабилизируется и возрастание силы сокращений определяется гомеометрическим механизмом.
10.Нервная и гуморальная регуляция сердечной деятельности. Гемодинамические рефлексы.
Нервная экстракардиальная регуляция. Эта регуляция осуществляется импульсами, поступающими к сердцу из ЦНС по блуждающим и симпатическим нервам.
Подобно всем вегетативным нервам, сердечные нервы образованы двумя нейронами. Тела первых нейронов, отростки которых составляют блуждающие нервы (парасимпатический отдел автономной нервной системы), расположены в продолговатом мозге (рис. 7.11). Отростки этих нейронов заканчиваются в интрамуральных ганглиях сердца. Здесь находятся вторые нейроны, отростки которых идут к проводящей системе, миокарду и коронарным сосудам.
Влияние на сердце блуждающих нервов впервые изучили братья Вебер (1845). Они установили, что раздражение этих нервов тормозит работу сердца вплоть до полной его остановки в диастолу. Это был первый случай обнаружения в организме тормозящего влияния нервов.
При электрическом раздражении периферического отрезка перерезанного блуждающего нерва происходит урежение сердечных сокращений. Это явление называется отрицательным хронотропным эффектом. Одновременно отмечается уменьшение амплитуды сокращений — отрицательный инотропный эффект.
При сильном раздражении блуждающих нервов работа сердца на некоторое время прекращается. В этот период возбудимость мышцы сердца понижена. Понижение возбудимости мышцы сердца называется отрицательным батмотропным эффектом. Замедление проведения возбуждения в сердце называется отрицательным дромотропным эффектом. Нередко наблюдается полная блокада проведения возбуждения в предсердно-желудочковом узле.
Микроэлектродные отведения потенциалов от одиночных мышечных волокон предсердий показали увеличение мембранного потенциала — гиперполяризацию при сильном раздражении блуждающего нерва
При продолжительном раздражении блуждающего нерва прекратившиеся вначале сокращения сердца восстанавливаются, несмотря на продолжающееся раздражение. Это явление называют ускользанием сердца из-под влияния блуждающего нерва.
При раздражении симпатических нервов ускоряется спонтанная деполяризация клеток — водителей ритма в диастолу, что ведет к учащению сердечных сокращений.
Раздражение сердечных ветвей симпатического нерва улучшает проведение возбуждения в сердце (положительный дромотропный эффект) и повышает возбудимость сердца (положительный батмотропный эффект). Влияние раздражения симпатического нерва наблюдается после большого латентного периода (10 с и более) и продолжается еще долго после прекращения раздражения нерва.
Инотропный эффект «усиливающего» нерва хорошо виден при регистрации внутрижелудочкового давления электроманометром. Выраженное влияние «усиливающего» нерва на сократимость миокарда проявляется особенно при нарушениях сократимости. Одной из таких крайних форм нарушения сократимости является альтернация сердечных сокращений, когда одно «нормальное» сокращение миокарда (в желудочке развивается давление, превышающее давление в аорте и осуществляется выброс крови из желудочка в аорту) чередуется со «слабым» сокращением миокарда, при котором давление в желудочке в систолу не достигает давления в аорте и выброса крови не происходит. «Усиливающий» нерв не только усиливает обычные сокращения желудочков, но и устраняет альтернацию, восстанавливая неэффективные сокращения до обычных (рис. 7.13). По мнению И. П. Павлова, эти волокна являются специально трофическими, т. е. стимулирующими процессы обмена веществ.
Совокупность приведенных данных позволяет представить влияние нервной системы на ритм сердца как корригирующее, т. е. ритм сердца зарождается в его водителе ритма, а нервные влияния ускоряют или замедляют скорость спонтанной деполяризации клеток водителя ритма, ускоряя или замедляя таким образом частоту сердцебиений.
В последние годы стали известны факты, свидетельствующие о возможности не только корригирующих, но и пусковых влияний нервной системы на ритм сердца, когда сигналы, приходящие по нервам, инициируют сокращения сердца. Это можно наблюдать в опытах с раздражением блуждающего нерва в режиме, близком к естественной импульсации в нем, т. е. «залпами» («пачками») импульсов, а не непрерывным потоком, как это делалось традиционно. При раздражении блуждающего нерва «залпами» импульсов сердце сокращается в ритме этих «залпов» (каждому «залпу» соответствует одно сокращение сердца). Меняя частоту и характеристику «залпов», можно управлять ритмом сердца в широких пределах.
Воспроизведение сердцем центрального ритма резко изменяет электрофизиологические параметры деятельности синоатриального узла. При работе узла в режиме автоматии, а также при изменениях частоты под влиянием раздражения блуждающего нерва в традиционном режиме возбуждение возникает в одной точке узла, в случае воспроизведения центрального ритма в инициации возбуждения принимает участие одновременно множество клеток узла. На изохронной карте движения возбуждения в узле этот процесс отражается не в виде точки, а в виде большой площади, образованной одновременно возбуждающимися структурными элементами. Сигналы, обеспечивающие синхронное воспроизведение сердцем центрального ритма, отличаются по своей медиаторной природе от общетормозных влияний блуждающего нерва. По-видимому, выделяющиеся в этом случае наряду с ацетилхолином регуляторные пептиды отличаются по своему составу, т. е. реализация каждого типа эффектов блуждающего нерва обеспечивается своей смесью медиаторов («медиаторные коктейли»).
Гуморальная регуляция деятельности сердца
Изменения работы сердца наблюдаются при действии на него ряда биологически активных веществ, циркулирующих в крови.
Катехоламины (адреналин, норадреналин) увеличивают силу и учащают ритм сердечных сокращений, что имеет важное биологическое значение. При физических нагрузках или эмоциональном напряжении мозговой слой надпочечников выбрасывает в кровь большое количество адреналина, что приводит к усилению сердечной деятельности, крайне необходимому в данных условиях.
Указанный эффект возникает в результате стимуляции катехоламинами рецепторов миокарда, вызывающей активацию внутриклеточного фермента аденилатциклазы, которая ускоряет образование 3',5'-циклического аденозинмонофосфата (цАМФ). Он активирует фосфорилазу, вызывающую расщепление внутримышечного гликогена и образование глюкозы (источника энергии для сокращающегося миокарда). Кроме того, фосфорилаза необходима для активации ионов Са2+ — агента, реализующего сопряжение возбуждения и сокращения в миокарде (это также усиливает положительное инотропное действие катехоламинов). Помимо этого, катехоламины повышают проницаемость клеточных мембран для ионов Са2+, способствуя, с одной стороны, усилению поступления их из межклеточного пространства в клетку, а с другой — мобилизации ионов Са2+ из внутриклеточных депо.
Активация аденилатциклазы отмечается в миокарде и при действии глюкагона — гормона, выделяемого α-клетками панкреатических островков, что также вызывает положительный инотропный эффект.
Гормоны коры надпочечников, ангиотензин и серотонин также увеличивают силу сокращений миокарда, а тироксин учащает сердечный ритм. Гипоксемия, гиперкапния и ацидоз угнетают сократительную активность миокарда.
Рефлекторная регуляция деятельности сердца
Осуществляется при участии всех перечисленных отделов ЦНС. Рефлекторные реакции могут как тормозить (замедлять и ослаблять), так и возбуждать (ускорять и усиливать) сердечные сокращения.
Рефлекторные изменения работы сердца возникают при раздражении различных рецепторов. Особое значение в регуляции работы сердца имеют рецепторы, расположенные в некоторых участках сосудистой системы. Эти рецепторы возбуждаются при изменении давления крови в сосудах или при воздействии гуморальных (химических) раздражителей. Участки, где сосредоточены такие рецепторы, получили название сосудистых рефлексогенных зон. Наиболее значительна роль рефлексогенных зон, расположенных в дуге аорты и в области разветвления сонной артерии. Здесь находятся окончания центростремительных нервов, раздражение которых рефлекторно вызывает урежение сердечных сокращений. Эти нервные окончания представляют собой барорецепторы. Естественным их раздражителем служит растяжение сосудистой стенки при повышении давления в тех сосудах, где они расположены. Поток афферентных нервных импульсов от этих рецепторов повышает тонус ядер блуждающих нервов, что приводит к замедлению сердечных сокращений. Чем выше давление крови в сосудистой рефлексогенной зоне, тем чаще возникают афферентные импульсы.
Рефлекторные изменения сердечной деятельности можно вызвать раздражением рецепторов и других кровеносных сосудов. Например, при повышении давления в легочной артерии замедляется работа сердца. Можно изменить сердечную деятельность и путем раздражения рецепторов сосудов многих внутренних органов.
Обнаружены также рецепторы в самом сердце: эндокарде, миокарде и эпикарде; их раздражение рефлекторно изменяет и работу сердца, и тонус сосудов.
В правом предсердии и в устьях полых вен имеются механорецепторы, реагирующие на растяжение (при повышении давления в полости предсердия или в полых венах). Залпы афферентных импульсов от этих рецепторов проходят по центростремительным волокнам блуждающих нервов к группе нейронов ретикулярной формации ствола мозга, получивших название «сердечно-сосудистый центр». Афферентная стимуляция этих нейронов приводит к активации нейронов симпатического отдела автономной нервной системы и вызывает рефлекторное учащение сердечных сокращений. Импульсы, идущие в ЦНС от механорецепторов предсердий, влияют и на работу других органов.
Классический пример вагального рефлекса описал в 60-х годах прошлого века Гольц: легкое поколачивание по желудку и кишечнику лягушки вызывает остановку или замедление сокращений сердца (рис. 7.16). Остановка сердца при ударе по передней брюшной стенке наблюдалась также у человека. Центростремительные пути этого рефлекса идут от желудка и кишечника по чревному нерву в спинной мозг и достигают ядер блуждающих нервов в продолговатом мозге. Отсюда начинаются центробежные пути, образованные ветвями блуждающих нервов, идущими к сердцу. К числу вагальных рефлексов относится также глазосердечный рефлекс Ашнера (урежение сердцебиений на 10—20 в минуту при надавливании на глазные яблоки).
Рефлекторное учащение и усиление сердечной деятельности наблюдаются при болевых раздражениях и эмоциональных состояниях: ярости, гневе, радости, а также при мышечной работе. Изменения сердечной деятельности при этом вызываются импульсами, поступающими к сердцу по симпатическим нервам, а также ослаблением тонуса ядер блуждающих нервов.
11. Клеточные механизмы действия медиаторов сердечных нервов - ацетилхолина и норадреналина - на сократительные клетки миокарда и клетки проводящей системы.
При раздражении периферических отрезков блуждающих нервов в их окончаниях в сердце выделяется АХ, а при раздражении симпатических нервов — норадреналин. Эти вещества являются непосредственными агентами, вызывающими торможение или усиление деятельности сердца, и поэтому получили название медиаторов (передатчиков) нервных влияний. Существование медиаторов было показано Леви (1921). Он раздражал блуждающий или симпатический нерв изолированного сердца лягушки, а затем переносил жидкость из этого сердца в другое, тоже изолированное, но не подвергавшееся нервному влиянию — второе сердце давало такую же реакцию (рис. 7.14, 7.15). Следовательно, при раздражении нервов первого сердца в питающую его жидкость переходит соответствующий медиатор. На нижних кривых можно видеть эффекты, вызываемые перенесенным раствором Рингера, находившимся в сердце во время раздражения.
Получены данные, свидетельствующие о том, что при возбуждении наряду с основным медиаторным веществом в синаптическую щель поступают и другие биологически активные вещества, в частности пептиды. Последние обладают модулирующим действием, изменяя величину и направленность реакции сердца на основной медиатор. Так, опиоидные пептиды угнетают эффекты раздражения блуждающего нерва, а пептид дельта-сна усиливает вагусную брадикардию.
12.Объемная скорость кровотока как основной параметр системы кровообращения. Факторы, определяющие ее величину в покое и при физических нагрузках. Линейная скорость движения крови, скорость кругооборота.
Различают линейную и объемную скорость кровотока. Линейная скорость кровотока (V-лин) это расстояние, которое, проходит частица крови в единицу времени. Она зависит от суммарной площади перечного сечения всех сосудов, образующих участок сосудистого русла. Поэтому в кровеносной системе наиболее узким участком является аорта. Здесь наибольшая линейная скорость кровотока, составляющая 0,5-0,6 м/сек. В артериях среднего и мелкого калибра она снижается до 0,2-0,4 м/сек. Суммарный просвет капиллярного русла в 500-600 раз больше чем аорты, поэтому скорость кровотока в капиллярах уменьшается до 0,5 мм/сек. Замедление тока крови в капиллярах имеет большое физиологическое значение, так как в них происходит транскапиллярный обмен. В крупных венах линейная скорость кровотока вновь возрастает до 0,1-0.2 м/сек. Линейная скорость кровотока в артериях измеряется ультразвуковым методом. Он основан на эффекте Доплера. На сосуд помешают датчик с источником и приемником ультразвука. В движущейся среде - крови частота ультразвуковых колебаний изменяется. Чем больше скорость течения крови по сосуду, тем ниже частота отраженных ультразвуковых волн. Скорость кровотока в капиллярах измеряется под микроскопом с делениями в окуляре, путем наблюдения за движением определенного эритроцита. Объемная скорость кровотока (объём.) это количество крови проходящей через поперечное сечение сосуда за единицу времени. Она зависит от разности давлений в начале и конце сосуда и сопротивления току крови. Объёмная скорость кровотока в сердечно-сосудистой системе составляет 4—6 л/мин, она распределяется по регионам и органам в зависимости от интенсивности их метаболизма в состоянии функционального покоя и при деятельности (при активном состоянии тканей кровоток в них может возрастать в 2—20 раз).
Зная объемную скорость кровотока (количество крови, протекающее через поперечное сечение сосуда), измеряемую в миллилитрах в секунду, можно рассчитать линейную скорость кровотока, которая выражается в сантиметрах в секунду. Линейная скорость (V) отражает скорость продвижения частиц крови вдоль сосуда и равна объемной (Q), деленной на площадь сечения кровеносного сосуда: V=Q/πr2
Линейная скорость, вычисленная по этой формуле, есть средняя скорость. В действительности линейная скорость различна для частиц крови, продвигающихся в центре потока (вдоль продольной оси сосуда) и у сосудистой стенки. В центре сосуда линейная скорость максимальна, около стенки сосуда она минимальна в связи с тем, что здесь особенно велико трение частиц крови о стенку.
Объем крови, протекающей в 1 мин через аорту или полые вены и через легочную артерию или легочные вены, одинаков. Отток крови от сердца соответствует ее притоку. Из этого следует, что объем крови, протекший в 1 мин через всю артериальную и всю венозную систему большого и малого круга кровообращения, одинаков. При постоянном объеме крови, протекающей через любое общее сечение сосудистой системы, линейная скорость кровотока не может быть постоянной. Она зависит от общей ширины данного отдела сосудистого русла. Это следует из уравнения, выражающего соотношение линейной и объемной скорости: чем больше общая площадь сечения сосудов, тем меньше линейная скорость кровотока. В кровеносной системе самым узким местом является аорта. При разветвлении артерий, несмотря на то, что каждая ветвь сосуда уже той, от которой она произошла, наблюдается увеличение суммарного русла, так как сумма просветов артериальных ветвей больше просвета разветвившейся артерии. Наибольшее расширение русла отмечается в капиллярной сети: сумма просветов всех капилляров примерно в 500—600 раз больше просвета аорты. Соответственно этому кровь в капиллярах движется в 500—600 раз медленнее, чем в аорте.
В венах линейная скорость кровотока снова возрастает, так как при слиянии вен друг с другом суммарный просвет кровяного русла суживается. В полых венах линейная скорость кровотока достигает половины скорости в аорте.
Время кругооборота крови. Время полного кругооборота крови — это время, необходимое для того, чтобы она прошла через большой и малый круг кровообращения. Для измерения времени полного кругооборота крови применяют ряд способов, принцип которых заключается в том, что в вену вводят какое-либо вещество, не встречающееся обычно в организме, и определяют, через какой промежуток времени оно появляется в одноименной вене другой стороны. В последние годы скорость кругооборота (или только в малом, или только в большом круге) определяют при помощи радиоактивного изотопа натрия и счетчика электронов. Для этого несколько таких счетчиков помещают на разных частях тела вблизи крупных сосудов и в области сердца. После введения в локтевую вену радиоактивного изотопа натрия определяют время появления радиоактивного излучения в области сердца и исследуемых сосудов. Время полного кругооборота крови у человека составляет в среднем 27 систол сердца. При частоте сердечных сокращений 70—80 в минуту кругооборот крови происходит приблизительно за 20—23 с, однако скорость движения крови по оси сосуда больше, чем у его стенок. Поэтому не вся кровь совершает полный кругооборот так быстро и указанное время является минимальным. Исследования на собаках показали, что 1/5 времени полного кругооборота крови приходится на прохождение крови по малому кругу кровообращения и 4/5 — по большому.
13. Условия возникновения давления крови в сосудистой системе. Динамика изменения сопротивления и давления в сосудистой системе (график). Причины непрерывности тока крови по сосудам.
О сопротивлении в различных сосудах можно судить по разности давления крови в начале и в конце сосуда: чем выше сопротивление току крови, тем большая сила затрачивается на ее продвижение по сосуду и, следовательно, тем значительнее падение давления на протяжении данного сосуда. Как показывают прямые измерения давления крови в разных сосудах, давление на протяжении крупных и средних артерий падает всего на 10%, а в артериолах и капиллярах — на 85%. Это означает, что 10% энергии, затрачиваемой желудочками на изгнание крови, расходуется на продвижение крови в крупных и средних артериях, а 85% — на продвижение крови в артериолах и капиллярах.
|
|
|
Изменения давления в разных частях сосудистой системы. I — в аорте; 2 — в крупных артериях; 3 — в мелких артериях; 4 — в артериолах; 5 — в капиллярах; б — в венулах; 7 — в венах; 8 — в полой вене. Штриховкой обозначено колебание давления в систолу и диастолу, пунктиром — среднее давление. Среднее давление в аорте поддерживается на высоком уровне (примерно 100 мм рт. ст.), поскольку сердце непрестанно перекачивает кровь в аорту. С другой стороны, артериальное давление меняется от систолического уровня 120 мм рт. ст. до диастолического уровня 80 мм рт. ст., поскольку сердце перекачивает кровь в аорту периодически, только во время систолы. По мере продвижения крови в большом круге кровообращения среднее давление неуклонно снижается, и в месте впадения полых вен в правое предсердие оно составляет 0 мм рт. ст. Давление в капиллярах большого круга кровообращения снижается от 35 мм рт. ст. в артериальном конце капилляра до 10 мм рт. ст. в венозном конце капилляра. В среднем «функциональное» давление в большинстве капиллярных сетей составляет 17 мм рт. ст. Этого давления достаточно для перехода небольшого количества плазмы через мелкие поры в капиллярной стенке, в то время как питательные вещества легко диффундируют через эти поры к клеткам близлежащих тканей. Причины непрерывности тока крови по сосудам. Непрерывный ток крови по всей сосудистой системе обусловливают выраженные упругие свойства аорты и крупных артерий. В сердечно-сосудистой системе часть кинетической энергии, развиваемой сердцем во время систолы, затрачивается на растяжение аорты и отходящих от нее крупных артерий. Последние образуют эластическую, или компрессионную, камеру, в которую поступает значительный объем крови, растягивающий ее; при этом кинетическая энергия, развитая сердцем, переходит в энергию эластического напряжения артериальных стенок. Когда систола заканчивается, растянутые стенки артерий стремятся спасаться и проталкивают кровь в капилляры, поддерживая кровоток во время диастолы. |
14.Факторы, обеспечивающие возврат крови к сердцу. Центральное венозное давление.
Факторы, обеспечивающие возврат крови к сердцу
1. Разность давлений в начале и конце венозного русла.
2. Сокращения скелетных мышц при движении, в результате которых кровь выталкивается из периферических вен к правому предсердию.
3. Присасывающее действие грудной клетки. На вдохе давление в ней становится отрицательным, что способствует венозному кровотоку.
4. Присасывающее действие правого предсердия в период его диастолы. Расширение его полости приводит к появлению отрицательного давления в нем.
5. Сокращения гладких мышц вен.
Движение крови по венам к сердцу связано и с тем, что в них имеются выпячивания стенок, которые выполняют роль клапанов.
Под центральным венозным давлением обычно понимают величину давления в правом предсердии, которая в норме близка к 0 мм рт. ст. Однако в действительности центральному венозному давлению соответствует величина давления в устье полых вен. Между давлением в правом предсердии и в устье полых вен далеко не всегда существует соответствие, особенно в фазу переходных процессов в системе кровообращения, когда давление в правом предсердии нормализуется быстрее, чем центральное венозное давление. Уровень центрального венозного давления (ЦВД) оказывает существенное влияние на величину венозного возврата крови к сердцу. При понижении давления в правом предсердии от 0 до 4 мм рт. ст. приток венозной крови возрастает на 20—30 %, но когда давление в нем становится ниже — 4 мм рт. ст., дальнейшее снижение давления не вызывает уже увеличения притока венозной крови, что обусловлено спадением вен, впадающих в грудную клетку, вызванным резким падением давления крови в этих венах. Средняя величина ЦВД у здоровых людей составляет в состоянии мышечного покоя около 40 мм водн. ст. и в течение дня меняется, нарастая днем и особенно к вечеру на 10—30 мм водн. ст., что связано с ходьбой и мышечными движениями. Увеличение внутриплеврального давления, сопровождаемое сокращением мышц брюшной полости (кашель, натужива-ние), приводит к кратковременному резкому возрастанию ЦВД, а задержка дыхания на вдохе — к его временному падению.
При вдохе центральное венозное давление ( ЦВД ) уменьшается за счет падения плеврального давления, что вызывает дополнительное растяжение правого предсердия и более полное заполнение его кровью. При этом возрастает скорость венозного кровотока и увеличивается градиент давления в венах, что приводит к дополнительному падению ЦВД. Так как давление в венах, лежащих вблизи грудной полости (например, в яремных венах), в момент вдоха является отрицательным, их ранение опасно для жизни, поскольку при вдохе в этом случае возможно проникновение в вены воздуха, пузырьки которого, разносясь с кровью, могут закупорить кровеносное русло (развитие воздушной эмболии).
При выдохе центральное венозное давление ( ЦВД ) растет, а венозный возврат крови к сердцу уменьшается. Это является результатом повышения плеврального давления, увеличивающего венозное сопротивление вследствие спадения грудных вен и сдавливающего правое предсердие, что затрудняет его кровенаполнение.
15.Базальный тонус сосудов, его происхождение и регуляция.
Сосуды, лишенные нервных и гуморальных влияний, как оказалось, сохраняют (хотя и в меньшей мере) способность оказывать сопротивление кровотоку. Денервация сосудов скелетных мышц, например, увеличивает кровоток в них примерно в два раза, но последующее введение ацетилхо-лина в кровоток этой сосудистой области может вызвать дальнейшее десятикратное увеличение в ней кровотока, свидетельствующее о сохраняющейся в этом случае способности сосудов к вазодилатации. Для обозначения этой особенности денервированных сосудов оказывать сопротивление кровотоку введено понятие «базальный тонус сосудов».
Базальный тонус сосудов определяется структурными и миогенными факторами. Структурная часть его создается жесткой сосудистой «сумкой», образованной коллагеновыми волокнами, которая определяет сопротивление сосудов, если активность их гладких мышц полностью исключена. Миогенная часть базального тонуса обеспечивается напряжением гладких мышц сосудов в ответ на растягивающее усилие артериального давления.
Следовательно, изменения сопротивления сосудов под влиянием нервных или гуморальных факторов наслаиваются на базальный тонус, который для определенной сосудистой области более или менее постоянен. Если нервные и гуморальные влияния отсутствуют, а нейрогенный компонент сопротивления сосудов равен нулю, сопротивление их кровотоку определяется базальным тонусом.
16. Рефлекторная и гуморальная регуляция тонуса сосудов. Афферентные нервы (И.Ф. Цион, Э. Геринг), сосудодвигательный центр, сосудодвигательные нервы (К. Бернар). Особенности действия норадреналина и адреналина на сосуды различных органов.
Рефлекторная регуляция сосудистого тонуса
По классификации В. Н. Черниговского, рефлекторные изменения тонуса артерий — сосудистые рефлексы — могут быть разделены на две группы: собственные и сопряженные рефлексы.
Собственные сосудистые рефлексы. Вызываются сигналами от рецепторов самих сосудов. Особенно важное физиологическое значение имеют рецепторы, сосредоточенные в дуге аорты и в области разветвления сонной артерии на внутреннюю и наружную. Указанные участки сосудистой системы получили название сосудистых рефлексогенных зон.
Рецепторы, расположенные в дуге аорты, являются окончаниями центростремительных волокон, проходящих в составе аортального нерва. Ционом и Людвигом этот нерв функционально был обозначен как депрессор. Электрическое раздражение центрального конца нерва обусловливает падение АД вследствие рефлекторного повышения тонуса ядер блуждающих нервов и рефлекторного снижения тонуса сосудосуживающего центра. В результате сердечная деятельность тормозится, а сосуды внутренних органов расширяются. Если у подопытного животного, например у кролика, перерезаны блуждающие нервы, то раздражение аортального нерва вызывает только рефлекторное расширение сосудов без замедления сердечного ритма.
В рефлексогенной зоне сонного синуса (каротидный синус, sinus caroticus) расположены рецепторы, от которых идут центростремительные нервные волокна, образующие синокаротидный нерв, или нерв Геринга. Этот нерв вступает в мозг в составе языкоглоточного нерва. При введении в изолированный каротидный синус крови через канюлю под давлением можно наблюдать падение АД в сосудах тела (рис. 7.22). Понижение системного АД обусловлено тем, что растяжение стенки сонной артерии возбуждает рецепторы каротидного синуса, рефлекторно понижает тонус сосудосуживающего центра и повышает тонус ядер блуждающих нервов.
Рецепторы сосудистых рефлексогенных зон возбуждаются при повышении давления крови в сосудах, поэтому их называют прессорецепторами, или барорецепторами. Если перерезать синокаротидные и аортальные нервы с обеих сторон, возникает гипертензия, т. е. устойчивое повышение АД, достигающее в сонной артерии собаки 200—250 мм рт.ст. вместо 100—120 мм рт.ст. в норме.
Понижение АД вследствие, например, уменьшения объема крови в организме (при кровопотерях), ослабления деятельности сердца или при перераспределении крови и оттоке ее в избыточно расширившиеся кровеносные сосуды какого-нибудь крупного органа ведет к тому, что прессорецепторы дуги аорты и сонных артерий раздражаются менее интенсивно, чем при нормальном АД. Влияние аортальных и синокаротидных нервов на нейроны сердечно-сосудистого центра ослабляется, сосуды суживаются, работа сердца усиливается и АД нормализуется. Этот способ регуляции АД представляет собой регуляцию «на выходе» системы, работающую по принципу отрицательной обратной связи. При отклонении АД от заданной величины включаются компенсаторные реакции, восстанавливающие это давление до нормы. Это — регуляция «по рассогласованию».
Существует еще один, принципиально иной, механизм регуляции АД «на выходе» системы, «по возмущению». В данном случае компенсаторные реакции включаются еще до того, как АД изменится, предупреждая отклонение его от нормы. Необходимые для этого реакции запускаются сигналами, возникающими в рецепторах растяжения миокарда и коронарных сосудов, несущих информацию о степени наполнения кровью полостей сердца и артериальной системы. В этом случае регуляторные реакции реализуются через внутрисердечную нервную систему, а также через вегетативные центры ЦНС.
Сосудистые рефлексы можно вызвать, раздражая рецепторы не только дуги аорты или каротидного синуса, но и сосудов некоторых других областей тела. Так, при повышении давления в сосудах легкого, кишечника, селезенки наблюдаются рефлекторные изменения АД в других сосудистых областях.
Рефлекторная регуляция давления крови осуществляется при помощи не только механорецепторов, но и хеморецепторов, чувствительных к изменениям химического состава крови. Такие хеморецепторы сосредоточены в аортальном и сонном гломусе (glomus caroticum, каротидные тельца), т. е. в местах локализации хеморецепторов.
Хеморецепторы чувствительны к СО2 и недостатку кислорода в крови; они раздражаются также СО, цианидами, никотином. От этих рецепторов возбуждение по центростремительным нервным волокнам передается к сосудодвигательному центру и вызывает повышение его тонуса. В результате сосуды суживаются и давление повышается. Одновременно происходит возбуждение дыхательного центра.
Таким образом, возбуждение хеморецепторов аорты и сонной артерии вызывает сосудистые прессорные рефлексы, а раздражение механорецепторов — депрессорные рефлексы.
Хеморецепторы обнаружены также в сосудах селезенки, надпочечников, почек, костного мозга. Они чувствительны к различным химическим соединениям, циркулирующим в крови, например к ацетилхолину, адреналину и др. (В. Н. Черниговский).
Сопряженные сосудистые рефлексы. Это рефлексы, возникающие в других системах и органах, проявляются преимущественно повышением АД. Их можно вызвать, например, раздражением поверхности тела. Так, при болевых раздражениях рефлекторно суживаются сосуды, особенно органов брюшной полости, и АД повышается. Раздражение кожи холодом также вызывает рефлекторное сужение сосудов, главным образом кожных артериол.
Кортикальная регуляция сосудистого тонуса. Влияние коры большого мозга на сосуды было впервые доказано путем раздражения определенных участков коры.
Кортикальные сосудистые реакции у человека изучены методом условных рефлексов. В этих опытах о сужении или расширении сосудов судят по изменению объема руки при плетизмографии. Если сосуды суживаются, то кровенаполнение, а следовательно, и объем органа уменьшаются. При расширении сосудов, наоборот, кровенаполнение и объем органа увеличиваются.
Если многократно сочетать какое-либо раздражение, например согревание, охлаждение или болевое раздражение участка кожи с каким-нибудь индифферентным раздражителем (звуковым, световым и т. п.), то через некоторое число подобных сочетаний один индифферентный раздражитель может вызвать такую же сосудистую реакцию, как и безусловное раздражение.
Сосудистая реакция на ранее индифферентный раздражитель осуществляется условнорефлекторным путем, т. е. при участии коры большого мозга. У человека при этом часто возникает и соответствующее ощущение (холода, тепла или боли), хотя никакого раздражения кожи не было.
Влиянием коры большого мозга объясняется то, что у спортсменов перед началом упражнения или соревнования наблюдается повышение артериального давления, вызванное изменениями деятельности сердца и сосудистого тонуса.
Сосудодвигательный центр
В. Ф. Овсянниковым (1871) было установлено, что нервный центр, обеспечивающий определенную степень сужения артериального русла — сосудодвигательный центр — находится в продолговатом мозге. Локализация этого центра определена путем перерезки ствола мозга на разных уровнях. Если перерезка произведена у собаки или кошки выше четверохолмия, то АД не изменяется. Если перерезать мозг между продолговатым и спинным мозгом, то максимальное давление крови в сонной артерии понижается до 60—70 мм рт.ст. Отсюда следует, что сосудодвигательный центр локализован в продолговатом мозге и находится в состоянии тонической активности, т. е. длительного постоянного возбуждения. Устранение его влияния вызывает расширение сосудов и падение АД.
Более детальный анализ показал, что сосудодвигательный центр продолговатого мозга расположен на дне IV желудочка и состоит из двух отделов — прессорного и депрессорного. Раздражение прессорного отдела сосудодвигательного центра вызывает сужение артерий и подъем, а раздражение второго — расширение артерий и падение АД.
Считают, что депрессорный отдел сосудодвигательного центра вызывает расширение сосудов, понижая тонус прессорного отдела и снижая, таким образом, эффект сосудосуживающих нервов.
Влияния, идущие от сосудосуживающего центра продолговатого мозга, приходят к нервным центрам симпатической части вегетативной нервной системы, расположенным в боковых рогах грудных сегментов спинного мозга, регулирующих тонус сосудов отдельных участков тела. Спинномозговые центры способны через некоторое время после выключения сосудосуживающего центра продолговатого мозга немного повысить давление крови, снизившееся вследствие расширения артерий и артериол.
Гуморальные влияния на сосуды
Одни гуморальные агенты суживают, а другие расширяют просвет артериальных сосудов.
Сосудосуживающие вещества. К ним относятся гормоны мозгового вещества надпочечников — адреналин и норадреналин, а также задней доли гипофиза — вазопрессин.
Адреналин и норадреналин суживают артерии и артериолы кожи, органов брюшной полости и легких, а вазопрессин действует преимущественно на артериолы и капилляры.
Адреналин, норадреналин и вазопрессин оказывают влияние на сосуды в очень малых концентрациях. Так, сужение сосудов у теплокровных животных происходит при концентрации адреналина к крови 1*10 7 г/мл. Сосудосуживающий эффект этих веществ обусловливает резкое повышение АД
К числу гуморальных сосудосуживающих факторов относится серотонин (5-гидроокситриптамин), продуцируемый в слизистой оболочке кишечника и в некоторых участках головного мозга. Серотонин образуется также при распаде тромбоцитов. Физиологическое значение серотонина в данном случае состоит в том, что он суживает сосуды и препятствует кровотечению из пораженного сосуда. Во второй фазе свертывания крови, развивающейся после образования тромба, серотонин расширяет сосуды.
Особый сосудосуживающий фактор — ренин, образуется в почках, причем тем в большем количестве, чем ниже кровоснабжение почек. По этой причине после частичного сдавливания почечных артерий у животных возникает стойкое повышение артериального давления, обусловленное сужением артериол. Ренин представляет собой протеолитический фермент. Сам ренин не вызывает сужения сосудов, но, поступая в кровь, расщепляет α2-глобулин плазмы — ангиотензиноген и превращает его в относительно малоактивный дека-пептид — ангиотензин I. Последний под влиянием фермента дипептидкарбоксипептидазы превращается в очень активное сосудосуживающее вещество ангиотензин II. Ангиотензин II быстро разрушается в капиллярах ангиотензиназой.
Сосудорасширяющие вещества. В почках образуется также и сосудорасширяющее вещество, названное медуллином (вырабатывается в мозговом слое почки). Это вещество представляет собой липид.
В настоящее время известно образование во многих тканях тела ряда сосудорасширяющих веществ, получивших название простагландинов. Такое название дано потому, что впервые эти-вещества были найдены в семенной жидкости у мужчин и предполагалось, что их образует предстательная железа. Простагландины представляют собой производные ненасыщенных жирных кислот.
Из подчелюстной, поджелудочной желез, из легких и некоторых других органов получен активный сосудорасширяющий полипептид брадикинин. Он вызывает расслабление гладкой мускулатуры артериол и понижает уровень АД. Брадикинин появляется в коже при действии тепла и является одним из факторов, обусловливающих расширение сосудов при нагревании. Он образуется при расщеплении одного из глобулинов плазмы крови под влиянием находящегося в тканях фермента калликреина.
К сосудорасширяющим веществам относится ацетилхолин (АХ), который образуется в окончаниях парасимпатических нервов и симпатических вазодилататоров. Он быстро разрушается в крови, поэтому его действие на сосуды в физиологических условиях чисто местное.
Сосудорасширяющим веществом является также гистамин — вещество, образующееся в слизистой оболочке желудка и кишечника, а также во многих других органах, в частности в коже при ее раздражении и в скелетной мускулатуре во время работы. Гистамин расширяет артериолы и увеличивает кровенаполнение капилляров. При введении 1—2 мг гистамина в вену кошке, несмотря на то что сердце продолжает работать с прежней силой, уровень АД резко падает вследствие уменьшения притока крови к сердцу: очень большое количество крови животного оказывается сосредоточенным в капиллярах, главным образом брюшной полости. Снижение АД и нарушение кровообращения при этом подобны тем, какие возникают при большой кровопотере. Они сопровождаются нарушением деятельности ЦНС вследствие расстройства мозгового кровообращения. Совокупность перечисленных явлений объединяется понятием «шок». Тяжелые нарушения, возникающие в организме при введении больших доз гистамина, называют гистаминовым шоком.
17. Кровяное давление, его виды: систолическое, диастолическое, пульсовое, среднее, центральное (системное) и периферическое (органное); артериальное и венозное.
Кровяное давление - давление внутри кровеносных сосудов (внутри артерий - артериальное давление, внутри капилляров - капиллярное и внутри вен - венозное). Обеспечивает возможность продвижения крови по кровеносной системе и тем самым осуществление обменных процессов в тканях организма.
Артериальное давление — это давление крови в крупных артериях человека; это сила, с которой поток крови оказывает давление на стенки артерий. Различают два показателя артериального давления:
Систолическое (верхнее) артериальное давление — это уровень давления крови в момент максимального сокращения сердца.
Диастолическое (нижнее) артериальное давление — это уровень давления крови в момент максимального расслабления сердца. Артериальное давление измеряется в миллиметрах ртутного столба, сокращенно мм рт. ст. Значение величины артериального давления 120/80 означает, что величина систолического (верхнего) давления равна 120 мм рт. ст., а величина диастолического (нижнего) артериального давления равна 80 мм рт. ст.
Разность между систолическим и диастолическим давлением, т. е. амплитуда колебаний давления, называется пульсовым давлением. Пульсовое давление при прочих равных условиях пропорционально количеству крови, выбрасываемой сердцем при каждой систоле.
Среднее артериальное давление представляет собой ту среднюю величину давления, при которой в отсутствие пульсовых колебаний наблюдается такой же гемодинамический эффект, как и при естественном пульсирующим давлении крови, т. е. среднее артериальное давление — это равнодействующая всех изменений давления в сосудах.
В клинической практике АД определяют обычно в плечевой артерии. У здоровых людей в возрасте 15—50 лет максимальное давление, измеренное способом Короткова, составляет 110—125 мм рт.ст. В возрасте старше 50 лет оно, как правило, повышается. У 60-летних максимальное давление равно в среднем 135—140 мм рт.ст. У новорожденных максимальное артериальное давление 50 мм рт.ст., но уже через несколько дней становится 70 мм рт.ст. и к концу 1-го месяца жизни — 80 мм рт.ст.
Минимальное артериальное давление у взрослых людей среднего возраста в плечевой артерии в среднем равно 60—80 мм рт.ст., пульсовое составляет 35—50 мм рт.ст., а среднее — 90—95 мм рт.ст.
Венозное давление - давление, которое кровь, находящаяся в просвете вены, оказывает на ее стенку: величина В. д. зависит от калибра вены, тонуса ее стенок, объемной скорости кровотока и величины внутригрудного давления.
18.Артериальное давление как одна из физиологических констант организма. Анализ периферических и центральных компонентов системы саморегуляции артериального давления.
Артериальное давление (АД) – это давление внутри кровеносных сосудов, благодаря которому осуществляется движение крови по ним.
Артериальное давление измеряют при оценке общего состояния организма, так как оно является одним из важнейших показателей состояния и функционирования сердечно-сосудистой системы. Измерение осуществляется различными способами, чаще всего с помощью специального медицинского прибора – тонометра, который определяет и верхнее, и нижнее давление, а также – некоторые модели – пульс.
Различают систолическое (верхнее) и диастолическое (нижнее) давления. У здорового человека АД составляет 120/80 мм рт. ст. с небольшими колебаниями (показатели различаются в зависимости от близости сосудов к сердцу – чем ближе к нему, тем выше). В норме давление человека характеризуется устойчивостью и регулируется организмом самостоятельно, в первую очередь, за этим следит вегетативная нервная система. При изменении внешних условий, которые также влияют на характер артериального давления, в организме срабатывает механизм саморегуляции давления – идет сигнал о необходимости возвращения уровня давления до физиологической нормы.
Высота артериального давления зависит от множества факторов:
от частоты сокращений сердца, которое гонит кровь по сосудам,
от качества стенок сосудов (их эластичность), которые оказывают крови сопротивление,
от объема циркулирующей крови и ее вязкости,
от психологического состояния человека,
от употребления некоторой пищи (например, кофе, колы), приема лекарственных препаратов.
от времени суток и др.
В некоторых ситуациях артериальное давление изменяется по физиологическим причинам: например, повышается в стрессовой ситуации или понижается во время сна. Кроме того, у некоторых людей оно может быть немного повышенным или пониженным от природы. Низкое давление в норме также отмечается у всех новорожденных, у многих подростков в период полового созревания. Однако часто подобные изменения носят патологический характер и являются признаками нарушений в организме и симптомами различных заболеваний, требующих профессиональной поддержки.
19.Общее количество капилляров. Количество функционирующих капилляров. Емкость капиллярного русла. Механизмы мерцания капилляров.
Капилляры представляют собой тончайшие сосуды, диаметром 5—7 мкм, длиной 0,5—1,1 мм. Эти сосуды пролегают в межклеточных пространствах, тесно соприкасаясь с клетками органов и тканей организма. Суммарная длина всех капилляров тела человека составляет около 100 000 км, т. е. нить, которой можно было бы 3 раза опоясать земной шар по экватору. Физиологическое значение капилляров состоит в том, что через их стенки осуществляется обмен веществ между кровью и тканями. Стенки капилляров образованы только одним слоем клеток эндотелия, снаружи которого находится тонкая соединительнотканная базальная мембрана.
Скорость кровотока в капиллярах невелика и составляет 0,5— 1 мм/с. Таким образом, каждая частица крови находится в капилляре примерно 1 с. Небольшая толщина слоя крови (7—8 мкм) и тесный контакт его с клетками органов и тканей, а также непрерывная смена крови в капиллярах обеспечивают возможность обмена веществ между кровью и тканевой (межклеточной) жидкостью.
В тканях, отличающихся интенсивным обменом веществ, число капилляров на 1 мм2 поперечного сечения больше, чем в тканях, в которых обмен веществ менее интенсивный. Так, в сердце на 1 мм2 сечения в 2 раза больше капилляров, чем в скелетной мышце. В сером веществе мозга, где много клеточных элементов, капиллярная сеть значительно более густая, чем в белом.
Различают два вида функционирующих капилляров. Одни из них образуют кратчайший путь между артериолами и венулами (магистральные капилляры). Другие представляют собой боковые ответвления от первых: они отходят от артериального конца магистральных капилляров и впадают в их венозный конец. Эти боковые ответвления образуют капиллярные сети. Объемная и линейная скорость кровотока в магистральных капиллярах больше, чем в боковых ответвлениях. Магистральные капилляры играют важную роль в распределении крови в капиллярных сетях и в других феноменах микроциркуляции.
Давление крови в капиллярах измеряют прямым способом: под контролем бинокулярного микроскопа в капилляр вводят тончайшую канюлю, соединенную с электроманометром. У человека давление на артериальном конце капилляра равно 32 мм рт.ст., а на венозном — 15 мм рт.ст., на вершине петли капилляра ногтевого ложа — 24 мм рт.ст. В капиллярах почечных клубочков давление достигает 65— 70 мм рт.ст., а в капиллярах, оплетающих почечные канальцы, — всего 14—18 мм рт.ст. Очень невелико давление в капиллярах легких — в среднем 6 мм рт.ст. Измерение капиллярного давления производят в положении тела, при котором капилляры исследуемой области находятся на одном уровне с сердцем. В случае расширения артериол давление в капиллярах повышается, а при сужении понижается.
Кровь течет лишь в «дежурных» капиллярах. Часть капилляров выключена из кровообращения. В период интенсивной деятельности органов (например, при сокращении мышц или секреторной активности желез), когда обмен веществ в них усиливается, количество функционирующих капилляров значительно возрастает.
Регулирование капиллярного кровообращения нервной системой, влияние на него физиологически активных веществ — гормонов и метаболитов — осуществляются при воздействии их на артерии и артериолы. Сужение или расширение артерий и артериол изменяет как количество функционирующих капилляров, распределение крови в ветвящейся капиллярной сети, так и состав крови, протекающей по капиллярам, т. е. соотношение эритроцитов и плазмы. При этом общий кровоток через метартериолы и капилляры определяется сокращением гладких мышечных клеток артериол, а степень сокращения прекапиллярных сфинктеров (гладких мышечных клеток, расположенных у устья капилляра при его отхождении от метаартериол) определяет, какая часть крови пройдет через истинные капилляры.
В некоторых участках тела, например в коже, легких и почках, имеются непосредственные соединения артериол и венул — артериовенозные анастомозы. Это наиболее короткий путь между артериолами и венулами. В обычных условиях анастомозы закрыты и кровь проходит через капиллярную сеть. Если анастомозы открываются, то часть крови может поступать в вены, минуя капилляры.
Артериовенозные анастомозы играют роль шунтов, регулирующих капиллярное кровообращение. Примером этого является изменение капиллярного кровообращения в коже при повышении (свыше 35°С) или понижении (ниже 15°С) температуры окружающей среды. Анастомозы в коже открываются и устанавливается ток крови из артериол непосредственно в вены, что играет большую роль в процессах терморегуляции.
Структурной и функциональной единицей кровотока в мелких сосудах является сосудистый модуль — относительно обособленный в гемодинамическом отношении комплекс микрососудов, снабжающий кровью определенную клеточную популяцию органа. При этом имеет место специфичность васкуляризации тканей различных органов, что проявляется в особенностях ветвления микрососудов, плотности капилляризации тканей и др. Наличие модулей позволяет регулировать локальный кровоток в отдельных микроучастках тканей.
Механизм активного расширения и сужения капилляров до сих пор еще представляет нерешенную проблему. Предполагается, что явление ритмического расширения и сжатия капилляров может быть обусловлено, во-первых, нервными импульсами, а во-вторых, они могут возникать под влиянием веществ, образующихся в тканях, окружающих капилляры, или, другими словами, в результате гуморальных воздействий.
Изучая расширение и сужение капилляров, исследователь прежде всего сталкивается с фактом, что никаких двигательных волокон, которые можно найти даже у самых мелких артериол, капилляры не получают. Вокруг капилляров в окружающей их соединительной ткани можно видеть очень богатую сеть нервных окончаний, развертывающихся между адвентипиальными клетками иногда даже в непосредственной близости к эндотелиальной стенке. Откуда идут эти волокна, пока не установлено; вероятнее всего, они чувствительной природы.
Раздражая электрическим током какое-либо окончание чувствительного нерва, можно наблюдать, что в соседних участках сейчас же произойдет расширение капилляров. Получается впечатление,что нервный импульс распространился с чувствительного волокна по сети нервных окончаний и вызвал это расширение. Такое распространение возбуждения называется антидромным, а все явления передачи импульса с периферии на соседние участки по конечным отросткам получили название аксонного рефлекса
20. Морфофункциональные особенности микроциркуляторного русла. Транскапиллярный обмен.
Микроциркуляторное русло включает в себя следующие компоненты:
артериолы;
прекапилляры;
капилляры;
посткапилляры;
венулы;
артериоло-венулярные анастомозы.
Функции микроциркуляторного русла состоят в следующем:
трофическая и дыхательная функции, так как обменная поверхность капилляров и венул составляет 1000 м2, или 1,5 м2 на 100 г ткани;
депонирующая функция, так как в сосудах микроциркуляторного русла в состоянии покоя депонируется значительная часть крови, которая во время физической работы включается в кровоток;
дренажная функция, так как микроциркуляторное русло собирает кровь из приносящих артерий и распределяет ее по органу;
регуляция кровотока в органе, эту функцию выполняют артериолы благодаря наличию в них сфинктеров;
транспортная функция, то есть транспорт крови.
В микроциркуляторном русле различают три звена:
артериальное (артериолы прекапилляры);
капиллярное;
венозное (посткапилляры, собирательные и мышечные венулы).
Артериолы имеют диаметр 50-100 мкм. В их строении сохраняются три оболочки, но они выражены слабее, чем в артериях. В области отхождения от артериолы капилляра находится гладкомышечный сфинктер, который регулирует кровоток. Этот участок называется прекапилляром.
Капилляры - это самые мелкие сосуды, они различаются по размерам на:
узкий тип 4-7 мкм;
обычный или соматический тип 7-11 мкм;
синусоидный тип 20-30 мкм;
лакунарный тип 50-70 мкм.
В их строении прослеживается слоистый принцип. Внутренний слой образован эндотелием. Эндотелиальный слой капилляра - аналог внутренней оболочки. Он лежит на базальной мембране, которая вначале расщепляется на два листка, а затем соединяется. В результате образуется полость, в которой лежат клетки перициты. На этих клетках на этих клетках заканчиваются вегетативные нервные окончания, под регулирующим действием которых клетки могут накапливать воду, увеличиваться в размере и закрывать просвет капилляра. При удалении из клеток воды они уменьшаются в размерах, и просвет капилляров открывается. Функции перицитов:
изменение просвета капилляров;
источник гладкомышечных клеток;
контроль пролиферации эндотелиальных клеток при регенерации капилляра;
синтез компонентов базальной мембраны;
фагоцитарная функция.
Для капилляров характерна органная специфичность, в связи с чем выделяют три типа капилляров:
капилляры соматического типа или непрерывные, они находятся в коже, мышцах, головном мозге, спинном мозге. Для них характерен непрерывный эндотелий и непрерывная базальная мембрана;
капилляры фенестрированного или висцерального типа (локализация - внутренние органы и эндокринные железы). Для них характерно наличие в эндотелии сужений - фенестр и непрерывной базальной мембраны;
капилляры прерывистого или синусоидного типа (красный костный мозг, селезенка, печень). В эндотелии этих капилляров имеются истинные отверстия, есть они и в базальной мембране, которая может вообще отсутствовать. Иногда к капиллярам относят лакуны - крупные сосуды со строением стенки как в капилляре (пещеристые тела полового члена).
Венулы делятся на:
посткапиллярные;
собирательные;
мышечные.
Посткапиллярные венулы образуются в результате слияния нескольких капилляров, имеют такое же строение, как и капилляр, но больший диаметр (12-30 мкм) и большое количество перицитов. В собирательных венулах (диаметр 30-50 мкм), которые образуются при слиянии нескольких посткапиллярных венул, уже имеются две выраженные оболочки: внутренняя (эндотелиальный и подэндотелиальный слои) и наружная - рыхлая волокнистая неоформленная соединительная ткань. Гладкие миоциты появляются только в крупных венулах, достигающих диаметра 50 мкм. Эти венулы называются мышечными и имеют диаметр до 100 мкм. Гладкие миоциты в них, однако, не имеют строгой ориентации и формируют один слой.
Артериоло-венулярные анастомозы или шунты - это вид сосудов микроциркуляторного русла, по которым кровь из артериол попадает в венулы, минуя капилляры. Это необходимо, например, в коже для терморегуляции. Все артериоло-венулярные анастомозы делятся на два типа:
истинные - простые и сложные;
атипичные анастомозы или полушунты.
В простых анастомозах отсутствуют сократительные элементы, и кровоток в них регулируется за счет сфинктера, расположенного в артериолах в месте отхождения анастомоза. В сложных анастомозах в стенке есть элементы, регулирующие их просвет и интенсивность кровотока через анастомоз. Сложные анастомозы делятся на анастомозы гломусного типа и анастомозы типа замыкающих артерий. В анастомозах типа замыкающих артерий во внутренней оболочке имеются скопления расположенных продольно гладких миоцитов. Их сокращение приводит к выпячиванию стенки в виде подушки в просвет анастомоза и закрытию его. В анастомозах типа гломуса (клубочек) в стенке есть скопление эпителиоидных Е-клеток (имеют вид эпителия), способных насасывать воду, увеличиваться в размерах и закрывать просвет анастомоза. При отдаче воды клетки уменьшаются в размерах, и просвет открывается.
В полушунтах в стенке отсутствуют сократительные элементы, ширина их просвета не регулируется. В них может забрасываться венозная кровь из венул, поэтому в полушунтах, в отличии от шунтов, течет смешанная кровь. Анастомозы выполняют функцию перераспределения крови, регуляции артериального давления.
Транскапиллярный обмен - обмен веществ между кровью капилляров и органами, тканями.
В капиллярах благоприятные условия:
медленное движение крови;
различное давление в артериальном и венозном отделах капиллярах;
проницаемость сосудистой стенки.
Транскапиллярный обмен осуществляется за счёт:
диффузии;
фильтрации;
активного транспорта;
пиноцитоза.
Диффузия - пассивный транспорт веществ через стенку по градиенту концентрации; ионы, минеральные вещества, вещества растворимые в воде. В капиллярах 2-х сторонняя диффузия. Облегчённая диффузия - образуется комплекс с молекулой-перносчиком и осуществляется диффузия по коэфициэнту концентрации этих комплексов. Диффузией обладает СО2 и О2. Они растворяются в липидах и затем диффундируют по всей поверхности стенок капилляров. Газовый состав крови, после прохождения через капилляры, меняется в 30-40 раз.
Фильтрация - пассивный транспорт, осуществляемый за счёт разности давлений. Таким образом, происходит движение воды и растворённых в ней веществ.
В процессе фильтрации участвуют 4 силы.
Гидростатическое давление крови - способствует фильтрации (Р г/кр).
Гидростатическое давление межтканевой жидкости - препятствует фильтрации. (Р г/межтк. ж).
Онкотическое давление крови - создаётся белками крови, которые удерживают жидкую часть крови в сосудах - препятствуют фильтрации. (Р омк/кр).
Онкотическое давление межтканевой жидкости. Р омк/межтк. Р онкотическое в капиллярах - Р онкотическое в межтканевой жидкости = сила, прерятствующая фильтрации.
Сила фильтрации = (Р г/кр - Р г/межтк. ж) - (Р онк/кр - Р межтк. ж.); Чем больше Р г/кр, тем больше сила фильтрации. Р г/кр легко меняется, остальные 3 величины - почти постоянные.
Фильтрация воды осуществляется через щели между эндотелиоцитами. Фильтрация жиров - по всей поверхности капилляров.
Активный транспорт - с помощью мелких переносчиков, с затратой энергии. Таким образом, транспортируются отдельные аминокислоты, углеводы и др. вещества. Активный транспорт часто связан с транспортом Na+. Т. е. вещество образует комплекс с молекулой переносчиком Na+.
Пиноцитоз - микровезикулярный транспорт. Внутри эндотелиоцитов есть везикулы, которые захватывают вещество у наружной поверхности клетки и транспортируют их к внутренней поверхности. В некоторых эндотелиоцитах микровезикулы выстраиваются, образуя микроканал, по которым осуществляется транспорт. Таким образом, транспортируются отдельные белки.
Факторы влияющие на транскапиллярный обмен.
Проницаемость стенки капилляра. (Р г/кр - Р г/межтк. жидк).
Разность концентрации различных веществ.
Наличие веществ-переносчиков.
Дыхание