
- •Лекция № 1 классификация органических соединений
- •Лекция № 2
- •Лекция № 3 Изомерия
- •2. Пространственная изомерия (стереохимия)
- •2.1. Конформации (поворотная изомерия)
- •Диаграмма потенциальной энергии конформаций этана.
- •Диаграмма потенциальной энергии конформаций н-бутана.
- •2.2. Геометрическая изомерия
- •2.3. Оптическая изомерия (энантиомерия)
- •Проекционные формулы
- •2.4. Диастереомерия
- •2.5. Методы получения стереоизомеров
- •Лекция № 4 органические кислоты и основания
- •Протонная теория кислот и оснований Брёнстеда
- •Классификация органических кислот и оснований
- •Влияние структурных факторов на относительную силу кислот и оснований
- •Влияние строения на силу кислот и оснований.
- •Кислоты и основания Льюиса
- •Классификация органических реакций и реагентов
- •Углеводороды
- •2. Сульфохлорирование
- •3. Нитрование
- •4. Окисление
- •1.1. Методы получения
- •1.2. Химические свойства
- •1. Реакции электрофильного присоединения
- •Методы получения сопряженных диенов
- •Химические свойства сопряженных диенов
- •Методы получения
- •Химические свойства
- •Методы получения
- •Химические свойства
- •1. Реакции электрофильного замещения.
- •2.2. Реакции с участием боковых цепей алкилбензолов.
- •2.3. Реакции с разрушением ароматической системы.
- •Галогенпроизводные
- •1. Методы получения
- •2. Химические свойства
- •2.1. Реакции нуклеофильного замещения
- •2.2. Реакции элиминирования
- •Альдегиды и кетоны
- •1. Методы получения.
- •2. Химические свойства.
- •2.1. Реакции нуклеофильного присоединения.
- •2.2. Реакции по α -углеродному атому.
- •2.3. Реакции окисления и восстановления
- •Гидроксилпроизводные углеводородов
- •1. Методы получения спиртов.
- •2. Химические свойства спиртов.
- •3. Многоатомные спирты.
- •4. Фенолы. Методы получения.
- •5. Фенолы. Химические свойства.
- •6. Простые эфиры
- •Химические свойства
- •Карбоновые кислоты
- •1. Методы получения
- •2. Химические свойства
- •2.1. Кислотные свойства
- •2.2. Реакции нуклеофильного замещения. Функциональные производные карбоновых кислот.
- •2.3. Реакции по α -углеродному атому
- •2.4. Декарбоксилирование
- •2.5. Восстановление.
- •3. Дикарбоновые кислоты
- •Гидрокси- и оксокислоты
- •1. Гидроксикислоты
- •Методы получения
- •1.2. Химические свойства.
- •1.3. Биологически важные гидроксикислоты.
- •2. Оксокислоты
- •1. Классификация
- •2. Методы получения.
- •3. Химические свойства.
- •Гетероциклические соединения
- •1. Классификация
- •Пятичленные азотсодержащие гетероциклы с одним гетероатомом Пиррол
- •Шестичленные азотсодержащие гетероциклы с одним гетероатомом. Пиридин
- •Пяти- и шестичленные гетероциклы с двумя атомами азота. Имидазол. Пиразол.
- •Пиримидин
- •Лекция № 16 аминокислоты. Пептиды
- •1. Методы получения
- •2. Химические свойства
- •2.1. Кислотно-основные свойства
- •2.2. Реакции по аминогруппе
- •2.3. Реакции по карбоксильной группе
- •2.4. Специфические реакции аминокислот
- •Пептиды
1.1. Методы получения
Крекинг алканов
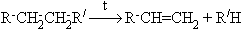
Дегидрирование алканов

Дегидратация спиртов
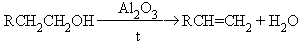
Дегидрогалогенирование галогеналканов

Дегалогенирование вицинальных дигалогенидов
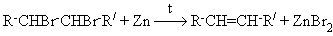
1.2. Химические свойства
Химические свойства алкенов определяются наличием связи С=С. π -Связь обладает меньшей энергией, чем σ -связи. Энергия двойной связи (611 кДж/моль) меньше удвоенной энергии простой связи (703 кДж/моль). Связь С=С неполярна, но обладает большей поляризуемостью, чем σ -связи. Поэтому она легко разрывается под действием электрофильных (AE реакции) и радикальных (AR реакции) реагентов. Кроме того, π -связь оказывает влияние на реакционную способность связи С-Н в аллильном положении, что делает возможным протекание реакций радикального замещения атома водорода.
Таким образом, молекулы алкенов содержат два основных реакционных центра – связь С=С и связь С-Н в аллильном положении:
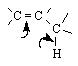
Основные типы реакций алкенов:
1. Реакции электрофильного присоединения
AE реакции – основной тип превращений алкенов. По электрофильному механизму к алкенам могут присоединяться галогены, галогеноводороды, серная кислота, вода и другие электрофильные реагенты.
Общий механизм реакции включает ряд последовательных стадий:
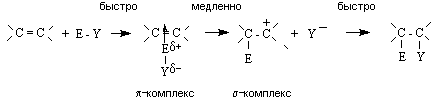
На первой стадии электрофил образует π -комплекс с алкеном, в котором двойная связь выступает как донор, а электрофил как акцептор электронов. Далее π -комплекс медленно перегруппировывается в карбокатион (σ -комплекс). На последней стадии происходит быстрое взаимодействие карбокатиона с нуклеофилом (Y -) с образованием продукта присоединения. Скорость-определяющей стадией процесса является стадия образования π -комплекса. Ее скорость, а, следовательно, и скорость процесса в целом, зависит от стабильности интермедиата – карбокатиона, который близок по энергии к переходному состоянию лимитирующей стадии.
Стабильность карбокатионов возрастает в ряду:
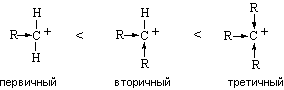
Электронодонорные заместители (алкильные группы) увеличивают реакционную способность алкенов, так как повышают электронную плотность двойной связи и стабилизируют карбокатион. Электроноакцепторные заместители действуют в противоположном направлении:
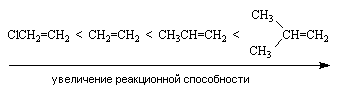
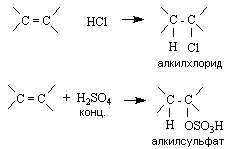
Присоединение протонных кислот
Галогеноводороды и концентрированная серная кислота взаимодействуют с алкенами с образованием соответственно алкилгалогенидов и алкилсульфатов:
Реакционная способность кислот зависит от их силы и возрастает в ряду: HF < HCl < HBr < HI
При присоединении кислот к несимметрично замещенным алкенам реакция протекает региоселективно. Согласно правилу Марковникова, водород присоединяется к наиболее гидрированному атому углерода:
R-CH=CH2 + HCl → R-CHCl-CH3
Направление присоединения определяется поляризацией двойной связи и относительной стабильностью образующихся карбокатионов:
![]()
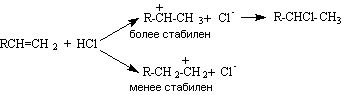
Правило Марковникова не является универсальным. Оно может нарушаться в случае изменения механизма реакции, а также при присоединении кислот к алкенам, содержащим электроноакцепторные заместители, обладающие –I-эффектом (CF3, +N(CH3)3 ) или –I- и –М-эффектами (CHO, COOH, CN), например:
CF3CH=CH2 + HCl → CF3CH2CH2Cl
В этом случае реакция также протекает в направлении образования наименее дестабилизированного интермедиата, которым является первичный карбокатион, так как в нем электроноакцепторный заместитель не расположен в непосредственной близости от положительно заряженного атома углерода:
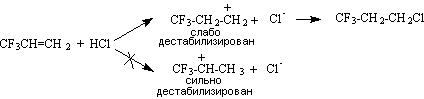
С учетом приведенных фактов можно сформулировать следующее правило:
Электрофильное присоединение несимметричных реагентов к несимметричным алкенам протекает в направлении образования наиболее стабильного карбокатиона.
Это правило позволяет предсказать строение продуктов присоединения к алкенам не только соединений типа HX, но и других несимметричных реагентов (ICl, HOCl).
2. Гидратация алкенов
Алкены присоединяют воду в присутствии протонных кислот в качестве катализаторов. При этом образуются спирты. Присоединение происходит в соответствии с правилом Марковникова.
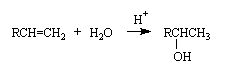
Реакция используется для получения вторичных и третичных спиртов.
3. Присоединение галогенов
Галогены легко присоединяются к алкенам с образованием вицинальных дигалогенидов, например:
RCH=CH2 + Br2 → RCHBrCH2Br
Реакционная способность галогенов возрастает в ряду: I2 < Br2 < Cl2 < F2. Присоединения брома используют как качественную реакцию на двойную связь.
4. Реакции радикального присоединения
Реакции присоединения по радикальному механизму протекают против правила Марковникова.
![]()
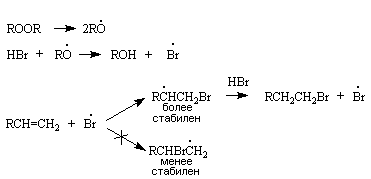
Образуется продукт, которому предшествует более стабильный свободный радикал. Реакция характерна только для HBr. В случае НСl и HI радикальный процесс энергетически не выгоден.
5. Реакции окисления связи С = С
Алкены легко окисляются. Состав продуктов окисления зависит от окислителя и условий проведения реакции.
Эпоксидирование
Алкены взаимодействуют с надкислотами, кислородом в присутствии катализатора с образованием эпоксидов:
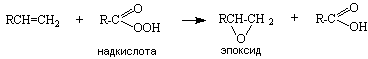
Эпоксиды обладают высокой реакционной способностью и являются ценными продуктами в промышленном органическом синтезе. Предполагают, что эпоксиды являются первичными продуктами ферментативного окисления кислородом связей С=С, в том числе и в конденсированных ароматических углеводородах.
Окисление перманганатом калия
Алкены окисляются перманганатом калия в нейтральной среде при комнатной температуре с образованием двухатомных спиртов:
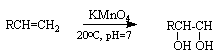
Реакция используется как тест на присутствие в соединении С=С связи (реакция Вагнера).
Окисление KMnO4 в более жестких условиях (кислая среда, нагревание) протекает с расщеплением углеродного скелета и образованием кетонов и (или) кислот.
Озонолиз
Алкены взаимодействуют с озоном с образованием озонидов, при гидролизе которых образуются карбонильные соединения и пероксид водорода:

Состав продуктов озонолиза позволяет установить положение двойной связи в исходном алкене. Гидролиз озонида обычно проводят в присутствии восстановителей (Zn), чтобы избежать окисления альдегидов пероксидом водорода.
6. Реакции по аллильному положению
Галогенирование
Хлорирование пропена хлором при высоких температурах дает продукт замещения, а не присоединения:
![]()
Реакция протекает по радикальному механизму.
2. А л к а д и е н ы
Алкадиены – это углеводороды состава СnH2n-2, содержащие две связи С=С. В зависимости от взаимного расположения двойных связей алкадиены делят на три типа:
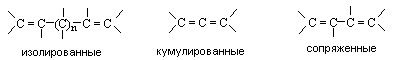
Диены с изолированными связями по своим свойствам мало отличаются от алкенов. Кумулированные и сопряженные диены обладают рядом специфических свойств. Наибольший интерес представляют сопряженные диены.
