
Гончарук Е.И. Коммунальная гигиена 2006
.pdf
ВОДОПРОВОД ИЗ ПОВЕРХНОСТНЫХ ИСТОЧНИКОВ ВОДОСНАБЖЕНИЯ
ответственно осуществляется концентрированными в достаточной мере раст ворами кислот и оснований.
Опресненные воды обычно не совсем пригодны для питья, что обуслов ливает потребность в соответственном их кондиционировании: улучшении органолептических свойств, доочистке, коррекции макро- и микроэлементного состава, обеззараживании. Санитарно-технические требования к качеству на чальных и опресненных вод, а также к применению различных методов опрес нения высокоминерализованных вод для питьевых целей отражены в документе ВОЗ "Гигиенические аспекты опреснения воды", 1980 г. ("Guideliness on Health Aspects of Water Desalination", Sidorenko G.I., Rachmanin Y.A. WHO, Geneva, ETS/80.4. — 60 p.).
Дезактивация. Коагуляция, отстаивание и фильтрация воды на водопро водах снижает содержание радиоактивных веществ в ней на 70—80%. С целью более глубокой дезактивации воду фильтруют через катионо- и анионообменные смолы.
Дефторирование воды. Показания к использованию этого метода — по вышенное (свыше 1,5 мг/л) содержание фтора в воде и большое количество среди населения больных флюорозом зубов II и выше степеней. Дефторирова ние воды показано лишь тогда, когда для оздоровления эндемического очага флюороза невозможно изменить источник водоснабжения или разбавлять его воду водой с низкой концентрацией фтора.
При дефторировании концентрацию фтора в воде доводят до оптимальной для определенной местности. Для удаления из воды избытка фтора предложено множество методов, которые можно разделить на реагентные (методы осажде ния) и фильтрационные. Реагентные методы основываются на сорбции фтора свежеосажденными алюминия или магния гидроксидами. Этот метод рекоме ндуется для обработки поверхностных вод, так как, кроме фторирования, до стигается еще и осветление, и обесцвечивание.
Очищение воды от излишка фтора можно проводить при помощи ее фильт рования через анионообменные смолы:
Вкачестве ионообменного материала часто используют активированный
игранулированный алюминия оксид. Иногда уменьшить содержание фтора в воде можно за счет разведения ее водой из источника с минимальным количест вом фтора.
Фторирование воды. Выбор дозы фтора должен обеспечить противокариозный эффект. Однако, если содержание фтор-иона в воде превышает 1,5—2,0 мг/л, это приведет к поражению населения флюорозом. Вот почему во время фторирования воды содержание в ней фтор-иона должно быть в преде лах 70—80% от максимальных уровней в соответствии с разными климатичес кими районами — в пределах 0,7—1,5 мг/л.
Для фторирования питьевой воды можно использовать фторсодержащие соединения, в частности кремниефтористый натрий (Na2SiF6), кремниефто-
161

РАЗДЕЛ I. ГИГИЕНА ВОДЫ И ВОДОСНАБЖЕНИЯ НАСЕЛЕННЫХ МЕСТ
ристую кислоту H2SiF6, натрия фторид (NaF), кремниефтористый аммоний (NH4)2SiF6, кальция фторид (CaF2), фтористоводородную кислоту (HF) и т. п.1 Есть два способа фторирования воды: на протяжении года одной дозой и посезонно зимней и летней дозами. В первом случае на протяжении года доба вляют одинаковую дозу фтора, которая отвечает климатическим условиям на селенного пункта. Если доза изменяется в зависимости от сезона года, то в хо лодный период, когда среднемесячная температура воздуха (в 13.00) не превы шает 17—18 °С, воду можно фторировать на уровне 1 мг/л, а в теплый период (например, в июне — августе) — на более низком уровне. Это зависит от сред ней максимальной температуры (в 13.00) в эти месяцы. Например, при тем пературе 22—26 °С используют дозу 0,8 мг/л фтор-иона, при 26—30 °С и вы
ше — 0,7 мг/л.
Обеззараживание питьевой воды
Обеззараживание питьевой воды служит для создания надежного барьера на пути передачи водным путем возбудителей инфекционных болезней. Мето ды обеззараживания воды направлены на уничтожение патогенных и услов но-патогенных микроорганизмов, чем обеспечивается эпидемическая безопас ность воды.
Воду обеззараживают на конечном этапе очистки после осветления и обе сцвечивания перед поступлением в резервуары чистой воды, которые одновре менно выполняют функции контактных камер. Для обеззараживания воды применяют реагентные (химические) и безреагентные (физические) методы. Реагентные методы основаны на введении в воду сильных окислителей (хло рирование, озонирование, манганирование, обработка воды йодом), ионов тя желых металлов и ионов серебра. К безреагентным относятся термическая об работка, ультрафиолетовое облучение, обработка ультразвуком, у-облучение, обработка током сверхвысокой частоты. Метод выбирают в зависимости от количества и качества исходной воды, методов ее предварительной очистки, требований к надежности обеззараживания, с учетом технико-экономических показателей, условий поставки реагентов, наличия транспорта, возможности автоматизации процесса.
Обеззараживание воды хлором и его соединениями. На сегодняшний день наиболее распространенным методом обеззараживания воды на водопро водных станциях остается хлорирование. Среди хлорсодержащих соединений, учитывая определенные гигиенические и технические преимущества, чаще все го используют жидкий хлор. Возможно также применение хлорной извести, кальция и натрия гипохлорита, хлора диоксида, хлораминов и др.
Для использования в практике хозяйственно-питьевого водоснабжения допускаются лишь фторсодержащие соединения, прошедшие гигиеническую апробацию и включенные в "Перечень материалов и реагентов, разрешенных Главным санитарно-эпидемиологическим управлением Министерства здравоохранения СССР для применения в практике хозяйственно-питьевого во доснабжения (№ 3235-85)".
162
ВОДОПРОВОД ИЗ ПОВЕРХНОСТНЫХ ИСТОЧНИКОВ ВОДОСНАБЖЕНИЯ
Впервые в практике водоподготовки хлор был применен задолго до открытия Л. Пастером микробов, доказательства Р. Кохом этиологического значения па тогенных микроорганизмов в развитии инфекционных болезней, окончательного осознания Т. Эшерихом микробиологической сущности водных эпидемий и бакте рицидных свойств хлора. Применяли его с целью дезодорации воды, которая имела неприятный "септический"запах. Хлор оказался очень эффективным дезодоран том и, кроме того, после обработки воды хлором у людей значительно реже диаг ностировали кишечные инфекции. С началом хлорирования воды во многих стра нах Европы прекратились эпидемии брюшного тифа и холеры. Было высказано предположение, что причиной болезней были плохой запах и вкус воды, которые эффективно устранял хлор. Лишь со временем доказали микробную этиологию водных эпидемий кишечных инфекций и признали роль хлора в качестве обеззара живающего агента.
Для хлорирования воды применяют жидкий хлор, который хранится под давлением в специальной таре (баллонах), или вещества, содержащие актив ный хлор.
Хлорирование воды жидким хлором. Хлор (С12) при нормальном атмо сферном давлении является газом зеленовато-желтого цвета, который в 1,5— 2,5 раза тяжелее воздуха, с резким и неприятным запахом, хорошо раство ряется в воде, при повышении давле ния легко сжижается. Атомный вес хло ра — 35,453, молекулярная масса — 70,906 г/моль. Хлор может находиться в трех агрегатных состояниях: твердом, жидком и газообразном.
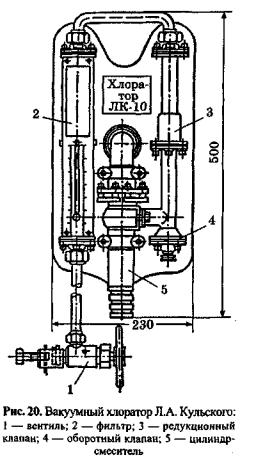
Хлор на водопроводные станции для обеззараживания воды доставля ют жидким в баллонах под давлением. Хлорирование осуществляют при по мощи хлораторов. В них готовят раст вор хлора, который вводят непосред ственно в трубопровод, по которому вода поступает в РЧВ. Используют хло раторы Л.А. Кульского (рис. 20), ва куумные хлораторы ЛОНИИ-100, Ж-10, ЛК-12, ХВ-11. Принципиальная схема хлоратора ЛОНИИ-100 изображена на рис. 21.
При подключении баллона к хло ратору жидкий хлор испаряется. Газо образный хлор очищается в баллоне и на фильтре, и после снижения его дав ления с помощью редуктора до 0,001— 0,02 МПа его смешивают в смесителе с водой. Из смесителя концентрирован-
163
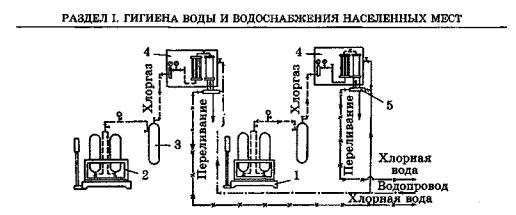
Рис. 21. Технологическая схема типичной хлораторной на 3 кг/ч:
1 — весы платформные; 2 — стояки с баллонами; 3 — улавливатель загрязнений; 4 — хлораторы ЛОНИИ-100; 5 — эжекторы
ный раствор всасывается эжектором и подается в трубопровод. Хлораторы ти па ЛК, конструкция которых проще, а точность ниже используют для станций больших мощностей. Эти хлораторы не требуют предварительной очистки хлора, не так точны в дозировании, но могут подавать хлорную воду на высоту 20— 30 м. После же эжектора от ЛОНИИ-100 напор составляет лишь 1—2 м.
Во время растворения хлора в воде происходит его гидролиз с образова нием хлоридной (соляной) и гипохлоритной (или хлорноватистой) кислот:
С12+ Н2 0 ^ HCl + НС10.
Хлорноватистая кислота НС10 является слабой одноосновной нестойкой кислотой, которая легко диссоциирует, образуя гипохлорит-ион (СЮ~):
НСЮ ^ Н+ + СЮ".
Степень диссоциации хлорноватистой кислоты зависит от pH воды. При pH < 5 (по Л. Кульскому) почти весь свободный хлор остается в виде неионизированной хлорноватистой кислоты (НСЮ). При повышении pH возрастает степень диссоциации хлорноватистой кислоты. При pH свыше 9,2 (по Л. Куль скому) почти весь свободный хлор находится в виде иона гипохлорита (СЮ-). Окислительное действие (окислительный потенциал) имеет как гипохлоритная кислота, так и гипохлорит-ион. Именно поэтому обе эти формы способны ока зывать бактерицидное влияние. Их называют свободным активным хлором. Окислителем является и молекулярный хлор (С12), который также рассматри вается как одна из форм свободного активного хлора1.
Кроме того, хлорноватистая кислота распадается с образованием атомар ного кислорода, который также является сильным окислителем:
НСЮ It HCl + О".
Активным хлором называется такой, который способен при pH 4 выделять эквивалент ное количество йода из водных растворов калия йодида. Различают свободный (молекулярный хлор, хлорноватистая кислота, гипохлорит-ион) и связанный (хлор, входящий в состав органи ческих и неорганических моно- и дихлораминов) активный хлор.
164
ВОДОПРОВОД ИЗ ПОВЕРХНОСТНЫХ ИСТОЧНИКОВ ВОДОСНАБЖЕНИЯ
Раньше считали, что именно этот атомарный кислород оказывает бактери цидное действие. Сегодня доказано, что обеззараживающий эффект жидкого хлора, а также хлорной извести, кальция и натрия гипохлоритов, двухтретиосновной соли кальция гипохлорита обусловлен окислителями, которые образу ются в воде при растворении хлорсодержащих соединений, причем прежде всего — действием гипохлоритной кислоты, а затем — гипохлоритного анио на и наконец атомарного кислорода.
Хлорирование воды гипохлоритами (солями хлорноватистой кислоты) проводят на водопроводных станциях низкой мощности. Гипохлориты также используют для длительного обеззараживания воды в шахтных колодцах при помощи керамических патронов, для обеззараживания воды в полевых усло виях, в том числе с использованием тканево-угольных фильтров и др.
Для дезинфекции питьевой воды используют кальция гипохлорит Са(ОС1)2. В процессе его растворения в воде происходит гидролиз с образованием хлор новатистой кислоты и дальнейшей ее диссоциацией:
Са(ОС1)2 + 2Н2 0 = Са(ОН)2 + 2НСЮ,
нею -£. н+ + cicr.
В зависимости от способа производства кальция гипохлорит может содер жать от 57—60% до 75—85% активного хлора. Вместе с чистым гипохлоритом для обеззараживания воды используют смесь кальция гипохлорита с другими солями (NaCl, СаС12). Такие смеси содержат до 60—75% чистого гипохлорита.
На станциях с расходом активного хлора до 50 кг/сут можно использовать для обеззараживания воды натрия гипохлорит (NaCIO • 5Н20). Этот крис таллогидрат получают из раствора натрия хлорида (NaCl) электролитическим способом.
Натрия хлорид в воде диссоциирует с образованием катиона натрия и ани она хлора:
NaCl ^ Na+ + СГ
Во время электролиза на аноде происходит разряжение ионов хлора и обра зуется молекулярный хлор:
2СГ -» С12 + 2е. Образовавшийся хлор растворяется в электролите:
С12 +Н2 О^НС1 + НСЮ,
С 1 2 + О Н - ^ С І + Н С Ю . На катоде происходит разряд молекул воды:
Н2 0 + е -> ОН- + Н+.
Атомы водорода после рекомбинации в молекулярный водород выделяю тся из раствора в виде газа. Гидроксильные анионы ОН", оставшиеся в воде, реагируют с катионами натрия Na+, вследствие чего образуется NaOH. Натрия гидроксид взаимодействует с хлорноватистой кислотой с образованием натрия гипохлорита:
NaOH + НС10 -> NaOCI + Н2 0.
165
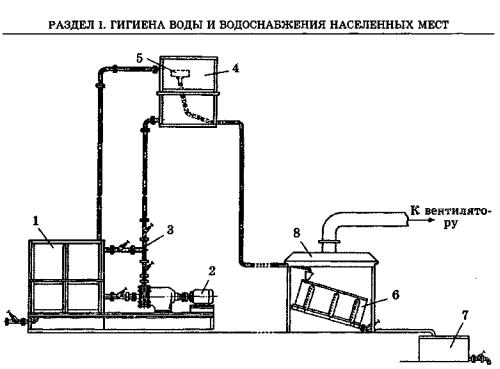
Рис. 22. Технологическая схема электролитического получения натрия гипохлорита:
1 — растворный бак; 2 — насос; 3 — распределительный тройник; 4 — рабочий бак; 5 — дозатор; 6 — электролизер с графитовыми электродами; 7 — бак-накопитель натрия гипохлорита; 8 — зонт вытяжной вентиляции
Натрия гипохлорит в значительной мере диссоциирует с образованием СЮ", который обладает высокой антимикробной активностью:
NaCIO ^ Na+ + СЮ",
сю- + н+;^нсю.
Электролизерные установки разделяют на проточные и порционные. В их состав входят электролизеры, разнотипные баки. Принципиальная схема пор ционной установки изображена на рис. 22. Раствор натрия хлорида 10% кон центрации подают в бак постоянного уровня, откуда он вытекает с постоян ным расходом. После заполнения бачка-дозатора срабатывает сифон и сливает определенный объем раствора в электролизер. Под воздействием электричес кого тока в электролизере образуется натрия гипохлорит. Новые порции раст вора соли выталкивают натрия гипохлорит в расходный бак, из которого он дозируется насосом-дозатором. Бак-накопитель должен вмещать объем натрия гипохлорита не менее чем на 12 ч.
Преимуществом получения натрия гипохлорита электролитическим мето дом в месте употребления является то, что отпадает необходимость в транспор тировке и хранении токсического сжиженного хлора. Среди недостатков мож но назвать значительные энергозатраты.
Обеззараживание воды прямым электролизом. Метод состоит в прямом электролизе пресной воды, в которой природное содержание хлоридов не ни-
166
ВОДОПРОВОД ИЗ ПОВЕРХНОСТНЫХ ИСТОЧНИКОВ ВОДОСНАБЖЕНИЯ
же 20 мг/л, а жесткость — не выше 7 мг-экв/л. Применяют на водопроводных станциях мощностью до 5000 м3/сут. Вследствие прямого электролиза на ано де происходит разряжение находящихся в воде хлорид-ионов и образуется мо лекулярный хлор, который гидролизуется с образованием хлорноватистой кис лоты:
2СГ ^ С12 + 2е, С12 + Н 2 О^НС1 + НСЮ.
Во время обработки электролизом воды с pH в пределах 6—9 главными дезинфекционными агентами являются хлорноватистая (гипохлоритная) кис лота НСЮ, гипохлорит-анион С10~ и монохлорамины NH2C1, которые образу ются вследствие реакции между НСЮ и аммонийными солями, содержащими ся в природной воде. Одновременно во время обработки воды электролитичес ким методом на микроорганизмы действует электрическое поле, в котором они находятся, что усиливает бактерицидный эффект.
Обеззараживание воды хлорной известью применяют на малых водоп роводных станциях (производительностью до 3000 м3/сут), предварительно приготовив раствор. Хлорной известью также заполняют керамические патро ны для обеззараживания воды в шахтных колодцах или на локальных водопро водах.
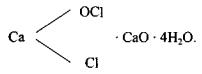
Хлорная известь — белый порошок с резким запахом хлора и сильными окисляющими свойствами. Это смесь кальция гипохлорита и кальция хлорида. Получают хлорную известь из известняков. Кальция карбонат при температу ре 700 °С распадается с образованием негашеной извести (кальция оксид), ко торая после взаимодействия с водой превращается в гашеную известь (кальция гидроксид). При взаимодействии хлора с гашеной известью образуется хлор ная известь:
СаСОз ^ СаО + С02 , СаО + Н2 0 = Са(ОН)2,
2Са(ОН)2 + 2С12 = Са(ОС1)2 + СаС12+ 2Н2 0 или 2Са(ОН)2 + 2С12= 2СаОС12 + 2Н2 0.
Основную составную часть хлорной извести выражают формулой:
Технический продукт содержит не более 35% активного хлора. В процессе хранении хлорная известь частично разлагается. То же происходит с кальция гипохлоритом. Свет, влажность и высокая температура ускоряют потерю ак тивного хлора. Хлорная известь теряет приблизительно 3—4% активного хло ра в месяц вследствие реакций гидролиза и разложения на свету. Во влажном помещении хлорная известь разлагается, образуя хлорноватистую кислоту:
2СаОС12 + С02 + Н2 0 = СаС03 + СаС12 + 2НСЮ.
167

РАЗДЕЛ I. ГИГИЕНА ВОДЫ И ВОДОСНАБЖЕНИЯ НАСЕЛЕННЫХ МЕСТ
Поэтому перед использованием хлорной извести и кальция гипохлорита проверяют их активность — выраженное в процентах содержание активного хлора в хлорсодержащем препарате.
Бактерицидным действием хлорная известь, так же, как и гипохлориты, обя зана группе (ОСГ), которая в водной среде образует хлорноватистую кислоту:
2СаОС12 + 2Н2 0 -> СаС12 + Са(ОН)2 + 2НС10.
Хлора диоксид (ClOJ — газ желто-зеленого цвета, легко растворяется в воде (при температуре 4 °С в 1 объеме воды растворяется 20 объемов газооб разного СЮ2). Не гидролизует. Его целесообразно применять в случае, если особенности природной воды являются неблагоприятными для эффективного обеззараживания хлором, например, при высоких значениях pH или в присут ствии аммиака. Однако получение хлора диоксида является сложным процес сом, который требует специального оборудования, квалифицированного пер сонала, дополнительных финансовых затрат. Кроме того, хлора диоксид взры воопасен, что требует строгого соблюдения требований техники безопасности. Указанное ограничивает использование хлора диоксида для обеззараживания воды на хозяйственно-питьевых водопроводах.
Кхлорсодержащим препаратам относятся и хлорамины (неорганические
иорганические), которые в практике водоподготовки используют ограничено, но применяют как обеззараживающие агенты во время проведения мероприя тий по дезинфекции, в частности в лечебно-профилактических учреждениях.
Неорганические хлорамины (монохлорамины NH2C1 и дихлорамины NHC12) образуются при взаимодействии хлора с аммиаком или аммонийными солями:
NH3 + CI2 = NH2CI + HCI,
NH2CI + CI2 = NHCI2 + HCl.
Вместе с неорганическими соединениями хлора для обеззараживания ис пользуют и органические хлорамины (RNHC1, RNC12). Их получают в процес се взаимодействия хлорной извести с аминами или их солями. При этом один или два атома водорода аминной группы замещаются хлором. Разные хлора мины содержат 25—30% активного хлора.
Процесс обеззараживания воды хлорсодержащими препаратами прои сходит в несколько стадий:
1. Гидролиз хлора и хлорсодержащих препаратов: С12 + Н2 0 = HCl + НС10;
Са(ОС1)2 +2Н20 = Са(ОН)2+ 2НС10; 2СаОС12 + 2Н2 0 = Са(ОН)2 + СаС12 + 2НС10.
2. Диссоциация хлорноватистой кислоты.
При pH ~ 7,0 НС10 диссоциирует: НС10 <± Н+ + СЮ".
3.Диффузия в бактериальную клетку молекулы НС10 и иона СЮ".
4.Взаимодействие обеззараживающего агента с энзимами микроорганиз мов, которые окисляются хлорноватистой кислотой и гипохлорит-ионом.
168
ВОДОПРОВОД ИЗ ПОВЕРХНОСТНЫХ ИСТОЧНИКОВ ВОДОСНАБЖЕНИЯ
Активный хлор (НСЮ и СЮ") сначала диффундирует внутрь бактериаль ной клетки, а затем вступает в реакцию с ферментами. Наибольшее бактери цидное и вирулицидное действие оказывает недиссоциированная хлорноватис тая кислота (НСЮ). Скорость процесса обеззараживания воды определяется кинетикой диффузии хлора внутрь бактериальной клетки и кинетикой отмира ния клеток в результате нарушения метаболизма. С повышением концентра ции хлора в воде, ее температуры и с переходом хлора в недиссоциированную форму легко диффундируемой хлорноватистой кислоты общая скорость про цесса дезинфекции повышается.
Механизм бактерицидного действия хлора состоит в окислении органи ческих соединений бактериальной клетки: коагуляции и повреждении ее обо лочки, угнетении и денатурации ферментов, обеспечивающих обмен веществ и энергии. Наиболее всего повреждаются тиоловые ферменты, содержащие SH-группы, которые окисляются хлорноватистой кислотой и ионом гипохлорита. Среди тиоловых ферментов активнее всего угнетается группа дегидрогеназ, которые обеспечивают дыхание и энергетический обмен бактериальной клетки1. Под влиянием хлорноватистой кислоты и гипохлорит-иона угнетают ся дегидрогеназы глюкозы, этилового спирта, глицерина, янтарной, глютаминовой, молочной, пировиноградной кислот, формальдегида и др. Угнетение дегидрогеназ приводит к торможению процессов окисления на начальных эта пах. Последствием этого является как торможение процессов размножения бак терий (бактериостатическое действие), так и их гибель (бактерицидное действие).
Механизм действия активного хлора на вирусы состоит из двух фаз. Сна чала происходят адсорбция хлорноватистой кислоты и гипохлорит-иона на обо лочке вируса и проникновение через нее, а затем — инактивация ими РНК или ДНК вируса.
С повышением значения pH бактерицидность хлора в воде снижается. На пример, для уменьшения количества бактерий в воде на 99% при дозе свобод ного хлора 0,1 мг/л продолжительность контакта увеличивается с 6 до 180 мин при повышении pH соответственно с 6 до 11. Следовательно воду целесообраз но обеззараживать хлором при низких значениях pH, то есть до введения ще лочных реагентов.
Наличие в воде органических соединений, способных к окислению, неор ганических восстановителей, а также коллоидных и взвешенных веществ, об волакивающих микроорганизмы, приводит к замедлению процесса обеззара живания воды.
Взаимодействие хлора с компонентами воды — сложный и многостадий ный процесс. Небольшие дозы хлора полностью связываются органическими веществами, неорганическими восстановителями, взвешенными частицами, гуминовыми веществами и микроорганизмами воды. Для надежного обеззара живающего эффекта воды после ее хлорирования необходимо определять оста точные концентрации свободного или связанного активного хлора.
Энергетический метаболизм у бактерий происходит в мезосомах — аналогах митохондрий.
169

Рис. 23. График зависимости величины и вида остаточного хлора от введенной дозы хлора
На рис. 23 приведена зависимость между дозой введенного хлора и оста точным хлором при наличии в воде аммиака или аммонийных солей. При хло рировании воды, не содержащей аммиака или других азотсодержащих соеди нений', с увеличением количества внесенного в воду хлора возрастает содер жание в ней остаточного свободного хлора. Но картина меняется при наличии
вводе аммиака, аммонийных солей и других азотсодержащих соединений, ко торые являются составной частью природной воды или искусственно вносятся
внее. При этом хлор и хлорные агенты взаимодействуют с присутствующим в воде аммиаком, аммонийными и органическими солями, содержащими амино группы. Это приводит к образованию моно- и дихлораминов, а также чрезвы чайно нестойких трихлораминов:
NH3 + Н2 0 = NH4OH;
С12 + Н2 0 = НС10 + HCl;
НСЮ + NH4OH = NH2C1 + Н2 0;
НСЮ + NH2C1 = NHC12+ H2 0;
НСЮ + NHC12 = NC13 + Н2 0.
Хлорамины представляют собой связанный активный хлор, обладающий бактерицидным действием, которое в 25—100 раз меньше, чем у свободного хлора. Кроме того, в зависимости от pH воды изменяется соотношение между моно- и дихлораминами (рис. 24). При низких значениях pH (5—6,5) преиму щественно образуются дихлорамины, а при больших значениях pH (больше 7,5) — монохлорамины, бактерицидное действие которых в 3—5 раз слабее, чем дихлораминов. Бактерицидность неорганических хлораминов в 8—10 раз выше, чем хлорпроизводных органических аминов и иминов. При добавлении к воде невысоких доз хлора при молярном соотношении С12 : NH* < 1 образу ются моно- и дихлорамины. Поэтому на отрезке II кривой (см. рис. 23) в воде
Безаммиачной воды в природе нет. Ее можно приготовить лишь в лабораторных условиях из дистиллированной воды.
170
