
- •Коллоидная химия
- •Печатается по рекомендации Методического совета и по решению Редакционно-издательского совета Хакасского государственного университета им. Н. Ф. Катанова
- •Оглавление
- •Введение
- •Лекция 1. Дисперсные системы
- •1.1. Предмет коллоидной химии
- •1.2. Количественные характеристики дисперсных систем
- •1.3. Классификация дисперсных систем
- •Классификация по дисперсности
- •Классификация по агрегатному состоянию фаз
- •Классификация по взаимодействию дисперсной фазы и дисперсионной среды (по межфазному взаимодействию)
- •Классификация по межчастичному взаимодействию
- •1.4. Краткий исторический очерк
- •Лекция 2. Поверхностные явления
- •2.1. Природа поверхностной энергии
- •2.2. Поверхностное натяжение
- •2.3. Самопроизвольные процессы в поверхностном слое
- •2.4. Адсорбция. Общие положения, классификация
- •Лекция 3. Виды адсорбции
- •3.1. Адсорбция на границе «жидкий раствор – газ». Поверхностно-активные вещества
- •3.2. Адсорбция газов и паров на поверхности твердых тел. Капиллярная конденсация
- •3.3. Адсорбция растворенного в жидкости вещества на твердом адсорбенте. Смачивание. Адгезия
- •Лекция 4. Лиофобные золи (коллоидные растворы)
- •4.1. Методы получения лиофобных золей
- •4.1.1. Диспергационные методы
- •4.1.2. Конденсационные методы
- •4.1.3. Пептизация
- •4.2. Методы очистки коллоидных растворов
- •4.2.1. Диализ
- •4.2.2. Электродиализ
- •4.2.3. Ультрафильтрация
- •4.2.4. Обратный осмос
- •Лекция 5. Оптические и молекулярно-кинетические свойства коллоидных растворов
- •5.1. Оптические свойства коллоидных растворов
- •5.1.1. Рассеяние света
- •5.1.2. Поглощение света и окраска золей
- •5.1.3. Оптические методы исследования коллоидных растворов
- •5.2. Молекулярно-кинетические свойства коллоидных растворов
- •5.2.1. Броуновское движение
- •5.2.2. Диффузия
- •5.2.3. Осмотическое давление
- •Лекция 6. Электрические свойства коллоидных растворов
- •6.1. Электрокинетические явления в гидрофобных золях
- •6.2. Пути образования двойного электрического слоя
- •6.3. Строение двойного электрического слоя
- •6.4. Факторы, от которых зависит дзета-потенциал
- •Лекция 7. Устойчивость коллоидных растворов. Коагуляция
- •7.1. Седиментационная устойчивость дисперсных систем
- •7.2. Агрегативная устойчивость коллоидных растворов. Коагуляция
- •7.3. Факторы устойчивости лиофобных золей
- •7.4. Теория устойчивости лиофобных золей
- •7.4.1. Электростатические силы отталкивания
- •7.4.2. Ван-дер-Ваальсовы силы притяжения
- •7.5. Виды коагуляции электролитами
- •7.6. Гетерокоагуляция и гетероадагуляция
- •Лекция 8. Лиофильные системы. Микрогетерогенные системы
- •8.1. Лиофильные системы
- •8.1.1. Растворы коллоидных поверхностно-активных веществ
- •8.1.2. Растворы высокомолекулярных соединений
- •8.2. Микрогетерогенные системы
- •8.2.1. Суспензии
- •8.2.2. Эмульсии
- •8.2.3. Пены
- •8.2.4. Аэрозоли
- •Заключение
- •Библиографический список
- •Горенкова Галина Алексеевна
- •Коллоидная химия
- •655017, Г. Абакан, пр. Ленина, 94
7.4. Теория устойчивости лиофобных золей
Современная теория устойчивости, развитая российскими учеными Б. В. Дерягиным и Л. Д. Ландау, получила всеобщее признание. Несколько позднее теоретическая разработка, которая привела практически к тем же результатам, была осуществлена голландскими учеными Фервеем и Овербеком. Поэтому современная теория устойчивости носит имя указанных ученых и известна в литературе как теория ДЛФО (DLVO).
Когда коллоидные частицы подходят очень близко друг к другу, их диффузные слои перекрываются и взаимодействуют. Это взаимодействие совершается в тонкой прослойке дисперсионной среды, разделяющей частицы. Очевидно, что свойства тонкого жидкого слоя определяют, произойдет ли коагуляция, т. е. определяют устойчивость коллоидов.
Исследования показали, что утончение тонкого слоя при сближении частиц происходит путем вытекания из него жидкости. Когда жидкий слой становится достаточно тонким (толщина его меньше 100–200 нм), свойства жидкости в нем начинают сильно отличаться от свойств жидкости в окружающем объеме. В слое появляется дополнительное давление, которое один из авторов теории ДЛФО Б. В. Дерягин назвал «расклинивающим давлением».
Возникновение расклинивающего давления в тонких жидких слоях обусловлено, главным образом, двумя факторами:
1) электростатическое
взаимодействие в слое – это силы
отталкивания с энергией
![]() ;
;
2) Ван-дер-Ваальсовы
силы притяжения с энергией
![]() .
.
Результирующая энергия межчастичного взаимодействия U определяется как сумма двух составляющих:
![]() .
.
Если
![]() ,
то преобладают силы отталкивания,
коагуляция не происходит, золь является
агрегативно устойчивым. В противоположном
случае преобладают силы притяжения
между частицами, происходит коагуляция.
,
то преобладают силы отталкивания,
коагуляция не происходит, золь является
агрегативно устойчивым. В противоположном
случае преобладают силы притяжения
между частицами, происходит коагуляция.
7.4.1. Электростатические силы отталкивания
Электростатическое отталкивание между мицеллами возникает при перекрывании диффузных слоев противоионов. Расчеты показывают, что энергия отталкивания уменьшается:
при увеличении зарядов противоионов и их концентрации;
при уменьшении по абсолютной величине φ0 и дзета-потенциала.
Энергия отталкивания Uотт убывает с увеличением расстояния между частицами h по экспоненциальному закону.
7.4.2. Ван-дер-Ваальсовы силы притяжения
Энергия притяжения связана, главным образом, с дисперсионным взаимодействием между молекулами. Uпр изменяется с увеличением расстояния между частицами h обратно пропорционально квадрату расстояния. Таким образом, притяжение сравнительно медленно уменьшается с увеличением расстояния.
Зависимость суммарной потенциальной энергии межчастичного взаимодействия от расстояния между частицами имеет сложный характер. Общий вид этой зависимости U = f(h) представлен на рис. 7.1.
Рис.7.1. Потенциальная
кривая взаимодействия двух коллоидных
частиц.
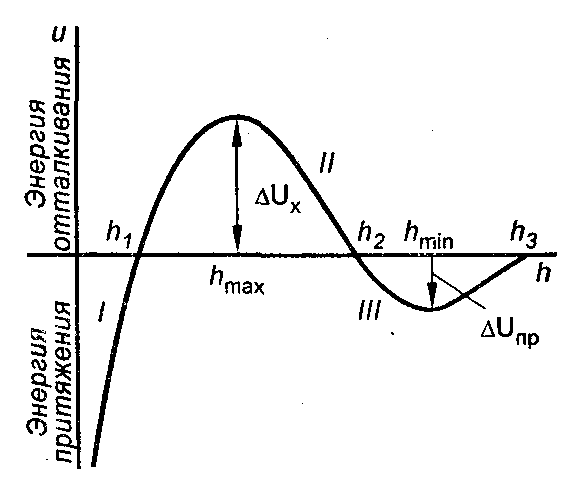
1)
![]() .
.
![]() ,
между частицами преобладают силы
притяжения, наблюдается ближний
минимум.
,
между частицами преобладают силы
притяжения, наблюдается ближний
минимум.
![]() ;
;
![]() .
Происходит коагуляция;
.
Происходит коагуляция;
2)
![]() .
.
![]() – между частицами преобладают силы
отталкивания.
– между частицами преобладают силы
отталкивания.![]() ;
;
3)
![]() .
.![]() – обнаруживается дальний минимум,
однако глубина его невелика.
– обнаруживается дальний минимум,
однако глубина его невелика.
При
![]() ,
,
![]() и
и
![]()
![]() ,
т. е. при этих расстояниях между частицами
силы притяжения уравновешиваются силами
отталкивания.
,
т. е. при этих расстояниях между частицами
силы притяжения уравновешиваются силами
отталкивания.
Таким образом,
если частицы сблизятся на расстояние
меньше h1,
они неизбежно слипнутся, но для этого
должен быть преодолен потенциальный
барьер
![]() .
Это возможно при достаточной кинетической
энергии частиц.
.
Это возможно при достаточной кинетической
энергии частиц.
Так
как золь обычно рассматривают при
постоянной температуре, кинетическая
энергия частиц остается постоянной.
Следовательно, для коагуляции должен
быть уменьшен потенциальный барьер
коагуляции
![]() .
.
