
Сафонов А.И. Эволюционное учение. Классики и современники
.pdfмутации проявились в фенотипе, оказался понижен у червей +HSF-1 по сравнению с контролем на 18–88 %.
Более того, оказалось, что эффекты мутаций, пенетрантность которых снизилась у червей +HSF-1, зависят также и от температуры. Если подвергнуть молодую личинку обычного (немодифицированного) червя тепловому шоку (нагреванию до 35 °C на два часа), пенетрантность мутаций снижается примерно так же, как у червей +HSF-1. Если же пенетратность мутации не зависит от уровня HSF-1, то и тепловой шок на нее не влияет. Скорее всего, те три мутации, которые оказались нечувствительны к уровню HSF-1, просто «не лечатся» шаперонами (например, они могут быть связаны не с нарушением структуры какого-нибудь белка, а с полным его отсутствием).
Таким образом, эксперимент показал, что реакция на стресс, вызванная путем генетических модификаций или средового воздействия (теплового шока), действительно снижает пенетрантность вредных мутаций. Проявится или нет мутация в фенотипе, зависит, во-первых, от генетики (например, от генетически обусловленного базового уровня HSF-1), во-вторых, от жизненной истории особи, в том числе от стрессов, перенесенных в детстве. Главное тут – соблюсти меру: слишком сильный стресс может повредить систему «забуферивания» мутаций при помощи шаперонов и тем самым усугубить фенотипические эффекты этих мутаций (Queitsch et al., 2002), однако умеренный стресс, перенесенный в определенном возрасте, напротив, может их сгладить.
Как мы уже говорили, неполная пенетрантность наблюдается и в изогенных популяциях, даже если условия, в которых развиваются особи, одинаковы. В ходе дальнейших экспериментов авторы, работая с изогенными линиями C. elegans , попытались выяснить, чем вызывается эта странная вариабельность у животных с одинаковыми генами и «жизненным опытом». Черви C. elegans способны к самооплодотворению (см. главу 3), поэтому вывести изогенную линию нетрудно. Более того, такие линии нередко возникают и в природе.
Ранее уже было показано, что в изогенных линиях C. elegans наблюдается случайная (не связанная ни с генетическими, ни со средовыми факторами) вариабельность по уровню экспрессии некоторых генов – участников реакции на стресс, причем от этого уровня зависит, во-первых, устойчивость червей к перегреву, во-вторых – продолжительность их жизни: особи с высоким уровнем шаперонов живут дольше. Речь идет, напомним, о генетически идентичных особях (Rea et al., 2005). Поэтому авторы вполне логично предположили, что случайные различия в уровне экспрессии шаперонов и других компонентов реакции на стресс могут влиять также и на фенотипический эффект вредных мутаций. Для проверки этого предположения генетически идентичных червей с той или иной вредной мутацией подвергали кратковременному перегреву на стадии личинки. Затем их делили на две группы в зависимости от силы реакции на стресс, которую определяли по уровню экспрессии участника этой реакции – гена hsp-16.2 . Оказалось, что у червей с сильной реакцией на стресс вредные мутации проявляются в фенотипе реже, чем у особей, слабо реагирующих на перегрев. Сама же сила реакции на стресс в свою очередь зависит от случайных различий в уровне экспрессии генов теплового шока. Такие различия есть у генетически идентичных личинок еще до того, как их подвергнут перегреву. У кого эти гены изначально работают активнее, тот и выдает более сильную реакцию на перегрев.
Таким образом, пенетрантность мутаций зависит не только от уровня реакции на стресс, обусловленного генетикой (как у червей +HSF-1) или средой, но и от случайных колебаний этого уровня, не зависящих ни от генов, ни от среды. У генетически идентичных червей имеется случайная изменчивость по силе реакции на стресс, причем те особи, которые реагируют на стресс активнее, получают сразу три важных преимущества. Во-первых, они легче переносят перегрев, во-вторых – дольше живут, в-третьих – они лучше защищены от вредных мутаций.
Возникает естественный вопрос: если сильная реакция на стресс так полезна, почему этот признак остается нестабильным, почему он варьирует даже у генетически идентичных
371
особей? Казалось бы, отбор давно должен был закрепить в генофонде C. elegans какие-нибудь мутации, обеспечивающие стабильно высокий уровень активности «стрессовых» генов.
Исследователи предположили, что раз этого не произошло, значит, тут есть какой-то подвох. Возможно, высокая активность этих генов не дается даром и, кроме пользы, приносит также и вред. Дальнейшие эксперименты подтвердили это предположение. Оказалось, что черви с более интенсивной реакцией на тепловой шок отличаются пониженной плодовитостью. За долгую жизнь и устойчивость к перегреву и вредным мутациям червям приходится платить низкой эффективностью размножения.
Черви C. elegans в природе живут в гниющих растительных остатках и питаются бактериями. Условия в местах их обитания переменчивы и непредсказуемы. Пока условия остаются благоприятными, особи с пониженным уровнем экспрессии «стрессовых» генов оказываются в выигрыше благодаря высокой скорости размножения. При ухудшении условий преимущество оказывается на стороне более жизнестойких индивидов с высоким уровнем шаперонов. Наилучшая стратегия в такой обстановке, по-видимому, состоит в том, чтобы не класть все яйца в одну корзину. Черви минимизируют риск вымирания, позволяя данному признаку широко варьировать даже у генетически идентичных особей (а природные микропопуляции C. elegans часто имеют низкое генетическое разнообразие из-за малого числа основателей и самооплодотворения). Как бы ни сложились обстоятельства, какая-то часть генетически однообразной, но фенотипически вариабельной популяции с большой вероятностью выживет и будет успешно размножаться.
Это исследование интересно тем, что обращает внимание на разновидность изменчивости, которую биологи обычно игнорируют в своих теоретических построениях: на случайную изменчивость, определяемую не генами и не средой, а неизбежными стохастическими флуктуациями на молекулярном уровне, в том числе на уровне экспрессии генов. По-видимому, роль такой изменчивости в жизни и эволюции организмов важнее, чем принято считать.
Молекулярные механизмы реакции на тепловой шок сходны у большинства животных. Вариабельность по силе реакции на стресс характерна для многих организмов. Поэтому можно предположить, что некоторые виды стрессовых воздействий способны сглаживать эффекты вредных мутаций не только у C. elegans , но и других животных. Не исключено, что некоторые из полученных выводов могут быть приложимы и к наследственным болезням человека. Но это пока только предположение.
–––––
Сложность организма и сложность программы развития
Соотношение между кажущейся сложностью организма и реальной сложностью генно-регуляторных сетей, составляющих его «программу развития», далеко не однозначно. Видимая сложность порой порождается весьма простой программой.
Например, чтобы перейти от внешне простой типичной офиуры (на рисунке 85 слева) к причудливому горгоноцефалюсу с фрактально ветвящимися руками (справа), достаточно, чтобы каждая рука в какой-то момент своего развития раздвоилась, так же как и каждая ветвь руки. Для этого нужно добавить в программу развития следующую инструкцию для растущих концов рук: «При выполнении таких-то условий разветвись надвое». В результате одной-единственной команды автоматически получается сложная, завораживающая фрактальная структура.
Для чего же на самом деле необходимо усложнение генетической программы развития? Герберт Спенсер (1820–1903), философ и социолог, с легкой руки которого дарвиновское «наследование с изменением» (descent with modification ) стали называть эволюцией , дал прекрасное определение тому, что мы сейчас назвали бы «прогрессивным развитием» или «развитием по пути усложнения». Спенсеровское определение таково:
прогрессивное развитие – это переход от неопределенной несвязной однородности к определенной связной разнородности.
372

Рис. 85 – Соотношение между кажущейся сложностью организма и реальной сложностью генно-регуляторных сетей (по А.В. Маркову, 2014)
373
Так вот, усложнение программы развития необходимо для изменений, подпадающих под это определение. Этот вывод трудно обосновать экспериментально – мы пока слишком многого не знаем о програмах развития реальных организмов, – но он быстро становится очевиден пользователю, поигравшему немного с программой EvoDevo .
Усложнение генетической программы развития необходимо, во-первых, для клеточной дифференцировки. Если мы хотим, чтобы из одного исходного типа эмбриональных клеток получились клетки нескольких разных типов (а это и есть переход от однородности к разнородности ), нам придется для каждого типа клеток написать свою «подпрограмму».
Во-вторых – это менее очевидно, хотя не менее важно, – усложнение программы необходимо для повышения упорядоченности фенотипа, для подавления «внутреннего хаоса» и роста устойчивости к внешним помехам. Повышение упорядоченности – это, по Спенсеру, переход от неопределенного состояния к определенному. Все эти «избыточные» регуляторные контуры и отрицательные обратные связи, которые приходится добавлять в программу, чтобы развитие стало стабильным, – это самое настоящее, подлинное усложнение, хотя на фенотипическом уровне оно может проявиться всего-навсего в снижении стохастической изменчивости, в более редком появлении всевозможных уродств. При этом каждый дополнительный регуляторный контур, развившийся «для стабильности», может в новых условиях сработать каким-то неожиданным, но интересным образом и стать источником эволюционных новшеств.
–––––
Надзор за надзирателями: кто присматривает за регуляцией развития
К билатериям (двусторонне-симметричным) относится большинство животных, в том числе черви, моллюски, членистоногие и хордовые. Специалисты по сравнительной анатомии и эмбриологии в течение прошлого века разработали несколько альтернативных теорий происхождения и ранней эволюции билатерий. Решить, какая из них ближе к реальности, помогли новые данные, в том числе молекулярно-генетические (Малахов, 2004).
По современным представлениям, последний общий предок всех современных билатерий был сегментированным животным, имел вторичную полость тела (цело́м) и, возможно, парные конечности (параподии). Иными словами, из всех современных животных он был больше всего похож на кольчатого червя. Соответственно, кольчатые черви – наименее изменившиеся из всех его потомков, или, что то же самое, самые примитивные из современных билатерий. Это звучит удручающе непривычно для зоологов старой школы, которые привыкли считать самыми примитивными билатериями не кольчатых, а плоских червей. Однако эволюционные реконструкции, основанные на молекулярных данных, свидетельствуют о том, что плоские и круглые черви, устроенные проще кольчатых, произошли от более высокоорганизованных предков, т. е. подверглись вторичному упрощению (рис. 86).
Подобно тому как ланцетник может служить живой упрощенной схемой хордовых (см. главу 5), кольчатые черви являются удобной моделью для изучения древнейших этапов эволюции билатерий.
Ранняя эволюция билатерий представляет особый интерес в связи с тем, что именно на этом этапе произошло радикальное усложнение и диверсификация планов строения и появилось много новых тканей и органов, в том числе центральная нервная система, разнообразные органы чувств, сквозной кишечник, специализированная мускулатура.
374
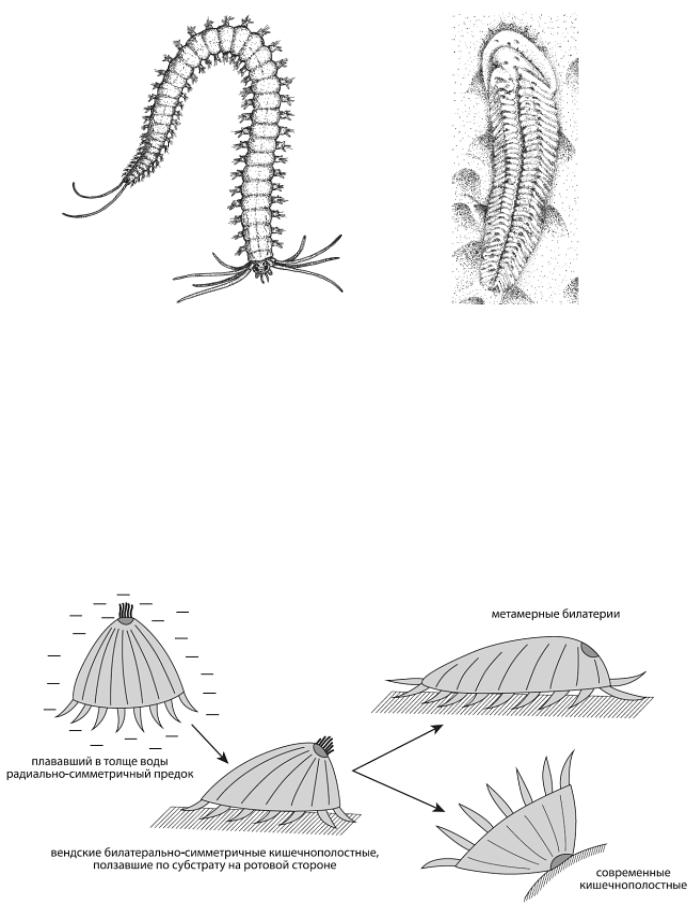
Рис. 86 – Современный кольчатый червь Platynereis (слева) и загадочное ископаемое животное Spriggina (вендский период, около 550 млн лет назад). Некоторые авторы сближают сприггину с предками билатерий, другие оспаривают такую трактовку. Малахов, 2004
Чтобы понять, откуда взялись все эти новшества, необходимо прежде всего разобраться, как они возникают в онтогенезе современных животных. Дело тут не только в том, что индивидуальное развитие иногда отчасти воспроизводит («рекапитулирует») эволюционную историю, но и в том, что эволюция организма, как мы уже знаем, – это прежде всего эволюция программы индивидуального развития. Вопрос о том, как появились новые органы и ткани, сводится к вопросу об изменениях в программе онтогенеза, которые произошли у древних билатерий (рис. 87).
Рис. 87 – Схема происхождения билатерий по В. В. Малахову (2004). Темное пятнышко – орган равновесия (аборальный орган), маркирующий передний полюс развивающегося животног
375
Важные шаги к пониманию этих изменений были сделаны в ходе изучения генов – регуляторов индивидуального развития животных, таких как Hox-гены. Наиболее очевидная функция белков, кодируемых этими генами, состоит в том, что они «размечают» эмбрион, определяя, где будет голова, а где хвост, где спина, а где брюхо, где расти ногам, а где быть границам между сегментами. Манипулируя работой белков-регуляторов, можно превратить, например, третий сегмент груди дрозофилы в дубликат второго, и тогда у мухи вырастет лишняя пара крыльев, можно превратить антенны в ноги или добиться появления зачатков конечностей на брюшных сегментах, где им быть не положено. Открытие сходных Hox-генов у разных типов животных заставило по-новому взглянуть на морфогенез животных и его преобразования в ходе эволюции. Стало ясно, что, изменив один ген (или только время и место его включения), можно трансформировать, создать, удалить или перенести в другое место сразу целый орган, сохранив при этом общий план строения.
Кроме регуляторных белков онтогенезом управляют маленькие молекулы РНК – микроРНК. Как и белки-регуляторы, микроРНК влияют на активность генов, причем под их контролем находятся также и гены, кодирующие те самые белки-регуляторы (как дополнительная система надзора за надзирателями). Во многих случаях удалось установить, какие именно гены регулируются теми или иными микроРНК, но как все это связано с конкретными планами строения билатерий и с их эволюцией, выяснить оказалось не так-то просто. Возможно, ключ к ответу на эти вопросы можно найти, исследуя работу микроРНК в ходе развития кольчатых червей.
Германские биологи изучили распределение микроРНК в органах и тканях развивающихся личинок кольчатых червей Platynereis и Capitella (Christodoulou et al., 2010).
Для сравнения использовался морской еж Strongylocentrotus – представитель вторичноротых. Билатерии вскоре после своего появления подразделились на две группы – первичноротых и вторичноротых. К первым относятся кольчатые, плоские и круглые черви, моллюски, членистоногие и много всякой мелочи, ко вторым – иглокожие, полухордовые и хордовые. Обе группы билатерий – и первичноротые, и вторичноротые – сравнивались с представителем кишечнополостных актинией Nematostella, животным с радиальной симметрией.
Ранее было установлено, что у билатерий имеется более 30 уникальных микроРНК, которых нет у других организмов. Это подтвердилось в ходе поиска микроРНК у платинереиса. У этого червя обнаружилось 34 микроРНК, общих для первично- и вторичноротых. Значит, они уже имелись у последнего общего предка билатерий, но их не было у более древних радиально-симметричных предков (кроме одной-единственной микроРНК, которая называется miR-100 и которая есть у актинии).
Получается, что резкое усложнение организма и появление новых тканей у древних билатерий сопровождалось приобретением трех десятков новых микроРНК. Главный вопрос состоит в том, была ли между этими новоприобретениями связь. Если да, то следует ожидать, что в ходе онтогенеза у примитивных билатерий микроРНК распределяются неким закономерным образом по формирующимся тканям. Ранее это пытались изучить на «высших» животных, таких как членистоногие и хордовые, но картина получалась слишком сложная и запутанная.
Оказалось, что в ходе развития платинереиса микроРНК действительно четко распределены по дифференцирующимся тканям. В частности, древнейшая микроРНК miR-100 и три другие микроРНК обнаруживаются исключительно в двух группах клеток по обе стороны от личиночной глотки (передней кишки). Клетки при ближайшем рассмотрении оказались нейросекреторными. Это интересно, потому что у позвоночных одна из этих молекул (miR-375) маркирует нейросекреторные клетки гипофиза и поджелудочной железы, формирование которых в онтогенезе связано с передней кишкой.
У актинии экспрессия miR-100 обнаружилась в отдельных клетках вдоль края
личиночного |
рта |
(бластопора), |
примерно |
в |
той |
области, |
которая |
по |
|
|
|
376 |
|
|
|
|
|
сравнительно-анатомическим данным соответствует передней кишке или глотке билатерий (предполагается, что у предков билатерий был щелевидный рот, как у некоторых кишечнополостных, который потом склеился посередине, оставив два отверстия по краям: они потом стали ртом и анусом).
У личинок червя Capitella и морского ежа эти микроРНК тоже локализуются вокруг глотки. По-видимому, такая их локализация первична для билатерий, но у продвинутых животных, таких как членистоногие и хордовые, эти микроРНК расширили сферу своей деятельности и стали работать не только в передней кишке и связанных с ней нейросекреторных клетках, но и в других частях зародыша.
Личинки кольчатых червей, иглокожих и многих других билатерий плавают при помощи ресничных шнуров – полосок эпителиальных клеток, покрытых согласованно бьющимися ресничками. Три микроРНК (miR-29, miR-34, miR-92) у обоих исследованных червей и морского ежа оказались приуроченными к ресничным шнурам. У позвоночных эти микроРНК экспрессируются в нейронах, выстилающих желудочки мозга, причем некоторые из этих нейронов несут реснички.
Этот факт должен привести в восторг сравнительных анатомов и эмбриологов, которые давно говорили о тесной связи между ресничными шнурами и нервными стволами и о том, что нервная пластинка (из которой формируется спинная нервная трубка – зачаток центральной нервной системы хордовых) гомологична невротроху – ресничному шнуру, образующемуся у личинок билатерий на месте замкнувшегося щелевидного бластопора. Иными словами, клетки с ресничками, выстилающие желудочки мозга позвоночных, исторически восходят к невротроху. Поэтому то, что в них экспрессируются те же микроРНК, что и в невротрохе, показывает, что сравнительные анатомы XIX–XX веков не даром ели свой хлеб.
Два набора микроРНК оказались приуроченными к двум разным областям мозга. Один набор присутствует в нейросекреторной ткани верхней (дорзальной, спинной) части мозга. Те же самые микроРНК ранее были обнаружены в нейросекреторных клетках гипоталамуса у рыб. То, что гипоталамус находится в нижней (брюшной) части мозга, это правильно, потому что брюшная сторона хордовых гомологична спинной стороне других билатерий (Малахов, 1996 ). Второй набор «мозговых» микроРНК у червей экспрессируется у оснований антенн – органов химического чувства. У мышей те же микроРНК приурочены к переднему мозгу, изначальной функцией которого у позвоночных была обработка обонятельной информации. Таким образом, здесь тоже наблюдается эволюционная преемственность.
Остальные микроРНК тоже оказались распределены закономерным образом по разным типам формирующихся тканей, причем были выявлены многочисленные параллели между их распределением у разных билатерий. Например, miR-124 приурочена к центральной нервной системе у насекомых и плоских червей, а у позвоночных – к нервным клеткам вообще. У платинереиса эта микроРНК экспрессируется только в центральной нервной системе – мозге и брюшной нервной цепочке. Другие микроРНК, у позвоночных экспрессирующиеся в некоторых органах чувств, у платинереиса тоже оказались приуроченными к органам чувств (глазам, антеннам, чувствительным придаткам параподий). МикроРНК miR-1 и miR-133 у кольчатых червей, как и у позвоночных, присутствуют только в развивающихся мышцах, и т. д.
Полученные результаты показывают, что одновременное появление у ранних билатерий новых тканей и новых микроРНК не было случайным совпадением. По-видимому, микроРНК изначально играли важную роль в дифференцировке тканей у билатерий. Их функции, однако, оказались более пластичными, чем у Hox -генов, и поэтому у высших билатерий «сфера влияния» многих микроРНК стала сильно отличаться от исходной.
377
Hox-гены обрели свободу – и змеи потеряли ноги
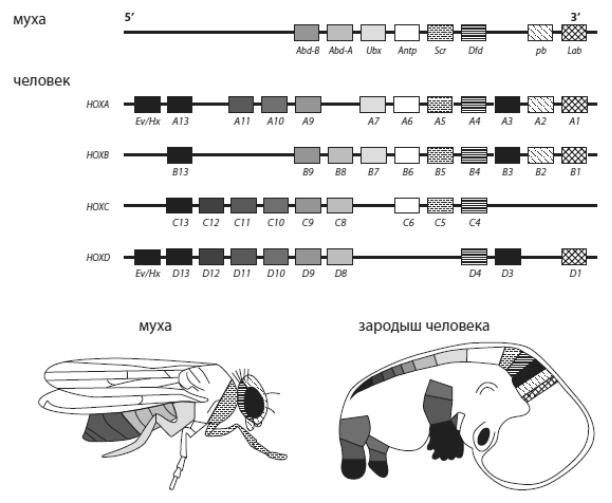
Напоследок рассмотрим исследование, проливающее свет на роль Hox -генов в эволюции позвоночных. Как известно, важнейшая функция Hox -генов состоит в том, что они подробно размечают эмбрион вдоль передне-задней оси. Дальнейшая судьба эмбриональных клеток, оказавшихся в той или иной части эмбриона, зависит от набора Hox -генов, экспрессирующихся в этой части. Для каждого Hox -гена характерна своя область экспрессии. Например, гены Hox12 и Hox13 , как правило, работают только в задней части эмбриона, которая в дальнейшем станет хвостом; гены Hox10 у некоторых позвоночных работают от заднего конца эмбриона до той черты, которая станет границей между грудным отделом (где на позвонках есть ребра) и поясничным, где ребра не развиваются. «Hox -код», определяющий план строения организма, сложен и не совсем одинаков у разных групп позвоночных (рис. 88).
Рис. 88 – Hox-гены дрозофилы и человека. Прямоугольниками обозначены гены в том порядке, в каком они расположены в хромосомах. У мухи один набор Hox-генов, у человека – четыре, частично дублирующие друг друга (они образовались из одного в результате двух полногеномных дупликаций). Кластеры A, B, C, D находятся на разных хромососмах (у мыши это хромосомы № 6, 11, 15 и 2, у человека – № у, 17, 2, 12). У змей, в отличие от мыши и человека, в кластере D отсутствует 12-й ген ( Hoxd12). На изображениях мухи и зародыша человека области экспрессии соответствующих генов окрашены теми же цветами, что и сами гены. По последним данным, соответствие между Hox-генами членистоногих и позвоночных несколько менее однозначно, чем показано на этой схеме.
Вряд ли можно сомневаться в том, что многие крупные эволюционные преобразования, затрагивающие план строения, были связаны с изменениями в структуре и экспрессии Hox
378

-генов. Однако хорошо изученных примеров, иллюстрирующих эту связь, пока немного96. У многих животных, в том числе у позвоночных, Hox -гены в геноме располагаются
кластерами, т. е. группами вплотную друг другу. Самое удивительное, что порядок расположения генов в Hox -кластерах часто (хотя и не всегда) совпадает с распределением областей экспрессии вдоль передне-задней оси: впереди находятся «головные» гены, за ними следуют гены, отвечающие за формирование средних участков тела, а замыкают кластер «задние» гены, управляющие развитием задних частей туловища. По-видимому, это связано со способом регуляции экспрессии Hox -генов: участок ДНК, где находится Hox -кластер, постепенно «раскрывается», становясь доступным для транскрипции по мере движения от переднего конца тела к заднему. Поэтому у переднего конца тела экспрессируются только передние Hox -гены, а чем ближе к хвосту, тем более задние гены включаются в работу. Удобный способ регуляции генов, отвечающих за разметку эмбриона вдоль передне-задней оси! У предков позвоночных, как у современного ланцетника, в геноме был один Hox -кластер, включающий 14 генов. На ранних этапах эволюции позвоночных произошло две полногеномные дупликации. В результате позвоночные приобрели четыре Hox -кластера вместо одного. Это открыло перед позвоночными большие эволюционные возможности (см. главу 5). Отдельные Hox -гены в некоторых кластерах были утрачены, но в целом их набор и порядок расположения остался сходным во всех четырех кластерах. Паралогичные гены (т. е. копии одного и того же Hox -гена в разных Hox -кластерах) приобрели немного различающиеся функции, что дало возможность тонко регулировать эмбриональное развитие и облегчило развитие новых планов строения.
Биологи из Швейцарии, Новой Зеландии и США изучили работу Hox-генов у чешуйчатых рептилий (отряд Squamata) (Di-Poi et al., 2010). Этот отряд, объединяющий ящериц и змей, интересен разнообразием планов строения и вариабельностью признаков, связанных с передне-задней дифференцировкой туловища (относительная длина отделов тела, число позвонков в них и т. п.) Поэтому логично было предположить, что Hox -кластеры чешуйчатых должны обладать специфическими особенностями и что Hox-гены ящериц и змей должны различаться.
Ранее было показано, что области экспрессии передних Hox -генов у змей расширились в заднем направлении по сравнению с другими позвоночными. Это хорошо согласуется с общим удлинением тела. Кроме того, было установлено, что правило колинеарности (т. е. одинаковый порядок расположения генов в кластере и областей их экспрессии в эмбрионе) у змей строго соблюдается.
Исследователи сосредоточились на задних Hox -генах (от 10-го до 13-го). Главными объектами исследования были хлыстохвостая ящерица Aspidoscelis uniparens и маисовый полоз Elaphe guttata. Кроме того, были отсеквенированы Hox -кластеры нескольких других ящериц, гаттерии и черепахи. Для сравнения использовались Hox -кластеры курицы, человека, мыши и лягушки. Набор задних Hox-генов у всех исследованных видов оказался одинаковым, если не считать того, что у змей и лягушек «потерялся» ген Hoхd12 (12-й Hox -ген из кластера D ). Важные изменения были обнаружены в регуляторных участках Hox -кластеров. Оказалось, что все чешуйчатые рептилии утратили регуляторный участок между
генами Hoхd13 и Evх2 97, а змеи вдобавок потеряли консервативный некодирующий элемент между Hoхd12 и Hoхd13 и некоторые регуляторные участки в других Hox -кластерах. Неожиданным результатом оказалось присутствие в Hox -кластерах чешуйчатых множества встроившихся мобильных генетических элементов. В результате общая длина
96Один такой пример рассмотрен в книге «Рождение сложности» на страницах 340–342. Там идет речь о связи утраты млекопитающими ребер на поясничных позвонках с генами Hox10 .
97Evn2 (even-skipped homeobox 2 ) – последний, четырнадцатый ген Hox -кластера. Название even skipped («четные пропущены») связано с тем, что у дрозофилы этот ген участвует в разбиении тела на сегменты, причем экспрессируется только в нечетных сегментах.
379
задней части Hox-кластеров у чешуйчатых значительно выросла по сравнению с другими наземными позвоночными.
Все это, по-видимому, говорит о том, что у чешуйчатых ослабли эволюционные ограничения, препятствующие накоплению изменений в задней части Hox-кластеров. Очищающий отбор, отбраковывающий подобные изменения у других позвоночных, в эволюции ящериц и змей действовал менее эффективно. Этот вывод подтвердился и в ходе анализа кодирующих участков Hox -генов. В этих участках у ящериц, и особенно у змей, по сравнению с другими позвоночными накопилось много значимых замен. Одни из них, по-видимому, зафиксировались случайно, из-за ослабления очищающего отбора, тогда как другие закрепились под действием положительного отбора, т. е. были полезными.
Изучение характера экспрессии задних Hox -генов у эмбрионов ящерицы и полоза подтвердило предположение о том, что изменения плана строения в эволюции чешуйчатых были тесно связаны с изменениями в работе задних Hox -генов.
У ящерицы, как и у других наземных позвоночных, передний край области экспрессии генов Hoxa10 и Hoxc10 в точности соответствует границе между грудным и поясничным отделами. Одной из функций этих генов является подавление развития ребер. У змей нет поясничного отдела, а на бывших крестцовых позвонках (у змей они называются клоакальными) имеются особые раздвоенные ребра. По-видимому, эти особенности связаны с тем, что Hox -гены у предков змей утратили способность останавливать рост ребер.
Область экспрессии Hoxa10 и Hoxc10 у полоза заходит далеко в грудной отдел. Эти гены отвечают также за своевременное прекращение роста грудного отдела. По-видимому, эта их функция у змей тоже ослаблена, что могло быть одной из причин удлинения грудного отдела у змей по сравнению с их предками – ящерицами. Удлинение хвостового отдела у змей связано с тем, что из четырех генов, «тормозящих» рост хвоста у ящериц (Hoxa13, Hoxc13, Hoxd13, Hoxd12) один ген у змей полностью утрачен (Hoxd12 ), а два других (Hoxa13, Hoxd13) не участвуют в передне-задней «разметке» эмбриона и используются только в формировании половых органов.
Многочисленные случаи независимой утраты и частичной редукции конечностей у чешуйчатых тоже могут быть связаны с тем, что в этом отряде задние Hox -гены получили нетипичную для других животных эволюционную «свободу». На них стал слабее действовать очищающий отбор, что позволило быстро накапливать мутации (рис. 89).
Известно, что задние Hox -гены играют ключевую роль не только в оформлении задних отделов туловища, но и в развитии конечностей. Поэтому некоторые мутации этих генов, ведущие, например, к удлинению тела или к редукции поясничного отдела, теоретически могут приводить и к таким побочным эффектам, как редукция конечностей. Удлинение тела в сочетании с редукцией конечностей встречается и в других группах позвоночных (например, у некоторых амфибий). Было ли это связано с такими же изменениями в работе Hox -генов, как у змей, или с другими, покажут дальнейшие исследования (рис. 89).
Эволюционная биология развития – быстро развивающаяся дисциплина, от которой следует ожидать важнейших научных прорывов. Расшифровка генно-регуляторных сетей, управляющих развитием, – одна из самых насущных задач биологии. Ее решение позволит понять не только соотношение между генотипом и фенотипом, но и важнейшие правила и закономерности эволюции сложных организмов.
Когда эти правила, известные нам сегодня лишь в общих чертах, будут изучены досконально, вплоть до построения строгих математических моделей, перед человечеством откроются небывалые возможности. Проектирование «с чистого листа» биологических систем с нужными нам свойствами – лишь одна из них. Другая – совершенствование нашей собственной природы. Все это будет. Нужно лишь четко уяснить, для каких целей это нужно будущему человечеству, и надеяться, что культурное, социальное и морально-этическое развитие человечества к тому времени исключит возможность использования этих открытий во вред.
380
