
Сафонов А.И. Эволюционное учение. Классики и современники
.pdf
281

282
Видообразование вокруг нас
В современной биосфере полным-полно примеров видообразования, происходящего
«здесь и сейчас». Все эти бесчисленные спорные виды, полувиды, супервиды, кольцевые виды, видовые комплексы и «букеты видов » (species flocks) – не что иное, как примеры незавершенного (или завершенного недавно) видообразования, в ряде случаев – очень быстрого.
Эволюция, как мы помним, процесс медленный. Но это в среднем. Темпы эволюции крайне неравномерны: вид может существовать, почти не меняясь, сотни тысяч и миллионы лет, а потом очень быстро – за считаные тысячелетия или даже века – сильно измениться или разделиться на несколько видов. Неудивительно, что те виды, которые находятся в фазе быстрых перемен именно в наши дни, привлекают особое внимание биологов.
Один из таких видов – трехиглая колюшка, небольшая рыбка, обычная в морях, реках и озерах Северного полушария. Стимулом для быстрой эволюции у колюшки стало освоение этой исходно морской рыбой пресных водоемов, что, в свою очередь, было связано с отступлением ледников около 10 тыс. лет назад и образованием на их месте множества больших и малых озер.
Эволюционные изменения у колюшки дальше всего зашли в семи озерах у тихоокеанского побережья Британской Колумбии (Юго-Западная Канада), где эти рыбки фактически разделились на два вида: придонный и пелагический (живущий в толще воды). Первый вид питается донными беспозвоночными, второй охотится на планктонных беспозвоночных в верхних слоях воды. Виды различаются не только диетой и образом жизни, но и размерами (придонный вид крупнее), формой тела, деталями строения, а также – что особенно важно – брачным поведением. Виды практически не скрещиваются между собой в природе, и даже если посадить в аквариум двух разнополых представителей придонного и пелагического видов, не оставив им возможности выбирать партнера, они, скорее всего, не станут скрещиваться (Rundle et al., 2000).
Зато пелагические колюшки из разных озер охотно скрещиваются друг с другом, так же как и придонные. И это несмотря на то, что разделение исходного вида на два произошло в семи озерах параллельно, т. е. независимо! (Здесь трудно не вспомнить аналогичные результаты, полученные в экспериментах по искусственному видообразованию.) В некоторых других американских озерах подразделение на придонный и пелагический виды наметилось, но не зашло так далеко. Во многих озерах подразделения вовсе нет: там живет исходная «генерализованная» форма колюшки, которая охотится как у дна, так и в толще воды.
Перед нами – типичный случай симпатрического видообразования. В данном случае движущим фактором видообразования было разделение исходной ниши и экологическая специализация.
О влиянии экологических факторов на видообразование мы знаем не так уж мало. Например, мы знаем, что видообразование во многом определяется и направляется набором доступных ниш. Что касается колюшек, то их разделению на два вида способствуют глубина озера и разнообразие условий в нем (например, одновременное наличие обширных отмелей и обрывистых берегов, под которыми сразу глубоко). Гораздо меньше ясности в вопросе о том, существует ли обратное влияние видообразования на свойства экосистемы. Теоретически такое влияние должно существовать. Например, модели предсказывают, что два специализированных хищника должны влиять на численность жертв иначе, чем один неспециализированный, «обобщенный» хищник. Однако проверить эти теории трудно. Колюшки (рис. 47) – удобный объект для таких исследований, чем и воспользовались недавно биологи из США и Канады (Harmon et al., 2009).
283
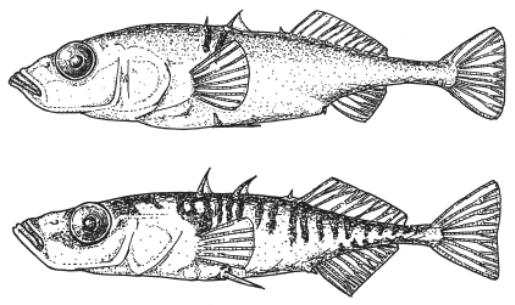
Рис. 47 – Придонная (вверху) и пелагическая (внизу) формы трехиглой колюшки. Harmon et al., 2009
Эксперименты проводились в цилиндрических аквариумах диаметром 2 м и глубиной 1 м. Каждый аквариум представлял собой маленькую экосистему. Сначала в него наливали чистую воду и насыпали на дно песок. В воду добавляли немного азотных и фосфорных удобрений, чтобы сделать возможным развитие фитопланктона. Затем в каждый аквариум добавляли по 2,5 л донного материала из двух озер, в одном из которых колюшка подразделилась на два вида, а в другом нет. Этот ил со дна озер содержал в себе яйца и споры всевозможных мелких озерных обитателей. Через неделю, когда в аквариуме уже вовсю кипела жизнь, туда выпускали колюшек.
В первые десять аквариумов посадили колюшек исходного вида, т. е. «генералистов», не подразделенных на пелагическую и бентосную формы (опыт 1). В две другие группы по десять аквариумов посадили придонных и пелагических колюшек (опыты 2 и 3). Наконец, в последние десять резервуаров выпустили представителей придонного и пелагического видов вместе (опыт 4). Рыбок мерили не штуками, а граммами: в каждый аквариум сажали от 5 до 6 г колюшек. Поскольку три формы колюшек различаются по размеру, это соответствовало разному количеству рыб (от трех массивных придонных рыб до шести худосочных пелагических). Затем в течение десяти недель ученые следили за состоянием «экосистем».
Сравнивая результаты опытов 1 и 4, исследователи намеревались оценить влияние диверсификации колюшек на экосистему. Опыты 2 и 3 нужны были для того, чтобы, сравнивая их с опытом 4, можно было выяснить, какие аспекты этого влияния объясняются разнообразием (числом видов) колюшек, а какие – их поведением и экологической специализацией.
Оказалось, что и разнообразие колюшек, и их специализация заметно влияют на свойства экосистемы. Эффекты оказались сложными, многообразными и не всегда соответствующими тому, что ожидалось на основе теоретических моделей. Например, можно было предположить, что пелагический вид – охотник на планктонных рачков и другие мелкие организмы – будет способствовать увеличению продуктивности экосистемы (потому что производителям органики – одноклеточным водорослям – станет легче жить, если колюшки съедят тех, кто ими питается). Но это не подтвердилось: фитопланктон лучше развивался не там, где имелись пелагические колюшки, а там, где жили колюшки исходного вида. Дело в том, что зоопланктон в аквариумах был разнообразен и далеко не все его представители являются строгими вегетарианцами. Многие планктонные рачки охотятся на других рачков, тем самым способствуя росту биомассы фитопланктона. Поэтому итоговая продуктивность системы зависит не столько от эффективности выедания рачков рыбами, сколько от того, каких именно рачков они будут поедать. А в этом отношении три вида
284

колюшек заметно отличаются друг от друга.
Кроме различий в составе фито- и зоопланктона были выявлены различия в прозрачности воды. Этот показатель связан с количеством фитопланктона и с составом растворенной органики, причем эти связи сложны и неоднозначны. Самая прозрачная вода была в опыте 1, самая мутная – в опытах 2 и 4. По расчетам авторов, диверсификация колюшек (или ее отсутствие) может объяснить до 10 % тех различий в прозрачности воды, которые наблюдаются в реальных озерах, населенных колюшками. Это существенная величина, особенно если учесть, что прозрачность воды сильно влияет на развитие фотосинтезирующих организмов в озерах, а следовательно и на экосистему в целом.
Таким образом, видообразование, происходящее в последние 10 тыс. лет у колюшек в канадских озерах, существенно влияет на озерные экосистемы. Это влияние должно сказываться и на эволюции других озерных жителей. В частности, диверсификация колюшек может способствовать видообразованию у других организмов, т. е. порождать «цепные реакции видообразования». Для проверки этого предположения необходимы дополнительные исследования.
–––––
Направленность эволюции колюшек зависит от наличия убежищ
Итак, около 10 тыс. лет назад трехиглая колюшка, исходно морская рыбка, стала осваивать пресные водоемы, образовавшиеся на месте растаявших ледников. Освоение пресных вод сопровождалось морфологическими изменениями, которые происходили независимо в разных популяциях. Одним из таких изменений является облегчение костяного панциря – уменьшение числа пластин, защищающих тело с боков. У морских колюшек пластин больше, чем у пресноводных. В основе этого эволюционного изменения лежат закрепленные отбором мутации в гене Ectodysplasin, который регулирует развитие эпителиальных структур. У людей мутации этого гена являются причиной наследственного заболевания – ангидротической эктодермальной дисплазии (рис. 48).
Рис. 48 – В ходе приспособления к жизни в пресных водоемах у многих популяций трехиглой колюшки уменьшилось число костных пластинок на боках. Marchinko, 2009
Есть три основные гипотезы о причинах уменьшения числа пластин у колюшек при переходе к жизни в пресных водах. Согласно первой, все дело в большей «дороговизне» костной ткани в пресных водоемах по сравнению с морем. В озерах и реках, где живут колюшки, меньше кальция, чем в морской воде, поэтому для того, чтобы вырастить костяной панцирь, рыбкам приходится тратить больше калорий.
Вторая гипотеза винит во всем хищных пресноводных насекомых, таких как гладыши и личинки стрекоз. Показано, что шипы и броня колюшек защищают их от хищных рыб, повышая шансы схваченной рыбки вырваться из зубов хищника. Но против насекомых эти
285
средства защиты бессильны: шестиногим хищникам даже удобнее хватать мальков за их колючки и костяные пластинки (со взрослой рыбкой насекомые не могут справиться). Экспериментально установлено, что хищные насекомые действительно могут избирательно выедать мальков с длинными колючками и тяжелой броней (Marchinko, 2009).
Третья гипотеза предполагает, что причина редукции брони – в разной доступности укрытий. Морские колюшки плавают в толще воды, где спрятаться абсолютно негде. Остается полагаться на броню. В пресных водоемах колюшки стали держаться ближе ко дну, где укрытий достаточно. Возможно, в этой ситуации для колюшек решающее значение приобрела маневренность и способность быстро юркнуть в укрытие. Эксперименты показали, что облегченная броня действительно улучшает маневренность и способность к «быстрому старту». Однако нужно еще доказать, что при наличии укрытий колюшки с облегченным панцирем действительно получают селективное преимущество, т. е. реже поедаются хищниками.
Недавно это удалось сделать биологам из Хельсинкского университета (Leinonen, 2011). Они сажали группы колюшек с полным и неполным набором костных пластин в большие аквариумы со щуками, причем в половине аквариумов были укрытия, где колюшки могли спрятаться от хищника. Спустя три месяца подсчитывалось число выживших рыбок.
Результаты подтвердили гипотезу о роли укрытий в эволюции костной брони. В аквариумах без укрытий число пластин положительно коррелировало с выживаемостью: чем меньше у рыбки пластин, тем больше были ее шансы погибнуть в зубах щуки. В аквариумах с укрытиями все было наоборот: здесь вероятность выживания росла с уменьшением числа пластин (что объясняется ростом маневренности). Впрочем, это не исключает и две другие возможные причины редукции панциря (недостаток кальция и хищные насекомые). Ведь у этих гипотез тоже есть экспериментальные подтверждения. Вполне возможно, что все три фактора действуют вместе, что объясняет очень быструю эволюцию этого признака в некоторых водоемах.
Исследование подтвердило два важных эмпирических обобщения, которые иногда называют даже «аксиомами» эволюционной биологии: 1) полезность признака зависит от контекста: один и тот же признак может быть полезным для одних популяций и вредным для других, живущих в иных условиях; 2) эволюция – это постоянный поиск компромиссов: например, колюшки не могут быть одновременно юркими и бронированными, поэтому приходится выбирать что-то одно в зависимости от обстоятельств.
Завершая рассказ о колюшках, нельзя не упомянуть о примере обратимой эволюции, который эти рыбки продемонстрировали в озере Вашингтон на северо-западе США. Лет 50 назад у тамошних колюшек было мало костных пластин. К настоящему времени число пластин значительно выросло: колюшки фактически вернулись к своему прежнему, «морскому» состоянию. Предполагаемая причина в том, что вода в озере за это время очистилась, а в прозрачной воде колюшкам труднее спрятаться от хищной форели. Поэтому тяжелая броня снова стала для них более выгодной, чем маневренность.
–––––
«Великий эволюционный эксперимент» в африканских озерах
Рыбы цихлиды больших африканских озер – превосходный объект для изучения симпатрического видообразования. Во-первых, это пресноводная группа, а значит, они развиваются в относительно замкнутых (по сравнению с океаном, конечно) системах. Каждое озеро изначально было заселено небольшим числом рыб, которые стали быстро дивергировать, причем эволюция в каждом озере шла в значительной мере независимо. Как обычно бывает в подобных случаях, освоение сходных ниш вело к независимому появлению сходных жизненных форм. Во-вторых, цихлиды эволюционируют в озерах с известной геологической историей, а это хорошая подсказка для определения стартовой точки эволюции. Озера имеют разный возраст, но все они относительно молоды. В-третьих, цихлиды отлично выживают в лабораторных условиях и поэтому с ними возможны всякие эксперименты. Помимо этого, в каждом из великих африканских озер – Малави, Танганьика и Виктория – сосредоточены сотни эндемиков, для которых имеются надежно реконструированные генеалогии. Эндемичные виды цихлид образовались и в других озерах
286
поменьше, и они тоже оказываются в фокусе научного интереса.
Вприроде разные виды цихлид обычно не скрещиваются между собой (собственно, поэтому они и считаются видами, а не разновидностями). Репродуктивная изоляция обеспечивается в основном брачными предпочтениями, т. е. это презиготическая изоляция. Одним из главных факторов, обеспечивших быстрое видообразование у цихлид, был половой отбор.
Для предотвращения гибридизации, как мы уже говорили, вполне достаточно брачных предпочтений. Поэтому дополнительные изолирующие механизмы цихлидам не требуются,
иони могут не возникать очень долго. Генетическая несовместимость (постзиготическая изоляция) развивается пассивно, по модели Добжанского – Мёллера, и на это требуется много времени – несколько миллионов лет, иногда даже более 10 млн. Это вычислили, сопоставив эксперименты по межвидовой гибридизации с оценками времени расхождения видов по молекулярным часам с учетом геологической истории озер.
Ваквариуме представители разных видов и даже родов африканских цихлид легко скрещиваются и дают плодовитое потомство. Эти эксперименты выявили важный факт. Оказалось, что чем больше прошло времени с момента расхождения скрещиваемых видов, тем больше у гибридного потомства появляется новых признаков, отсутствующих у родителей (Stelkens et al., 2009). Таких, например, как живописный нарост над головой цветорога (flowerhorn) – гибридной цихлиды, выведенной, правда, не биологами, а восточноазиатскими любителями красивых рыбок.
Стоит ли удивляться, что цихлиды стали излюбленным объектом для изучения адаптивной радиации – приспособления к разным экологическим нишам. «Великий эволюционный эксперимент Природы» – так именуют африканских цихлид исследователи (Barlow, 2000). Изучение сводного массива данных по 46 африканским озерам позволило Кэтрин Вагнер с коллегами выявить факторы, значимые для эволюции цихлид (Wagner et al., 2012). Исследователи проделали кропотливую работу, сопоставив множество экологических, морфологических и поведенческих признаков с темпами эволюции цихлид в разных озерах. Темпы видообразования оценивались по числу эндемиков и оказались очень разными в разных озерах. По-видимому, различия определялись какой-то озерной спецификой. Но какой?
Оказалось, что на темпы видообразования влияет, во-первых, возраст озера (чем старше, тем вероятнее появление эндемиков), во-вторых, глубина озера (чем глубже, тем больше вероятность дивергенции), в-третьих, различия в окраске у самок и самцов: если самцы и самки одинаково окрашены (что обычно свидетельствует о слабом половом отборе), то видообразование менее вероятно.
Что ж, выводы ожидаемые: для эволюции нужно время; разнообразие экологических обстановок способствует видообразованию; половой отбор является мощным фактором видообразования. Такой превосходный объект, как цихлиды, позволяет увидеть много, много больше. Например, можно попытаться расшифровать взаимосвязи между изменениями генотипа и фенотипа. Или выяснить, как происходит параллельная эволюция в разных линиях.
Первая из этих задач – архиважная для понимания механизмов эволюции, но пока прочитано не так уж много геномов цихлид. Главное, что обнаруживается при сравнении геномов рыб из одного озера – это высокое сходство ДНК у внешне различных рыб. В своей эволюционной истории они разошлись так недавно, что нейтральные различия в геноме не успели накопиться. А для поддержания презиготической изоляции достаточно небольшого числа поддержанных отбором мутаций (отвечающих за признаки окраски, брачного поведения, избирательности). В основе расхождения цихлид по трофическим нишам (типам питания) лежали изменения всего нескольких ключевых генов-регуляторов, контролирующих развитие челюстей, причем эти гены находились под действием сильного разнонаправленного отбора (Albertson, Kocher, 2006). Еще один важный вывод: наибольшие различия в геноме относятся к регуляторным последовательностям, а не белок-кодирующим.
287
Быстрая адаптация шла за счет тонкой настройки регуляции развития (Santos, Salzburger, 2012).
Вторая тема – генетические механизмы параллельной эволюции. Марко Коломбо и его коллеги из Базельского университета и Национального музея естественных наук в Мадриде проанализировали это явление на примере одного из характерных фенотипов цихлид – рыб с толстыми губами (Colombo et al., 2012). Выбранный признак – толстые губы – встречается не только у африканских цихлид, но и у центральноамериканских. Африка с Америкой потеряли связь около 100 млн лет назад, поэтому можно исключить и наследование признака от общего предка, и случайное расселение носителей признака, а вместо этого сосредоточиться на собственно параллельной эволюции.
Как выяснилось, толстые мясистые губы у цихлид вместе с некоторыми другими экстерьерными признаками возникали при переходе на специфическую диету – беспозвоночных с твердыми панцирями. Какие гены изменились, чтобы сформировать мясистые губы? В поисках ответа исследователи выделили РНК из тканей губ у толстогубых и тонкогубых цихлид и насчитали около 140 генов, по активности которых тонкогубые отличаются от толстогубых. Затем из этого набора кандидатов было придирчиво выбрано шесть генов. Нужно было, чтобы гены были связаны функционально с морфогенезом тканей губ и чтобы количество РНК у тонкогубых и толстогубых особей различалось контрастно. Всю процедуру сравнения проделали по отдельности для африканского озера Танганьика и центральноамериканского озера Манагуа. Три гена из шести отличали толстогубых рыб от тонкогубых в обеих выборках и удовлетворяли выбранным критериям. Эти гены отвечают за образование рыхлой соединительной и жировой ткани. А раз нашлись сходные генетические различия, то авторы закономерно заключили, что параллельное появление полезного признака произошло из-за изменения экспрессии именно этих сходных генов.
По-видимому, существует не так уж много способов сформировать конкретный признак, поэтому, если отбор начнет его поддерживать в двух разных линиях, это с большой вероятностью приведет к изменениям в работе одних и тех же генов. В целом сейчас известно больше примеров, иллюстрирующих принцип «сходный признак – сходные гены», чем «сходный признак – разные гены». С многочисленными примерами проявления обоих принципов мы уже познакомились. Складывается впечатление, что первый из принципов чаще реализуется в небольших компактных группах, второй – у организмов, представляющих удаленные ветви эволюционного дерева.
Эволюция цветного зрения и видообразование
Зрение у цихлид играет важную роль при выборе партнера: самцы каждого вида имеют свой особый наряд, а самки превосходно разбираются в нюансах их окраски. Зрение может быть специально настроено на спектральные характеристики брачного наряда: например, если самцы у данного вида синие, то и глаза наиболее чувствительны именно к синим оттенкам. Или, может быть, причинная связь направлена в обратную сторону: если глаза у данного вида лучше всего различают оттенки синего (например, потому, что это оптимально для поиска пропитания), то и самцам выгодно нарядиться в костюмчик этих оттенков, чтобы самки скорее их замечали. Так или иначе, то обстоятельство, что один и тот же признак – характеристики цветного зрения – тесно связан и с экологическими (пищевыми) адаптациями, и с выбором брачного партнера (а значит, и с презиготической изоляцией), открывает редкие возможности для видообразования (Terai et al., 2006).
Мы уже говорили об эволюции цветного зрения в главе 5. Доступный нам мир красок определяется разнообразием опсинов – светочувствительных белков-колбочек. Чтобы приобрести способность воспринимать новые оттенки, не нужно даже менять что-то в мозге
– достаточно добавить в сетчатку новый опсин. На примере опсинов удобно изучать эволюцию, поскольку в данном случае имеет место однозначное соответствие между генами и фенотипическими признаками (особенностями цветового восприятия).
Исследователи из США, Австралии и Швейцарии изучили опсины у 54 видов цихлид
288
из озера Малави и 11 видов из озера Виктория (Hofmann et al., 2009). У цихлид есть один ген «черно-белого» опсина-палочки (Rh1 ) и целых шесть классов «цветных» опсинов-колбочек: SWS1 (ультрафиолетовый), SWS2B (фиолетовый), SWS2A (синий), Rh2B (сине-зеленый), Rh2A (зеленый), LWS (красный). Наше унаследованное от обезьян трихроматическое зрение, вероятно, позволяет нам видеть лишь бледную тень того богатства красок, которое доступно цихлидам с их гексахроматическим зрением (впрочем, новейшее исследование по различению цветов у гексахроматических раков-богомолов не подтверждает этой «радужной» гипотезы (Thoen et al., 2014)). У цихлид сетчатка устроена сложнее, чем у млекопитающих. Колбочки делятся на «простые» и «двойные». В простых колбочках экспрессируются коротковолновые гены SWS, в двойных – длинноволновые Rh2 и LWS.
Как выяснилось, разные виды цихлид, в том числе и близкородственные, сильно различаются по активности шести опсиновых генов. В озере Малави, где вода прозрачная, цихлиды используют все шесть генов, хотя и в разной степени. Малавийские виды распадаются на три группы, сетчатка которых наиболее чувствительна к коротким, средним и длинным световым волнам. В озере Виктория, где вода мутная, цихлиды почти не используют гены ультрафиолетового и сине-зеленого опсинов. Их сетчатка наиболее чувствительна к длинноволновому свету, который лучше проходит сквозь мутную воду. Напомним, что ультрафиолетовый опсин является самым коротковолновым из опсинов простых колбочек, а сине-зеленый – самый коротковолновый из опсинов двойных колбочек.
Эти различия между озерами, по-видимому, отражаются и на окраске рыб: у рыб из Малави чаще встречаются синие и фиолетовые тона, у рыб из Виктории – красные и желтые.
Авторы сопоставили активность опсиновых генов с экологическими характеристиками рыб, а именно с питанием и типом местообитания. Оказалось, что только у одного гена (ультрафиолетового) активность тесно связана с типом питания. Среди рыб озера Малави наибольшая активность ультрафиолетового гена характерна для видов, питающихся планктоном или водорослями, наименьшая – для хищников. Экспериментально было показано, что способность воспринимать свет в ультрафиолетовом диапазоне повышает эффективность питания у рыб-планктофагов. Среди цихлид озера Виктория тоже встречаются и планктофаги, и фитофаги, и хищники, однако ультрафиолетовый ген ни у кого из них не работает – ни у планктофагов, ни у хищников, потому что мутная вода Виктории непрозрачна для ультрафиолета.
В озере Виктория, как выяснилось, спектр активности опсиновых генов связан с мутностью воды в конкретных местообитаниях, а также с глубиной, на которой живут представители данного вида. Чем мутнее вода и чем глубже обитают рыбы, тем слабее у них работает фиолетовый опсиновый ген, самый коротковолновый после ультрафиолетового.
Авторы также изучили межвидовые различия в аминокислотных последовательностях опсинов, влияющие на их чувствительность к волнам разной длины. В озере Малави самым вариабельным оказался ультрафиолетовый опсин, в Виктории – красный. Выявленные различия меняют оптимум восприятия красного опсина на 5-15 нм. У видов, обитающих на больших глубинах, где доступная цветовая гамма сильно смещена в длинноволновую сторону, туда же смещена и чувствительность красного опсина.
Таким образом, эволюция цветового восприятия у цихлид шла двумя путями: за счет изменения активности опсиновых генов и за счет изменения их кодирующих участков. Первым путем достигалась тонкая подстройка восприятия под особенности среды и образа жизни. Второй способ помогал менять границы воспринимаемого спектра – именно поэтому изменение аминокислотных последовательностей происходило преимущественно у двух «крайних» опсинов, ультрафиолетового и красного. Ученые рассчитали, учитывая различные экологические характеристики озер, что в прозрачном озере Малави на эволюцию цветового зрения сильнее влиял тип питания, в Виктории – спектральные характеристики доступного рыбам света, зависящие от мутности воды и глубины.
Столь высокое разнообразие цветового восприятия в пределах одной группы родственных видов – случай уникальный, не имеющий аналогов у позвоночных. Самое
289
удивительное, что все эти различия развились быстро: озеру Малави 1–2 млн лет, Виктории
–не более 120 тыс. лет. Обнаруженные различия в активности опсиновых генов смещают оптимум цветового восприятия очень сильно – до 100 нм. Разные виды цихлид действительно видят мир в разных красках. Это влияет как на их поведение, так и на эволюцию других признаков – прежде всего их собственной окраски. Африканские цихлиды
–одна из самых разнообразных по окраске групп пресноводных рыб (неслучайно их так любят аквариумисты). Теперь мы узнали, что и цветовое зрение у них тоже удивительно разнообразно.
Многие факты говорят о том, что видообразование у цихлид в озере Виктория происходит под действием так называемого сенсорного смещения или сенсорного драйва (Seehausen et al., 2008). Так называют влияние особенностей органов чувств на направленность полового отбора. Например, если данный вид лучше всего видит красные объекты, самцам выгодно быть красными, чтобы привлекать внимание самок. Им выгодно также красоваться перед самками в таких местах (на такой глубине), где их краснота смотрится наиболее эффектно, более заметна для самок. Если интенсивность окраски у самца отражает его здоровье и качество генов, т. е. является индикатором приспособленности (а это обычно так и бывает), то самкам выгодно научиться еще лучше различать оттенки красного. Самки с наилучшей способностью различать эти оттенки выберут лучших самцов и оставят больше потомства, причем их сыновья унаследуют «удачный» брачный наряд от отца, а дочери – пристрастие к таким нарядам от матери.
Врезультате эволюция под действием полового отбора может приобрести черты автокаталитического процесса: рост интенсивности окраски будет стимулировать рост избирательности самок, и наоборот. Это может завести вид очень далеко по пути развития яркого наряда и изощренной системы цветового восприятия. Вряд ли можно сомневаться, что практически все наблюдаемое у африканских цихлид буйство красок возникло под действием полового отбора, ведь для выживания вся эта пестрота не имеет существенного значения.
Эволюционный стартап у бабочек-подражателей
Коллекция хорошо изученных случаев симпатрического видообразования быстро пополняется. Разные пары расходящихся симпатрических видов и даже целые их «букеты» застигнуты исследователями на разных стадиях расхождения. Наименее изученными остаются начальные этапы этого процесса, когда популяция еще остается единой, но внутри нее уже зарождается презиготическая изоляция между особями с разными признаками.
Как показало исследование, выполненное сотрудниками Гарвардского, Гавайского и Техасского университетов, именно такая ситуация наблюдается в наши дни у бабочек
Helicomus cydno alithea , обитающих в западном Эквадоре (Chamberlain et al., 2009). Бабочки рода Heliconius защищены от хищников, во-первых, своей ядовитостью, во-вторых, яркой предупреждающей окраской. При этом у них широко распространена так называемая мюллеровская мимикрия – маскировка одних ядовитых видов под другие (другой вид мимикрии – бейтсовская, при которой неядовитые виды маскируются под ядовитые). Мюллеровская мимикрия ускоряет обучение хищников: «обжегшись» на одной из ядовитых бабочек, хищник уже не будет испытывать судьбу, нападая на другие похожие виды. На бабочках Heliconius было показано (в том числе при помощи экспериментов по переселению бабочек из одних частей ареала в другие), что приспособленность бабочек-подражателей напрямую зависит от частоты встречаемости бабочек-моделей: из всех подражателей самая высокая приспособленность у тех, кто маскируется под наиболее массовый вид «моделей» в данной местности.
Ранее были изучены две пары подражающих друг другу видов Heliconius cydno galanthus / H. sapho и H. pachinus / H. hewitsoni, обитающие по разные стороны водораздела в Коста-Рике. То есть с каждой стороны водораздела поселились по два вида, по одной паре
290
