
Bilet_1
.pdf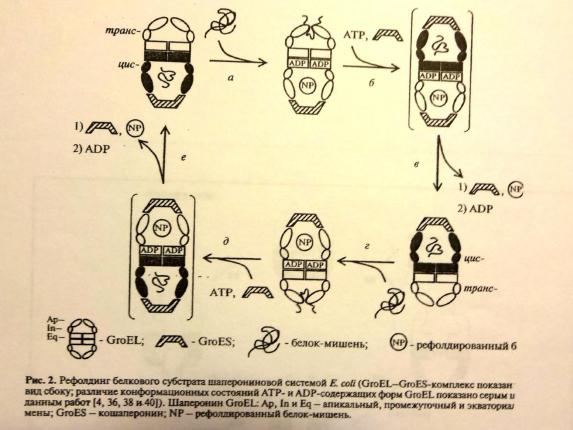
Билет №1.
1. Шаперонины про- и эукариот.
Шаперонины – группа шаперонов, ролью которых является временное экранирование белка от окружающей среды. Эти белки представляют собой олигомерные комплексы (14-16 субъединиц), имеющие форму «бочонка» с центральной полостью, в которую активно (с затратой АТФ) заключается развернутый белок. Полость формируется двумя состыкованными кольцами из 7-8 субъединиц. Шаперонины разделяют на два класса: I и II, присутствующие в прокариотах (I) и эукариотах и архебактериях (II), причём они радикально отличаются по связыванию белковых субстратов.
К группе I шаперонинов относится хорошо изученный шаперонин GroEL из Escherichia coli, состоящий из 14 идентичных субъединиц, выстроенных в два состыкованных кольца по 7 мономеров в каждом. «Закрывание» этого шаперонина происходит с помощью «крышки» — кофакторагептамера GroES, присоединяющегося к GroEL после связывания последнего с АТФ.
Шаперонины группы II, обнаруженные в эукариотах и архебактериях, хотя и устроены схожим образом, существенно отличаются от бактериальных шаперонинов. Во-первых, они не являются гомоолигомерами — так, каждое из колец шаперонина TRiC (также известного под аббревиатурой CCT) состоит из восьми различающихся, хотя и родственных субъединиц. Во-вторых, у этих шаперонинов нет отдельной «крышки» — доступ во внутреннюю полость может перекрываться апикальными участками тех же молекул, что образуют сам шаперонин. Отличия в устройстве позволяют шаперонинам группы II взаимодействовать со многими исключительно эукариотическими белками — например, актином, который не может быть корректно свёрнут при участии бактериальных шаперонинов.
Два кольца шаперонина TRiC работают подобно двухтактному двигателю, — когда одно кольцо замыкается, открывается второе, «выпуская на волю» уже свернувшийся в недрах шаперонина белок. Время, в течение которого белок находится в полости, очень важно — ведь и слишком короткий, и слишком длительный срок приведёт к получению неработоспособного белка; однако механизмы, регулирующие эту длительность, пока совсем не изучены.
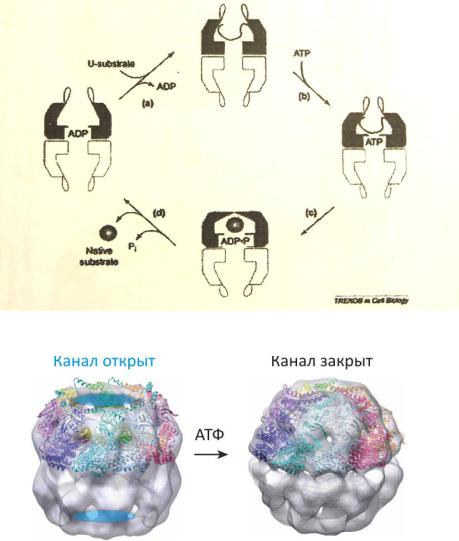
Устаревший механизм действия:
Модель, предложенная Джудит Фридман в 2008 году (на основе криомикроскопического анализа высокого разрешения):
Переход из открытой формы в закрытую связан с потреблением АТФ. Сворачиваемый белок, попадающий в результате этого на какое-то время в изолированное пространство внутри шаперонина, приобретает требуемую конформацию, после чего выходит из противоположных «ворот» шаперонина. Механизм открывания и закрывания канала эукариотического шаперонина напоминает действие диафрагмы фотоаппарата.
Компьютерная реконструкция работы шаперонина позволила выявить разные механизмы в эволюционно родственных белках — шаперонинах групп I и II. Однако многие детали работы шаперонинов так и остаются непонятыми.
2. Анализ аминокислотного состава белка. Определение N- и C-концевых аминокислот.
Для определения аминокислотной последовательности белка прежде всего разделяют его полипептидные цепи (если макромолекула состоит из нескольких цепей). Затем определяют аминокислотный состав цепей, N- и С-концевые аминокислотные остатки и аминокислотные последовательности. Полипептидные цепи подвергают специфическому расщеплению протеолитическими ферментами или хим. реагентами. Смесь образовавшихся фрагментов разделяют и для каждого из них определяют аминокислотный состав и аминокислотную последовательность. При необходимости крупные фрагменты дополнительно расщепляют на более мелкие. Порядок расположения фрагментов выясняют путем расщепления молекулы белка по др. связям и анализа образующихся при этом "перекрывающихся" фрагментов.
Анализ аминокислотного состава включает полный гидролиз исследуемого белка или пептида и количественное определение всех аминокислот в гидролизате. Для гидролиза обычно используют 5н водный р-р НСl, а при анализе содержания триптофана – 4н метансульфоновую к-ту, содержащую
0,2% 3-(2-аминоэтил) индола, или кипячение со щелочью. Количественное определение аминокислот в гидролизате проводят с помощью аминокислотного анализатора. В большинстве таких приборов смесь аминокислот разделяют на ионообменных колонках, детекцию осуществляют спектрофотометрически по реакции с нингидрином или флуориметрически с использованием флуорескамина или о-фталевого диальдегида. В последнем случае можно анализировать до 0,1-0,05 нмоль аминокислоты.
Наибольшее распространение для определения N-концевых остатков находит дансильный метод. Его первая стадия – присоединение дансилхлорида (1-диметиламинонафталин-5-сульфохлорида) к непротонированной α-аминогруппе с образованием дансилпептида (ДНС-пептида). Затем последний гидролизуют 5,7 н р-ром НСl при 105 °С, в результате чего освобождается N-концевая α-ДНС- аминокислота, которая обладает интенсивной флуоресценцией в УФ-области спектра; для ее идентификации достаточно 0,1-0,5 нмоль вещества.
Для определения С-концевых остатков чаще всего используют ферментативный гидролиз карбоксипептидазами, которые специфически расщепляют пептидные связи, образованные С- концевыми остатками. Поскольку после отщепления концевых остатков фермент атакует последующие пептидные связи, измерение скорости отщепления отдельных аминокислот позволяет анализировать также и С-концевую аминокислотную последовательность.
Важнейший этап в определении первичной структуры белка – расщепление макромолекулы на пептидные фрагменты. Среди ферментативных методов расщепления наиболее широко используется гидролиз трипсином. Трипсин обладает уникальной субстратной специфичностью: гидролизует исключительно связи, образованные карбоксильными группами основных аминокислот – лизина и аргинина. Введение заместителей в боковые цепи лизина или аргинина препятствует гидролизу по остаткам модифицированных аминокислот и позволяет гидролизовать макромолекулы избирательно только по остаткам аргинина или лизина. Особенно часто используется модификация остатков лизина с последующим гидролизом белков по остаткам аргинина. Модифицирующие агенты – ангидриды дикарбоновых кислот (янтарной, малеиновой и цитраконовой). Из других протеолитических ферментов широко применяется протеаза из Staphylococcus aureus (гидролизует связи, образованные карбоксильными группами остатков глутаминовой кислоты, а в некоторых случаях и остатков аспарагиновой кислоты), а также химотрипсин и термолизин. Последние ферменты обладают более широкой специфичностью. Химотрипсин катализирует гидролиз пептидных связей, образованных карбоксильными группами ароматических аминокислот: тирозина, фенилаланина и триптофана. С меньшей скоростью гидролизуются связи лейцина, метионина и гистидина. Термолизин преимущественно расщепляет связи, образованные аминогруппой остатков с
гидрофобной боковой цепью (изолейцин, лейцин, валин, фенилаланин, тирозин, триптофан).
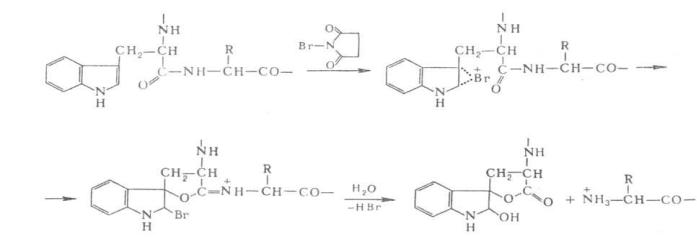
Для расщепления белков по карбонильной группе остатка триптофана используют N- бромсукцинимид или более селективный (BNPS-скатол):
Из химических методов расщепления белков наиболее специфичный и чаще всего применяемый - бромциановое расщепление по остаткам метионина (выход 90-100%):
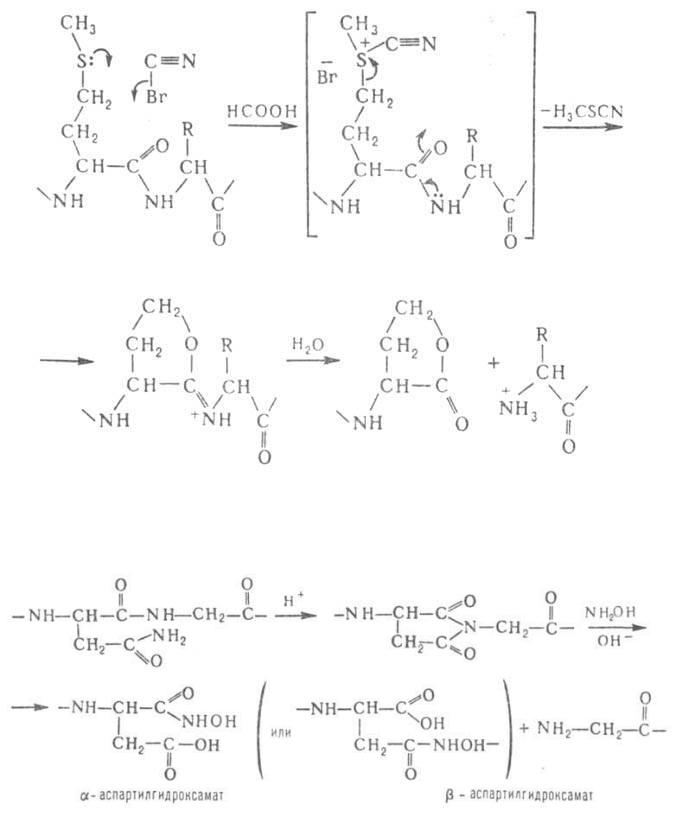
Гидроксиламин расщепляет пептидные связи между остатками аспарагина и глицина. При его взаимодействии с циклическим имидом ангидроаспартилглицина, спонтанно образующегося из аспарагинилглицина, в щелочной среде происходит расщепление пептидной цепи с образованием смеси α- и β-аспартилгидроксаматов:
В ряде случаев для расщепления белков используется метод частичного кислотного гидролиза. Наиболее чувствительны к действию кислот аспартильные пептидные связи и особенно связь аспартил - пропил.
При выборе методов разделения пептидов учитывают физ.-хим. свойства, кол-во и длину молекул разделяемых соединений. Для первичного фракционирования смесей коротких пептидов, содержащих до 15-20 аминокислотных остатков, в большинстве случаев используют ионообменную хроматографию на катионитах. Дальнейшее разделение и очистку проводят с помощью
хроматографии и электрофореза на бумаге или пластинках с тонким слоем целлюлозы или силикагеля.
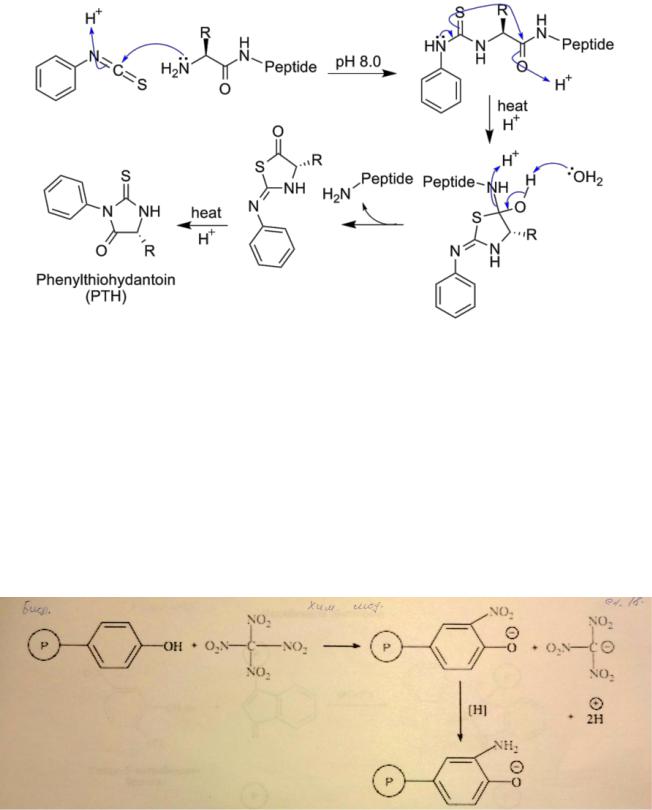
Осн. метод исследования аминокислотной последовательности пептидов и белков - хим. деградация с помощью фенилизотиоцианата. Этот метод позволяет последовательно отщеплять N-концевые аминокислотные остатки в виде фенилтиогидантоинов, к-рые абсорбируют свет в УФ-области с максимумом поглощения 265-270 нм. Для их идентификации наиб. часто используют тонкослойную хроматографию, жидкостную хроматографию высокого давления, а также масс-спектрометрию. Широкое применение нашел также метод, сочетающий последовательную деградацию пептида по Эдману с анализом N-концевых аминокислотных остатков в виде их дансильных производных. Достоинство метода -его высокая чувствительность.
Для непосредственного анализа первичной структуры белков обычно используют секвенатор - прибор, который с высокой эффективностью осуществляет последовательное автоматическое отщепление N-концевых аминокислотных остатков путем деградации белков по методу Эдмана.
3. Химическая модификация остатков тирозина и триптофана в белках.
Химические свойства тирозина определяются возможностями фенольной группы. Основные реакции химической модификации в данном случае – это реакции электрофильного замещения в ароматическом кольце.
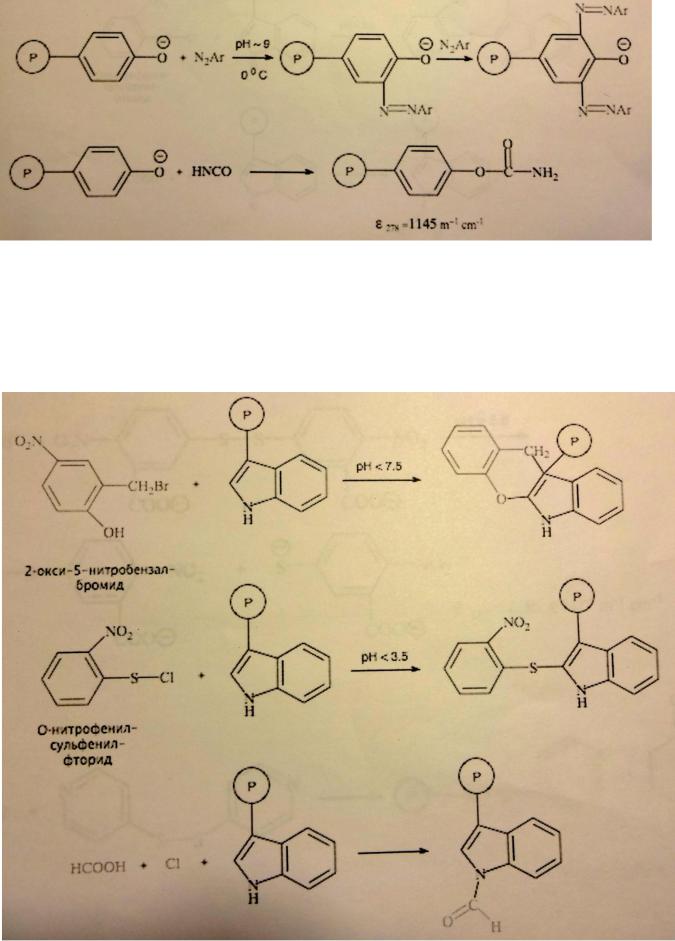
Для модификации остатков тирозина в молекулах белков используют нитрование тетранитрометаном и иодирование ароматического кольца, ацетилирование гидроксигруппы, реакции с бромсукцинимидом, цианурфторидом и диазониевыми соединениями. В пептидном синтезе фенольный гидроксил остатка тирозина защищают бензильной, 2,6-дихлорбензильной или трет-бутильной группой.
Основным реакционным центром триптофана в составе белка является индольное кольцо. π- Избыточный характер индола (а именно его пиррольного кольца) предопределяет его высокую реактивную способность по отношению к электрофильным реагентам.
Химическую модификацию остатков триптофана в молекулах белков проводят формилированием под действием муравьиной кислоты в соляной (последняя реакция на рисунке), сульфенированием с 2-нитрофенилсульфенилхлоридом (на фотографии фторид такой фторид) и конденсацией с 2-окси-5- нитробензалбромидом.
Билет №2.
1. Шаперон-зависимая автофагия как механизм специфической деградации белков в клетке.
Шапероны – класс белков, участвующих в формировании третичной и четвертичной структур белка и предохраняющих белки от агрегации. Белками теплового шока называют некоторые шапероны, экспрессия которых начинается в ответ на подъем температуры (а также другие повреждающие факторы), что содействует противостоянию неправильному сворачиванию белков. Также шапероны участвуют в транспорте белков (перенос субъединицы Rubisco из цитоплазмы в хлоропласт шапероном Hsp70), функционировании сигнальных путей (Hsp70 – часть антиапоптозного сигнального пути), регуляции действия молекул (Hsp90 блокирует стероидный рецептор в отсутствии его лиганда), и тому подобное и неподобное.
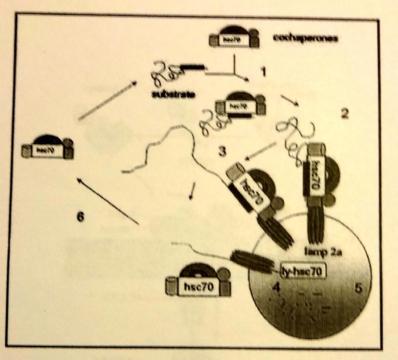
До сих пор не было известно иного способа утилизации белков, кроме убиквитинирования с последующей адресацией и разрушением в протеасоме. Однако, последние исследования британских учёных показали, что шапероны чуть менее, чем вездесущи: они могут принимать участие даже в деградации некоторых белков. Совсем недавно был выяснен механизм такой деградации, названной шаперон-зависимой автофагией, своей новизной вскружившей головы массе учёных. Процесс заключается в транслокации белка в лизосому, где он подвергается гидролизу под действием лизосомальных ферментов.
Этапы транспорта белка в лизосому:
hsc70 совместно с кошаперонами распознаёт пентапептид KFERQ в белке-мишени;
комплекс hsc70-мишень связывается с мультисубъединичным (вплоть до октамера) LAMP2A;
белок-мишень расплетается перед перемещением внутрь лизосомы;
для перемещения мишени в лизосому с ним связывается внутрилизосомальный шап. ly-hsc70;
белок-мишень расщепляется внутри лизосомы;
hsc70 отходит от мембраны лизосомы и готов взаимодействовать с новой мишенью.
Таким образом деградируется довольно широкий набор цитозольных белков, таких как рибонуклеаза А, некоторые гликолитические ферменты (альдолаза B, пируваткиназа, аспартатаминотрансфераза), некоторые транскрипционные факторы и ряд других белков.
2.Ферментативные методы гидролиза пептидных связей. Изменение специфичности действия трипсина с помощью химической модификации остатков K, R и С
гидролизуемого белка.
Реакции ферментативного гидролиза пептидных связей можно разделить на высокоспецифичные (Трипсин, протеаза из st. Aureus, лизин-специфическая протеаза, клострипаин, тромбин, протеаза из подчелюстной железы мышей, протеаза из почек ягненка) и низкоспецифичные (химотрипсин, термолизин, пепсин, папаин и эластаза).
Самым используемым в определении первичной структуры белка ферментом является трипсин – сериновая протеиназа, проявляющая наибольшую активность в диапазоне рН 7-9. Выделяется этот фермент из его предшественника, трипсиногена, получаемого из поджелудочной железы. В процессе выделения препарат загрязняется химотрипсином, низкоспецифичным ферментом, что создаёт серьёзные проблемы при оценке результатов трипсинолиза. Однако, есть способ избежать влияния такой контаминации: этого добиваются добавлением (1-тозиламидо-2-фенилэтил)-хлорметилкетона (ТФХК)– специфического ингибитора химотрипсина.
Трипсин уникален по своей субстратной специфичности, катализируя гидролиз связей, образованных карбокси-группами только основных аминокислот – лизина и аргинина. Выход такого гидролиза близок к 100%, однако может снижаться в случае локализации сайтов гидролиза на N- конце и соседстве с дикарбоновыми аминокислотами. Связи, образованные лизином или аргинином с пролином, обладают абсолютной устойчивостью к действию фермента. Также, несмотря на высокую избирательность фермента, после длительной инкубации наблюдается частичный гидролиз по связям, образованным ароматическими аминокислотами (тирозин, фенилаланин, триптофан).
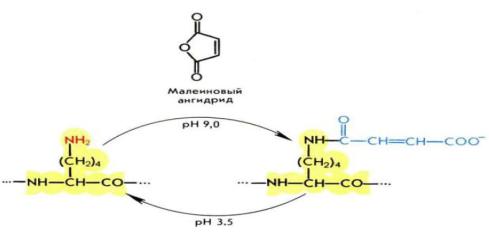
Введение заместителей в боковые цепи лизина и аргинина препятствуют гидролизу трипсином, позволяя выбирать между расщеплением связей, образованных одним из остатков. Модификацию лизина проводят с помощью ацилирования ангидридами дикарбоновых кислот. При этом происходит смена положительного заряда лизина на отрицательный заряд полуамида дикарбоновой кислоты:
В зависимости от природы используемого реагента модификация остатков лизина может быть как обратимой, так и необратимой. Для обратимой используется реакция с малеиновым или цитраконовым ангидридами. Регенерация остатков лизина в этом случае проводится путём понижения рН до 3,5 – в этих условиях полуамиды легко распадаются с деблокированием аминогруппы. Для необратимой модификации используется янтарный ангидрид.
Методы модификации остатков аргинина основаны на конденсации гуанидиновой группы с различными дикетонами и диальдегидами. Наиболее популярным блокирующим агентом является 1,2-циклогександион. Реакция протекает в мягких условиях в боратном буфере, при этом образуется устойчивый комплекс производного аргинина с боратом.
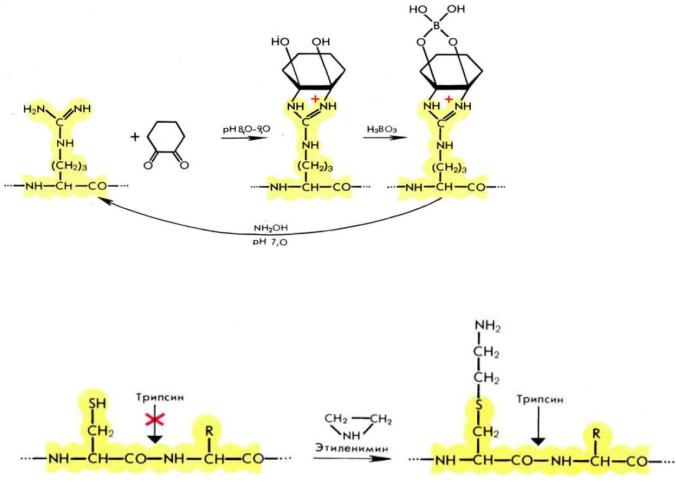
Модифицирующая группировка удаляется обработкой 0,5М гидроксиламином при рН 7,0, 37°С. С помощью хим. модификации можно также увеличить число гидролизуемых трипсином связей:
этого добиваются аминоэтилированием остатков цистеина этиленимином:
Пептидные связи, образованные карбокси-группой модифицированного цистеина, являющегося структурным аналогом лизина, способны расщепляться под действием трипсина, но с меньшей скоростью, чем каноничные пептидные связи.
Наряду с трипсином из поджелудочной железы выделяется химотрипсин – низкоспецифичная сериновая протеиназа, оптимум работы которой лежит в диапазоне рН 7,8-9,0. Фермент преимущественно катализирует гидролиз пептидных связей, образованных карбокси-группой ароматических аминокислот (тирозина, фенилаланина, триптофана). С меньшей скоростью гидролизуются пепт. связи лейцина, метионина, гистидина. Скорость расщепления может зависеть от природы соседствующего остатка.
Сериновая протеиназа, выделенная из St. aureus, имеет два оптимума работы: рН 4,0 и 7,8. Этот фермент расщепляет связи, образованные карбокси-группой глутаминовой кислоты. В ряде случаев гидролизу подвергаются и пепт. связи, образованные карбокси-группой аспарагиновой кислоты, особенно в случае соседства с гидрофобными остатками.
Уникальными свойствами обладает металлопротеиназа термолизин, содержащая цинк в качестве кофактора. Оптимум её работы лежит в диапазоне рН 7,0-9,0. Фермент невероятно устойчив: сохраняет свою активность в 8 М мочевине, при шестидесяти градусах и в 20%-ном растворе этанола. В отличие от большинства протеолитических ферментов, специфичность термолизина относится к остатку, которому принадлежит аминогруппа в пептидной связи. Таким образом, термолизин расщепляет пепт. связи, образованные аминогруппой гидрофобных аминокислот (изолейцин, лейцин, валин, фенилаланин, тирозин, триптофан). С меньшей скоростью гидролизуются связи с участием аланина и метионина.
Для избирательного расщепления белковой молекулы по остаткам лизина и аргинина широко используются новые ферменты. Один из них, лизин-специфическая протеиназа (из грибов Armilaria mellea), катализирует расщепление пепт. связи, образованной аминогруппой лизина. Клострипаин (Clostridium histolyticum) гидролизует связи, образованные карбокси-группой остатков аргинина.
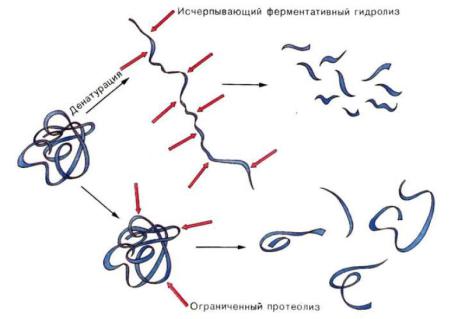
В арсенале современных исследователей также имеются менее специфичные ферменты (пепсин, папаин, эластаза, субтилизин, проназа и др.), которые используются для дополнительной фрагментации пептидов. Их субстратная специфичность определяется природой не только образующих пепт. связь остатков, но и более удаленных аминокислот.
Для исчерпывающего гидролиза необходимо денатурированное состояние белковой глобулы. В нативной конформации лишь часть сайтов могут быть задействованы в ферментативном гидролизе – проходит ограниченный протеолиз. Такие реакции повсеместны для организма – путём ограниченного протеолиза идёт активация многих проферментов.
3. Биоспецифическая модификация белков.
Модификации белков обычно проводятся с целью изучения взаимосвязи между структурой и функцией биополимерной молекулы. С этой целью могут предприниматься попытки химической модификации отдельных аминокислот, модификации с помощью бифункциональных реагентов, а также направленной биоспецифической модификации. Последняя модификация выделяется среди перечисленных своей точной адресацией (поэтому такой метод ещё называют аффинным мечением). Широко известно, например, использование субстратоподобных агентов для химического исследования природы и локализации активного центра ферментов и иных систем. Как биоспецифическую модификацию можно рассматривать и процессы посттрансляционной модификации белков в клетке (фосфорилирование, ацетилирование, гликозилирование, метилирование).
Реакционноспособные аналоги субстратов или других биоспецифических лигандов (гормонов, медиаторов, и др.) могут преимущественно или даже исключительно взаимодействовать с аминокислотными остатками, расположенными в активном центре фермента или белка-рецептора. В общем случае такие реагенты называются субстратоподобными. Так, например, этиловый эфир N- тозил-L-фенилаланина являетя субстратом химотрипсина. Аналог этого соединения – N-тозил-L- фенилаланилхлорметан является специфическим ингибитором – он селективно алкилирует остаток гистидина-57, расположенного в активном центре химотрипсина. Для изучения активности химотрипсина также использовался фенилметилсульфонилфторид, который избирательно реагирует с остатком серина-195. Так двумя путями уничтожалась возможность образования водородной связи между His57 и Ser195.
Реагенты для биоспецифической модификации белков часто содержат эпоксидную и диазогруппы. Так, для модификации химотрипсина применяется феноксиметилэтиленоксид, специфично взаимодействующий с остатком метионина-192.
