
Bilet_1
.pdf
2.Определение аминокислотной последовательности белков с помощью секвенаторов.
Секвенирование по Эдману (1960).
0)Необходимо разорвать все дисульфидные связи и защитить цистеины от повторного замыкания, всё очень хорошо почистить.
1)ФИТЦ (фенилизотиоцианат, мощный электрофильный агент) реагирует с незаряженной N-концевой аминокислотой в слабощелочных условиях, формируя ФТКпроизводное (фенилтиокарбомоил-производное).
Побочная реакция- в присутствии кислорода ФТКпроизводное пептидов десульфируется и не расщепляется. Также возможно блокирование аминогруппы альдегидами, находящимися в растворе с образованием основания Шиффа
2)При нагревании в безводной кислой среде происходит перестройка, циклизация продукта и отщепление пептида с образованием анилино-тиозолинон-производного и освобождении альфа аминогруппы.
Проблема здесь: если следующая аминокислота глутамин, то возможно превращение в пироглутамин, блокируется дальнейшая деградация.
А в случае связи Asn-Gly происходит образование циклического имида,затем альфа,бетатранспептидация, в итоге Эдман также блокируется.

Аминогруппа треонина серина легко гидролизуется в водной среде.Побочные реакии по остаткам аргинина и гистидина.
3) Анилино-тиазолинон экстрагируют из органического растворителя и добавляют к раствору водной кислоты, где формируется фенил-тиогидантоин – устойчивое производное аминокислоты, которое можно регистрировать с помощью хроматографии.
Существует большое число аналогов ФИТЦ, которые образуют тиогидантоины, обладающие рядом преимуществ по сравнению с ФТГ.
Наибольшее распространение получил (ДАБИТЦ).
В 1976 Эдманом и Бэггом был создан прототип автоматического жидкофазного секвенатора, где реакции были стандартизированы, был исключён контакт образца (нанесён на
твёрдую подложку из квадрола (нековалентно связан)) с воздухом, что привело к увеличению выхода реакции отщепления до 95%.
Далее группой под руководством Ларсена было придумана иммобилизация белка через различные боковые радикалы (в том числе по С-концу) на полистирольную матрицу (ковалентная иммобилизация). В 1981 году Худ и Ханкепиллер сконструировали газофазный секвенатор. Хитрая конструкция позволила значительно уменьшить расход реактивов, растворителей и исследуемого образца белка (до 100-500 пмоль).
Подробнее – со стр. 57 учебника Овчинникова.
3. N- и O-гликозилирование белков в гликопротеинах.
Гликопротеины – белки, содержащие ковалентно связанный углеводный компонент. Делят на 2 класса по количеству связанных олигосахаридных цепочек: протеогликаны – много сахара; собственно гликопротеины – много белка.
N-гликопротеины: Углеводный остаток присоединяется к амидному азоту остатка аспарагина (желательна непосредственная близость гидроксиаминокислот). Первым моносахаридом обычно оказывается N-ацетилглюкозамин, так что «узел» присоединения имеет следующую структуру:
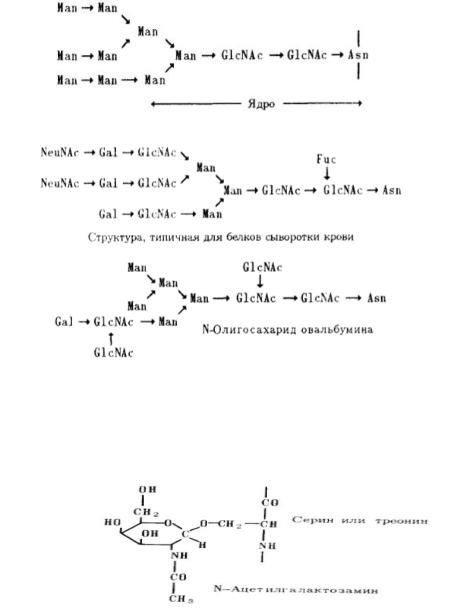
N-гликозидная связь легко расщепляется в кислой среде. В гликопротеинах этого типа к остатку аспарагина присоединен олигосахарид, в котором к «узловому» остатку N ацетилглюкозамина присоединен еще один остаток N-ацетилглюкозамина, далее следуют несколько остатков маннозы, галактозы, нейраминовой кислоты, фукозы и др. . Биосинтез N-гликопротеинов происходит в шероховатом ретикулуме, причём на амидную группу Asn переносится сразу большой-большой олигосахарид, включающий глюкозу, маннозу, ацетилглюкозамин, который подвергается процессингу (обязательное удаление глюкозы и удаление/добавление других сахаров).
Остается ядро, к которому присоединяются другие сахара.
Дальнейшие реакции специфичны, вот как пример
N-гликозилирование характерно для секреторных белков, попадающих в ЭПР, хотя оно не является непременной предпосылкой секреции.
O-гликопротеины
Углеводный остаток присоединяется к оксигруппе Ser или Thr (однозначного сиквенса для гликозилирования нет). Первый моносахарид – N-ацетилгалактозамин.
Биосинтез ступенчатый, всё по порядку, количество моносахаридов не такое большое. О- гликозилирование свойственно веществам, определяющим группу крови (муцины).
Углеводный компонент почти никогда не входит в состав каталитического центра, наличие гликозилирования обычно не влияет на скорость ферментативной реакции. Зато олигосахариды в составе гликопротеинов участвуют в процессах межклеточного узнавания, дифференциации, трансформации клеток, связывании гормонов с рецепторными белками.
Билет 10 1. Сортинг белков в эу-клетке. Сигнальные пептиды. Везикулярный транспорт.
Контрансляционный транспорт в ЭПР Осуществляется по мере синтеза белка. Сигнальная последовательность – 5-10 обычно
гидрофобных аминокислот на N-конце + последовательность для протеазки на удалённом участке. После синтеза сигнальной последовательности в цитоплазме, комплекс SRP (signal-recognition particle) блокирует трансляцию и связывает рибосому с SRP-рецептором на ЭПР. Далее комплекс мРНК-рибосома-SRP связывается с транслокатором, происходит диссоциация SRP, трансляция возобновляется, белок направляется внутрь ЭПР. После окончания трансляции рибосома уходит в цитозоль, сигнальная последовательность (гидрофобная, держится в мембране) отрезается протеазой, белок же оказывается в ЭПР, где претерпевает необходимый фолдинг.
Посттрансляционный транспорт в ЭПР Транспорт, при котором полностью синтезированный белок связывается в цитозоле с
шаперонами, а затем переносится в ЭПР через транслокатор при участии шаперонов семейства Hsp70. Этот вид транспорта является АТФ-зависимым. Для транспорта пептидов (длиной 8-16 аминокислот) из цитозоля в ЭПР для последующей их презентации в комплексе с молекулами MHC-I существует специальный транслокатор — TAP-белок.
Транспорт белов из ЭПР в АГ (аппарат Гольджи)
Белки поступают из ЭПР в АГ внутри окаймленных мембранных пузырьков, оболочка которых образуется из белка COP-II. Все правильно свернутые перемещаются в АГ. Однако белки со специальными сигнальными метками концентрируются в транспортных пузырьках. Отделившиеся от ЭПР пузырьки, сливаются в трубчато-везикулярные кластеры, которые с помощью моторных белков перемещаются по микротрубочкам к АГ. От этих кластеров отделяются пузырьки, одетые белком COP-I, обеспечивающие обратный транспорт белков в ЭПР. Возврат белков в ЭПР обеспечивается короткой сигнальной последовательностью на их С-конце, которая связывается либо непосредственно с COP-I (для мембранных белков), либо со специфическим рецептором, взаимодействующим с COP-I (для растворимых белков). Лишенные этих последовательностей белки преимущественно остаются в АГ.
Внутри пузырьков белки постепенно перемещаются из цис-Гольджи в транс-Гольджи. По мере перемещения белков внутри АГ ферменты гликозилтрансферазы осуществляют модификацию их олигосахаридных «меток».
Транспорт белков из АГ в лизосомы.
Мембранные белки и пищеварительные ферменты лизосом поступают из транс-Гольджи в составе окаймленных клатрином пузырьков в раннюю эндосому, а оттуда — в лизосомы. Для попадания лизосомальных ферментов в лизосомы на них должна присутствовать специальная метка
— остатки маннозо-6-фосфата на концах олигосахаридных цепей. Метка наносится на те белки, которые имеют специфические черты третичной структуры — «сигнальный бугорок». Затем маннозо-6-фосфаты опознаются специфическим мембранным рецептором, к которому присоединяются гидролазы. В эндосомах при понижении рН гидролазы отделяются от рецепторов, которые в составе специальных пузырьков доставляются обратно а АГ.
Транспорт в ядро (см. билет №9)
Транспорт в митохондрии
До наружной мембраны митохондрии пре-белки транспортируются в частично развёрнутом состоянии в ассоциации с белками-шаперонами (в частности — с hsp70). После переноса через наружную и внутреннюю мембраны, поступающие в митохондрию белки вновь связываются с шаперонами, но уже собственного митохондриального происхождения. Сам механизм немного похож на ядерный импорт, белки переносчики называются TOM (Translocase of Outer Membrane). Сигнал локализации удаляется митохондриальным Hsp70.

Билет 10 1. Сортинг белков в эукариотической клетке. Сигнальные пептиды. Везикулярный транспорт.
Биосинтез белков начинается на свободных рибосомах . Однако вскоре пути синтезируемых белков расходятся в соответствии с их функцией: белки, несущие на N-конце сигнальный пептид для ЭР , проходят через секреторный путь, а прочие белки, не имеющие этой сигнальной последовательности, следуют по цитоплазматическому пути .
Секреторный путь. Рибосомы, синтезирующие белок с сигнальной для ШЭР последовательностью, связаны с мембраной ЭПР. Растущая пептидная цепь направляется через мембрану в просвет ШЭР. Последующий путь растущей цепи определяется наличием соответствующего сигнального пептида или сигнального участка - разные вещи-
Белки, имеющие в растущей цепи специальную стоп-сигнальную последовательность (4), остаются в мембране ШЭР в качестве интегрального мембранного белка. По механизму везикулярного транспорта они могут быть перенесены из ШЭР на другие органеллы
Белки, попавшие в просвет ШЭР, транспортируются обычным путем в аппарат Гольджи и далее
вплазматическую мембрану. Белки, которые остаются в ШЭР, например ферменты модификации белков, возвращаются из аппарата Гольджи в ШЭР с помощью сигнала возврата (2)
Прочие белки из аппарата Гольджи попадают в лизосомы или в плазматическую мембрану (в качестве интегральных мембранных белков или продуктов конститутивного экзоцитоза), либо транспортируются секреторными везикулами (8) в межклеточное пространство (9; регулируемый экзоцитоз).
Цитоплазматический путь. Белки, не имеющие сигнального пептида для ШЭР, синтезируются
вцитоплазме на свободных рибосомах и остаются в этом отделе клетки. Для последующего
транспорта в митохондрии, ядро или пероксисомы белки
должны |
иметь |
специальные |
сигнальные |
последовательности.
Сигналы для сортировки белков Сигнальные пептиды — это короткие участки,
расположенные на N- и С-концах, реже — в центральной части полипептидной цепи. Эти фрагменты имеют характерные физико-химические свойства, такие, как гидрофобный характер, наличие положительного или отрицательного заряда, более важные в функциональном отношении, чем аминокислотная последовательность.
Сигнальные участки представляют собой трехмерные структуры на поверхности белка, составленные из
различных фрагментов одной и той же или нескольких
пептидных цепей. На схеме показаны некоторые из известных сигнальных последовательностей и сигнальных участков. Последовательности даны с использованием однобуквенного кода для аминокислот. Например, последовательность KDEL-COO- (2) определяет сродство белка к мембране ШЭР.
Сигнальные пептиды (участки) — это структурные сигналы, которые могут быть прочитаны клеткой двумя способами. Обычно они узнаются и связываются рецепторами, локализованными в мембранах органелл. Затем рецепторы при участии белков-посредников переносят связанные белки энергозависимым образом через мембраны в соответствующие органеллы, обеспечивая селективность переноса. Кроме того, сигнальные последовательности могут служить местами узнавания для ферментов, которые модифицируют белки, существенно изменяя их свойства и дальнейшую судьбу, в качестве примера можно привести белки лизосом или мембранные белки с липидным якорем.
Сигнальные пептиды, расположенные на N- или С-концах полипептидной цепи, после выполнения своей функции удаляются специфичными гидролазами. При наличии в белке нескольких сигнальных последовательностей они удаляются поочередно. Это имеет место, например, в случае импорта белков в митохондрии и хлоропласты, когда большинству белков приходится последовательно проходить через несколько мембран.
2. Химическая модификация аминогрупп в белках.
Подробно стр. 186 учебника Степанова, стр 161 учебника Овчинникова
Тип реакции |
Реактив |
А зачем? |
|
|
|
|
Ацилирование |
|
Ангидриды кислот |
Необратимая модификация |
|
||
|
|
Цитраконовый |
Обратимая |
модификация лизина |
для |
|
|
|
альдегид |
гидролиза трипсином только по остаткам |
|||
|
|
|
Arg |
|
|
|
Арилирование |
|
2,4-динитрофтор- |
Замена гидрофильной |
аминокислоты |
на |
|
|
|
бензол |
гидрофобную, |
введение |
флуоресцентной |
|
|
|
|
метки |
|
|
|
Образование |
реактивов |
Альдегиды, NaBH4 |
Добавление функциональной группировки |
|||
Шиффа |
с |
|
на ε-конец Lys |
|
|
|
восстановлением |
|
|
|
|
|
|
Реакция |
с |
Имидоэфиры |
Введение гидрофобного заместителя или |
|||
имидоэфирами |
|
CH3-O-C(=NH)-R |
увеличение заряда в данной точке молекулы |
|||
Гуанидирование |
H3C-O-C(=NH)- |
лизин -> гомоаргинин |
|
|
||
|
|
NH2 |
|
|
|
|
Карбамоилирование |
KN=C=O |
Секвенирование |
|
|
||
Дансилирование |
Дансил хлорид |
Добавление флуоресцентной метки |
|
|||
3. Время жизни белков в цитозоле клетки. Шапероны Hsp90.
Время жизни белков – от минут (факторы транскрипции, циклины) до дней, пока их не уничтожит протеасома.
Hsp90 – шаперон, занимающийся фолдингом, противостоящий тепловому шоку и помогающий в деградации белков. Консервативен, найден в бактериях и эукариотах (нет в археях).
Белок содержит 4 структурных домена:
Высококонсервативный N-концевой домен ~25 кДа. Содержит АТФ-связывающий карман;
Линкер с большим количеством заряженных аминокислот;
Средний домен ~40 кДа. Место связывания различных белков;
С-концевой домен ~12 кДа. Альтернативный АТФ-связывающий карман.
В открытом состоянии (АТФ связан) Hsp90 снаружи содержит гидрофобные участки и неверно фолдированные белки прекрасно с ними связываются. После связывания происходит гидролиз АТФ, изменения конформации шаперона и «зажимание» нефолдированного белка. Если белок не развернулся правильно, то Hsp90 навешивает на него убиквитиновые метки.
Билет №11 1. Импорт белков в митохондрии.
Чтобы попасть в митохондрию, белок должен иметь специальный направляющий сигнал (targeting signal). Некоторые белки, предназначенные для внутренней мембраны митохондрий или межмембранного пространства, как и белки наружной мембраны, имеют внутренние сигналы, которые еще не идентифицированы. Другие белки митохондриальной внутренней мембраны и большинство белков митохондриального матрикса синтезируются в цитозоле в виде предшественников, содержащих сигнальную последовательность из 12-70 аминокислот на N-конце (это пресиквенс). Обычно такие последовательности удаляются после импорта и называются сигнальными (транзиторными) пептидами. Это последовательности содержат много положительно заряженных аминокислот, которые могут образовывать α-спирали, в которых одна сторона заряжена положительно, а другая гидрофобна. Направляющим сигналом является, скорее, не определенная аминокислотная последовательность, а именно трехмерная структура амфифильной α-спирали.
Для импорта белка в матрикс ему необходимо пройти внутреннюю и внешнюю мембраны. Перенос белка осуществляется в так называемых сайтах транслокации, в которых обе мембраны находятся близко друг к другу. Каждая из них содержит собственный аппарат транслокации, который переносит белок в развернутом состоянии.
Белок-предшественник синтезируется на рибосомах и далее ассоциируется с шаперонами (напр., с цтБТШ70). Связывание с цтБТШ70 сопровождается гидролизом АТФ. Транспорт через внешнюю мембрану осуществляется ТОМ-комплексом, который состоит по меньшей мере из 8 различных белков. Субъединицы ТОМ20 и ТОМ22, возможно, участвуют с распознавании направляющей сигнальной последовательности. Возможно, в специфическое распознавание сигнала включены электростатические взаимодействиямежду положительно заряженной стороной α-спирали сигнальной последоваетельности и отрицательно заряженной поверхностью ТОМ22. Затем ТОМ20 и ТОМ22 участвуют в передаче полипептидной цепочки в транслокационную пору. Еще одним участником транспорта белков в митохондрии является ТОМ70. Он опосредует проникновение белка АТФ/АДФ-транслокатора и др белков-переносчиков внутренней мембраны. Такие белки содержат внутреннюю сигнальную последовательность, а не лидерную N-концевую. Возможно, что в формировании транслокационной поры участвуют также белок ТОМ40 и мелкие субъединицы ТОМ5,6,7.
Последующий транспорт через внутреннюю мембрану происходит с участием комплекса TIM. Он состоит из белков TIM 17,23,44 и некоторых др, еще не идентифицированных субъединиц. Для транспорта белков через внутреннюю мембрану нужно еще одно дополнительное условие: мембранный потенциал Δφ. Видимо, положительный заряд лидерной последовательности (пресиквенса) и отрицательным заряд со стороны матрикса на внутренней мембране способствуют прохождению пептида через транслокационную пору. Пептидная цепочка попадает в матрикс, где она вначале связывается с TIM44. После этого она связывается с шапероном мтБТШ70, что сопровождается гидролзом АТФ, и с др шаперонами. Проникновение пептидной цепочки через транслокационную пору происходит в результате теплового движения. Немедленное связывание с внутренним мтБТШ70 предотвращает обратный выход белка.
Когда полипептидная цепь полностью переходит в матрикс, N-концевая направляющая последовательность (пресиквенс) немедленно отрезается специальной пептидазой, осуществляющей процессинг белка. Сворачивание белков матрикса происходит с помощью супершаперонного комплекса БТШ60 и БТШ10.
Белки, предназначенные для наружной мембраны митохондрий, могут встраиваться в нее сразу после связывание с рецепторными субъединицами ТОМ-комплекса.
В большинстве случаев после транспорта через внешнюю мембрану белки, предназначенные для внутренней митохондриальной мембраны, встраиваются в нее сразу из межмембранного

пространства. Но в некоторых случаях белки могут содержать сигнальную последовательность, которая сначала направляет их в пространство матрикса. После удаления этого пресиквенса пептидазами такие белки встраиваются со стороны матрикса во внутреннюю мембрану с помощью второго сигнального пептида.
2. Особенности синтеза циклических пептидов. Современные возможности пептидного синтеза. Проблема рацемизации при синтезе.
Синтез циклопептидов Для получения циклических пептидов используются обычные для пептидного синтеза методы
создания амидной связи. Чаще всего первоначально создается линейный предшественник в виде защищенного пептида, активируется С-концевая карбоксильная группа, освобождается N-концевая аминогруппа и проводится реакция аминолиза собственной аминогруппой пептида. Для уменьшения межмолекулярных реакций аминолиза, приводящих к полимеризации и вследствие этого циклоолигомеризации, реакции циклизации проводят в условиях высокого разбавления в инертных растворителях.
Реакция циклоолигомеризации
Однако, как правило, побочные реакции полимеризации всегда имеют место и уменьшают выход циклического продукта. Лучшие результаты дает метод получения циклопептидов на полимерном носителе.
Выход циклических продуктов сильно зависит от стерических факторов: напряженности образующегося цикла, разветвленности боковых радикалов, термодинамических и конформационных параметров.
Рацемизация, т. е. полная или частичная потеря оптической чистоты одного или более аминокислотных остатков, является главной побочной реакцией в пептидном синтезе, накладывающей жесткие ограничения на выбор защитных групп и методов конденсации. Рацемизация приводит к образованию оптически неоднородных продуктов, разделение которых по мере удлинения цепи резко осложняется и превращается в практически неосуществимую задачу. Реакция рацемизации протекает по двум механизмам: 1) через образование 5(4Н)-оксазолонов (часто называемых азлактонами) или 2) через енолизацию:

В общем случае степень инверсии у α-углеродного атома (рацемизации) определяется природой заместителей X, R, Y, температурой и рН среды. Аминокислоты и их неактивированные производные заметно рацемизуются в сильнокислой или щелочной среде, особенно при нагревании. Активированные производные аминокислот более подвержены рацемизации как в процессе их получения, так и в ходе аминолиза. Особенно легко рацемизуются производные пептидов, что осложняет проведение конденсации фрагментов. Следует отметить, что уретановые N-защитные группировки аминокислот (в том числе наиболее популярные Z- и Вос-группы) обладают низкой склонностью к образованию оксазолонов. Поэтому ступенчатый синтез с использованием этих групп
— один из наиболее надежных путей избежать рацемизации при синтезе пептидов.
3. Пренилирование белков. Другие типы липопротеинов.
Пренилирование — присоединение остатков изопреноидов (фарнезила и геранилгеранила). Как написано у меня в тетради:
Пренилирование происходит в ЭПР, там образуются изопрены, они могут полимеризоваться: 4 изопрена – геранил-геранил, 3 изопрена – фарнезил, 2 изопрена – геранил.
Хвост геранила или фарнезила отвечает за встраивание в мембрану.
ипопротеины (липопротеиды) — класс сложных белков, простетическая группа которых представлена каким-либо липидом. Так, в составе липопротеинов могут быть свободные жирные кислоты, нейтральные жиры, фосфолипиды, холестериды.
Липопротеины представляют собой комплексы, состоящие из белков (аполипопротеинов) и липидов, связь между которыми осуществляется посредством гидрофобных и электростатических взаимодействий. Липопротеины подразделяют на свободные, или растворимые в воде (липопротеины плазмы крови, молока и др.), и нерастворимые, т. н. структурные (липопротеины мембран клетки, миелиновой оболочки нервных волокон, хлоропластов растений).
Среди свободных липопротеинов (они занимают ключевое положение в транспорте и метаболизме липидов) наиболее изучены липопротеины плазмы крови, которые классифицируют по их плотности. Чем выше содержание в них липидов, тем ниже плотность липопротеинов. Различают липопротеины очень низкой плотности (ЛОНП, 30-80 нм), низкой плотности (ЛНП, 18-26 нм), промежуточной (средней) плотности ЛПП (ЛСП, 25-35 нм), высокой плотности (ЛВП, 8-11 нм) и хиломикроны (75-1200 нм). Каждая группа липопротеинов очень неоднородна по размерам частиц (наиболее крупные — хиломикроны) и содержанию в ней апо-липопротеинов. Все группы липопротеинов плазмы содержат полярные и неполярные липиды в разных соотношениях.
Транспорт холестерина от периферийных тканей к печени - ЛВП, транспорт холестерина, триацилглицеридов и фосфолипидов от печени к периферийным тканям – остальные, хиломикроны - транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень.
Нековалентная связь в липопротеинах между белками и липидами имеет важное биологическое значение. Она обусловливает возможность свободного обмена липидов и модуляцию свойств липопротеинов в организме.
Липопротеины являются структурными элементами мембран клеток животных организмов и транспортными белками холестерина и других стероидов, фосфолипидов и др.

Билет №12 1. Неферментативные посттрансляционные модификации белков. ???
Гликирование, или неферментативное гликозилирование, — реакция Майяра, происходящая с участием белков организма. В процессе этой реакции между восстанавливающей (открытой) формой сахара крови или клетки (глюкоза, фруктоза и др.) и амино-группами белков (лизина или N- концевой амино-группы) образуется продукт Амадори, или фруктозамин, который в процессе дальнейших реакций и преобразований превращается в т.н. «поздние продукты гликирования».
Гликирование многих белков способно нарушать их функционирование и приводить к патологическим последствиям. Гликирование гемоглобина (HbA1c) широко используется как кумулятивный показатель содержания глюкозы в крови при диагностике диабета.
3.D и L формы аминокислот медленно превращаются друг в друга. Смесь таких кислот называется рацематом. Например, в белке дентина ( костная ткань зубов) L-аспарагиновая кислота самопроизвольно превращается в D со скоростью 0.1% в год.
4.Накопление в веществе хрусталика продуктов модификаций ароматических аминокислоттирозина и триптофанакинуренина. Является фотосенсибилизатором, это в свою очередь приводит
кусилению процессов перекисного окисления липидов хрусталика за счет постоянной генерации на свету активных форм кислорода.
2.Образование пептидной связи: методы смешанных ангидридов и активированных эфиров, карбодимидный и карбоксиангидридный методы конденсации.
Образование пептидной связи в общем сводится к отщеплению элементов воды. Для того чтобы сделать эту реакцию возможной и, более того, обеспечить ее высокую скорость и полноту, необходимо активировать карбоксильную группу. Такая активация должна сводиться к увеличению электрофильности карбонильного углерода (С6 + ).
Как легко видеть, важная роль в этом случае принадлежит группе X', которая в конечном счете определяет эффективность активации. Методы конденсации
обычно различаются природой группы.
1)Методы смешанных ангидридов аминокислот.
Хлорангидридный метод. Хлорангидридный метод, упоминавшийся в историческом очерке, в настоящее время применяется редко, так как сопровождается рацемизацией и образованием побочных продуктов. Хлорангидриды получаются обычно обработкой производных аминокислот и пептидов хлористым тионилом или пятихлористым фосфором.
